修回日期: 2010-05-01
接受日期: 2010-05-10
在线出版日期: 2010-06-08
目的: 探讨survivin在肝细胞癌(HCC)组织中的表达及其与临床病理资料的关系.
方法: 采用免疫组织化学及半定量RT-PCR检测76例HCC组织中survivin表达情况, 分析其与临床病理资料的关系; 应用Kaplan-Meier法及多变量Cox比例风险模型, 分析survivin表达与预后的关系.
结果: 76例HCC组织中survivin阳性表达53例, 表达率69.74%; 肝癌组织survivin mRNA表达明显高于癌旁组织(0.782±0.284 vs 0.251±0.064, P<0.01); survivin阳性表达与HBsAg阳性、Edmondson等级、门静脉癌栓及肿瘤数目相关, 与肝硬化、肿瘤大小、AFP水平及假包膜无关. survivin阳性组与阴性组术后的1, 2, 3年的生存率分别为62.0%、40.7%及19.0%和85.9%、59.3%及50.8%(P = 0.025). 在多变量回归COX分析显示: survivin阳性表达、门静脉癌栓及肿瘤数目是肝癌预后的高危因素, 危险度分别为值分别为为1.702、1.994及6.391.
结论: survivin过表达可能参与了肝癌的形成和发展, survivin基因的检测有助于有高危肝癌患者的选择, survivin有望成为肝癌治疗的新靶点.
引文著录: 林辉, 何自力, 钟德玝. 肝细胞癌survivin表达与临床相关性. 世界华人消化杂志 2010; 18(16): 1676-1681
Revised: May 1, 2010
Accepted: May 10, 2010
Published online: June 8, 2010
AIM: To analyze the clinical significance of survivin expression in hepatocellular carcinoma (HCC).
METHODS: The expression of survivin was examined by immunohistochemistry and semiquantitative RT-PCR in 76 HCC specimens. The correlation between survivin expression and clinicopathological parameters in HCC were analyzed. Survival data were analyzed using the Kaplan-Meier method and multivariate Cox proportional hazards model.
RESULTS: The positive rate of survivin protein expression in HCC was 69.74% (53/76). The relative expression level of survivin mRNA in HCC tissue was significantly higher than that in tumor-adjacent normal tissue (0.782 ± 0.284 vs 0.251 ± 0.064, P < 0.01). The positive expression of survivin was correlated with HbsAg positivity, Edmondson grade, portal vein tumor thrombus (PVTT) and tumor number in HCC, but not with cirrhosis, alpha-fetoprotein level, tumor size and pseudocapsule. The 1, 2, 3-year survival rates were 62.0%, 40.7% and 19.0% in survivin-positive group and 85.9%, 59.3% and 50.8% in survivin-negative group, respectively (P = 0.025). Multivariate Cox regression analysis showed that the positive expression of survivin, PTVV and tumor number were significant prognostic factors for HCC, and the risk ratios were 1.702, 1.994 and 6.391, respectively.
CONCLUSION: Overexpression of survivin may be involved in the development and progression of HCC. Detection of survivin expression will be helpful in selecting high-risk HCC patients. Survivin may be a promising target for HCC therapy.
- Citation: Lin H, He ZL, Zhong DW. Clinical significance of survivin expression in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(16): 1676-1681
- URL: https://www.wjgnet.com/1009-3079/full/v18/i16/1676.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i16.1676
肝细胞肝癌(hepatocellular carcinoma, HCC)是全球第五大恶性肿瘤, 死亡率居世界第三位[1]. 近年来, 我国肝癌发病率呈上升趋势, 已超过非洲居世界首位. 全世界每年新增加的肝癌病例约60万例, 其中40%发生在我国[2]. HCC早期缺乏典型的临床表现, 早期就可能就存在肝内转移, 导致术后的复发率居高不下. 此外肝癌患者多伴有肝炎、肝硬化背景, 容易造成严重的肝功能损害, 使得肝癌的生存率低下, 即使是根治性手术切除, 5年生存率仅为20%-30%[3]. 因此, 研究肝癌发生发展的机制十分必要. survivin是1997年发现的一个肿瘤特异性凋亡抑制因子[4], 是凋亡抑制蛋白家族(inhibition of apoptosis proteins, IAPS)中作用最强的分子[5]. survivin与肿瘤发生、发展、侵袭、转移及细胞通路等密切相关[6-8], 已成为研究肿瘤分子生物学和肿瘤演进的一个重要领域. 我们自2006-01-01起, 监测76例HCC手术患者survivin的表达及预后, 现报道如下.
76例HCC患者的标本为中南大学湘雅二医院2006-01/2009-05手术切除获取. 其中男66例, 女10例, 年龄在28-62(中位年龄38)岁. 所有标本在离体30 min内新鲜取材, 液氮固定, -70 ℃冰箱保存待用. 手术后均进行了随访, 随访率100%. 随访起始时间为手术治疗开始日起, 观察终止时间为2009-12-31. 引物(Sangon公司)RT-PCR试剂盒(Promega公司), 兔抗人survivin mAb(Biolegend公司), ECL试剂盒(GE公司)、蛋白提取试剂盒(Millipore公司)、TRIzol(Invitrogen公司)、Super Script试剂盒(Invitrogen公司).
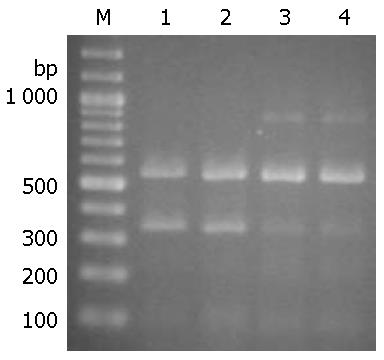
1.2.1 RT-PCR: 引物设计, 根据survivin, β-actin的mRNA序列, 应用在线引物设计软件Primer3设计相关引物(表1). 按厂家说明书, 取肝癌组织50-100 mg用匀浆器彻底匀浆后, 在冰上加入l mL TRIzol, 离心后加入0.2 mL氯仿. 用Super Script试剂盒提取RNA. 将逆转录产物cDNA于95 ℃变性5 min后, 行PCR扩增. 扩增产物行琼脂凝胶电泳, EB染色用凝胶图像分析仪分析结果.
| 目的基因 | 片段长度 | 引物序列 |
| survivin | 393 bp | 上游: 5'-CTTTCTCAAGGCCACCGCATC-3' |
| 下游: 5'-CAATCCATGGCAGCCAGCTGC-3' | ||
| β-actin | 550 bp | 上游: 5'-CGCGAGAAGATGACCCAGAT-3' |
| 下游: 5'-GCACTGTGTTGGCGTACAGG-3' |
1.2.2 免疫组织化学检测: 手术标本经4 mm厚连续切片. survivin的免疫组织化学染色行链霉素亲和素-过氧化酶复合物法(SP法). survivin Ab(Sigma)工作液浓度为1:100, SP免疫组织化学试剂盒为Zymed公司产品, 实验程序严格按照说明书进行. TBS代替一抗作为阴性对照. survivin阳性判断标准以肿瘤细胞胞质中染成淡黄或棕黄色为阳性.
统计学处理 用SPSS16.0 for Windows统计软件包进行统计分析, 用Perason Chi-square检验各病理因素与survivin的关系, 用Kaplan-Meier法描述生存曲线, 用Log-rank法进行统计学意义检验, 用Cox比例危险度模型作多因素预后分析. P<0.05认为有显著性差异.
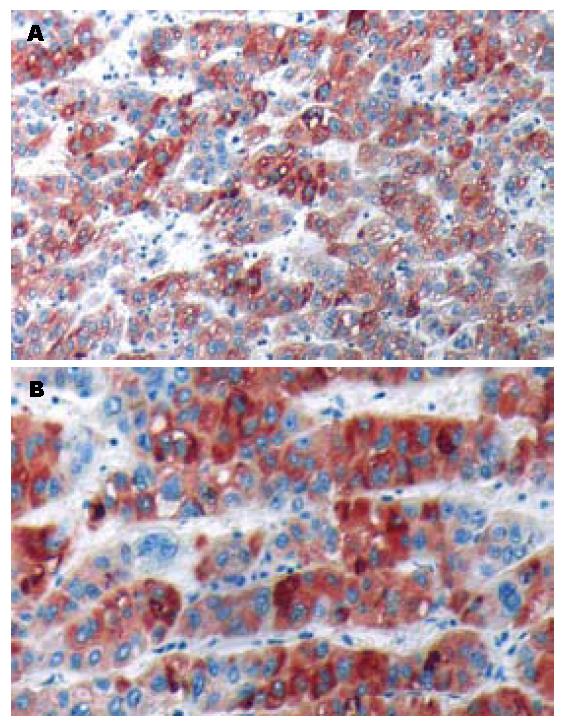
76例HCC患者的标本的survivin的阳性表达53例, 阳性表达率为69.74%. survivin在肝癌细胞的胞质和细胞核均呈阳性表达. 肿瘤细胞的异形性越明显, 肿瘤胞质和细胞核的染色越深(图1).
76例HCC组织survivin mRNA癌组织中表达为0.782±0.284, 明显高于癌旁组织0.251±0.064(P<0.01, 图2).
用Perason Chi-square检验各病理因素与survivin的关系, 结果显示survivin的阳性表达和HBsAg阳性、Edmondson等级、门静脉癌栓、及肿瘤数目相关, 而与肝硬化、AFP、假包膜、肿瘤大小等临床病理因素无相关性(表2).
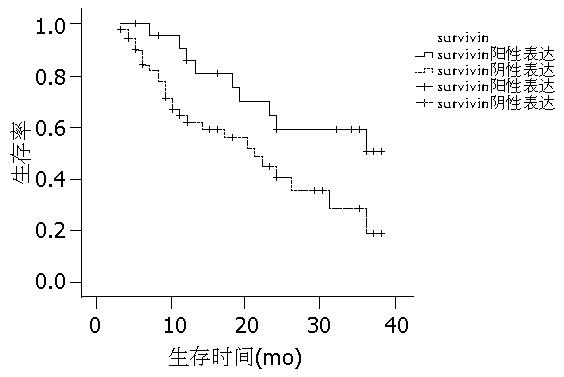
本组76例HCC患者1、2、3年总的生存率为69.4%、48.9%及32.2%. survivin基因阳性组1、2、3年生存率为62.0%、40.7%及19.0%, survivin基因蛋白阴性组1、2、3年生存率为85.9%、59.3%及50.8%, 两者有明显的差异性(P = 0.025, 图3).
我们采用Kaplan-Meier法分析HCC预后的单因素相关因子, 结果显示: 其与survivin阳性表达、Edmondson分级、肉眼癌栓、显微癌栓及肿瘤数目相关; 而与HBsAg、肝硬化、AFP、假包膜、肿瘤大小无关(表3); 多因素Cox回归分析结果显示: survivin基因蛋白表达、PVTT及肿瘤数目是反映肝癌预后的独立危险因素, 其危险度分别为1.702、1.994及6.391(表4).
| 分组 | 阳性定义 | P值 |
| survivin | 胞质阳性表达 | 0.025 |
| HbsAg | 阳性 | 0.990 |
| PVTT | 存在 | 0.003 |
| Edmondson等级 | Ⅲ-Ⅳ | 0.010 |
| 肿瘤数目 | 2个以上 | 0.000 |
| 肝硬化 | 存在 | 0.511 |
| 假包膜 | 存在 | 0.317 |
| AFP(μg/L) | >400 | 0.130 |
| 肿瘤大小(cm) | >5 | 0.112 |
| Sig | Exp(B) | 95%CI | ||
| Lower | Upper | |||
| survivin阳性表达 | 0.043 | 1.702 | 1.019 | 3.569 |
| Edmondson等级 | 0.058 | 2.121 | 0.974 | 4.617 |
| 肿瘤数目 | 0.000 | 6.391 | 2.884 | 14.162 |
| PVTT | 0.037 | 1.994 | 1.238 | 4.236 |
原发性肝癌是我国常见恶性肿瘤之一, 每年我国死于原发性肝癌的患者约有11万, 居恶性肿瘤病死率的第2位[9]. 其中HCC占原发性肝癌90%以上, 其起病隐匿, 侵袭性生长快速, 预后差, 近些年来其发病率和死亡率有逐年升高的趋势. 目前, 随着分子生物学的迅猛发展, 新兴的分子靶向技术为肝癌的治疗带来了曙光. 这些研究主要集中于血管信号的转导、原癌基因的抑制、肿瘤凋亡的促进及细胞周期的调控等等. 他们之间相互穿插、融合, 共同参与肿瘤的发生与发展[10,11]. 由于survivin与肿瘤增殖、凋亡、转移、侵袭等密切相关, 目前为肿瘤研究的热点. survivin在成熟的组织中表达沉默, 在胸腺[12]、胚胎[13]、造血干细胞[14]及分泌期子宫内膜等分裂旺盛的组织中有微弱表达, 在绝大多数肿瘤组织及转化的肿瘤细胞系中过量表达. survivin的这种高选择性分布特点其与参与细胞增殖分化有关[15-17], 可能促进了肿瘤的发生发展[18,19].
目前认为survivin促进肿瘤发生发展的机制大致可分为三个方面: (1)促进细胞增殖. survivin能与CDK4结合后, 导致CDK2/cyclinE活化和Rb磷酸化, 加快G1→S期的转换, 促进细胞分化[20,21]; 能逃避G2/M期凋亡监视点, 抵抗因DNA损伤或突变自身诱导的细胞凋亡, 通过有丝分裂促进细胞的异常增殖[22,23]; 还能与纺锤体的微管结合, 维持了纺锤体的稳定性, 间接促进细胞增殖[24,25]. (2)抑制细胞凋亡. survivin是抑制凋亡蛋白家族中作用最强的分子, 他能通过抑制死亡受体途径直接抑制凋亡终末效应器caspase-3、caspase-7的活性, 阻断各种刺激诱导的细胞凋亡过程[26,27]; 也能通过线粒体/细胞色素C途径干扰上游caspase-9的活化过程, 间接抑制其对下游效应分子caspase-3的活化[28,29]; 他也能通过p21途径与CDK4形成复合体后, 释p21并通过p21与caspase-3结合而抑制其活性[30]. (3)转移与侵袭. survivin通过上调VEGF促进肿瘤血管的形成[31]; 促进MMPs家族的表达[32]、抑制HSP70从而间接抑制p38-MAPK信号传导通路等机制促进肿瘤侵袭和转移[33].
鉴于survivin在肿瘤发生发展中的重要作用, 我们试从临床病理的角度探讨survivin表达与肝癌的关系. 2006-01/2009-05我们检测76例HCC标本的survivin的表达情况并观测其预后. survivin的阳性表达53例, 阳性率为69.74%. RP-PCR检测显示肝癌组织的survivin mRNA表达明显高于癌旁组织, 这些结果提示肝癌可能与survivin阳性表达相关.
同时我们也观测到, 在肿瘤胞质和细胞核中, survivin均有表达. 细胞的异形性越明显, 肿瘤胞质和细胞核的survivin染色越深, 与Edmondson等级相关. 提示在细胞恶性转化过程中, survivin可能作为一种转录因子参与胞质及胞核间移位. 本试验采用肿瘤胞质的阳性表达为肿瘤预后的观测指标. 进一步比较肝癌的临床病理资料和survivin阳性表达的关系. 结果显示: 这种阳性表达与HBsAg阳性、Edmondson等级、门静脉癌栓、及肿瘤数目相关, 而与肝硬化、AFP、假包膜、肿瘤大小等临床病理因素无相关性.
关于survivin与HBsAg的研究, Marusawa等[34]认为survivin与HBXIP的复合体可能参与乙型肝炎病毒抗凋亡的调节. Zhang等[35]认为乙型肝炎病毒X蛋白能够上调survivin的表达. 结合本试验的统计资料: survivin的表达与HBsAg阳性在x临床病例上具有相关性. 我们推断survivin可能乙型肝炎病毒相互作用, 共同参与了肝癌的发生发展. survivin阳性表达还与门静脉癌栓及肿瘤数目相关. 关于肝癌的门静脉癌栓与肿瘤数目的指标, 众多学者认为他们可以代表肝癌侵袭和转移程度和时效. survivin阳性表达与他们相关, 说明这种阳性表达可能与肝癌的侵袭和转移相关, 但具体机制仍待进一步研究. 最后, 我们用Kaplan-Meier分析比较survivin阳性组和阴性组的1, 2, 3年生存率的差异, 结果提示阳性组的生存率明显低于阴性组. 多因素Cox回归分析提示survivin基因阳性表达是肝癌预后的独立危险因素. 这些结果进一步说明survivin的阳性表达影响着肝癌的生存率, 提示干预survivin基因的靶向治疗可能提高患者的生存及生活质量.
目前, survivin研究已经深入基础的各个方面. 小分子抑制剂、siRNA等相关技术探讨survivin机制的研究不断取得新的进展. 关于survivin基因的靶向治疗可能为肝癌的治疗提供一片广阔的天地.
survivin是一种特异性凋亡抑制因子, 是凋亡抑制蛋白家族中作用最强的分子. 其与肿瘤发生、发展、侵袭、转移及细胞通路等密切相关, 已成为研究肿瘤分子生物学和肿瘤演进的一个重要领域.
梁力建, 教授, 中山大学附属第一医院肝胆外科
近年来, survivin与肿瘤的关系也受到人们的关注, 其在结肠癌、卵巢癌、乳腺癌、黑色素瘤等呈过表达状态. 但其在肝癌中的作用机制仍待研究.
survivin促进肿瘤发生发展的机制大致可分为三个方面: (1)促进细胞增殖; (2)抑制细胞凋亡; (3)转移与侵袭.
本文系统地分析了survivin基因与肝癌预后的关系, 认为survivin基因的过表达与肝炎、Edmondson等级、门静脉癌栓及肿瘤数目相关, 提出survivin基因的过表达是肝癌预后的独立危险因素. 并探讨了survivin基因的过表达在肝癌中的可能作用机制.
本文研究肝癌组织中survivin基因的表达与预后的相关性, 对肝癌的基因治疗提供了重要的理论指导依据.
本研究设计合理, 结果可靠, 具有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Williams R, White J, Croce M, Dilawari R. Surgical options in the treatment of hepatocellular carcinoma. Am Surg. 2007;73:658-662; discussion 662-663. [PubMed] |
| 2. | Yeo W, Mo FK, Chan SL, Leung NW, Hui P, Lam WY, Mok TS, Lam KC, Ho WM, Koh J. Hepatitis B viral load predicts survival of HCC patients undergoing systemic chemotherapy. Hepatology. 2007;45:1382-1389. [PubMed] [DOI] |
| 3. | Ho MC, Huang GT, Tsang YM, Lee PH, Chen DS, Sheu JC, Chen CH. Liver resection improves the survival of patients with multiple hepatocellular carcinomas. Ann Surg Oncol. 2009;16:848-855. [PubMed] [DOI] |
| 4. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 5. | Li F, Ambrosini G, Chu EY, Plescia J, Tognin S, Marchisio PC, Altieri DC. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396:580-584. [PubMed] [DOI] |
| 6. | Andric M, Dozic B, Popovic B, Stefanovic D, Basta-Jovanovic G, Djogo N, Andjus P, Milasin J. Survivin expression in odontogenic keratocysts and correlation with cytomegalovirus infection. Oral Dis. 2010;16:156-159. [PubMed] [DOI] |
| 7. | Amin AT, Shiraishi N, Ninomiya S, Tajima M, Inomata M, Kitano S. Increased mRNA expression of epidermal growth factor receptor, human epidermal receptor, and survivin in human gastric cancer after the surgical stress of laparotomy versus carbon dioxide pneumoperitoneum in a murine model. Surg Endosc. 2010;24:1427-1433. [PubMed] [DOI] |
| 8. | Barrett RM, Osborne TP, Wheatley SP. Phosphorylation of survivin at threonine 34 inhibits its mitotic function and enhances its cytoprotective activity. Cell Cycle. 2009;8:278-283. [PubMed] [DOI] |
| 9. | Su H, Zhao J, Xiong Y, Xu T, Zhou F, Yuan Y, Zhang Y, Zhuang SM. Large-scale analysis of the genetic and epigenetic alterations in hepatocellular carcinoma from Southeast China. Mutat Res. 2008;641:27-35. [PubMed] [DOI] |
| 10. | Berthelot T, Lasne MC, Déléris G. New trends in molecular imaging of tumor angiogenesis. Anticancer Agents Med Chem. 2008;8:497-522. [PubMed] [DOI] |
| 11. | Guruvayoorappan C. Tumor versus tumor-associated macrophages: how hot is the link? Integr Cancer Ther. 2008;7:90-95. [PubMed] [DOI] |
| 12. | Kobayashi Y, Yukiue H, Sasaki H, Fukai I, Yokoyama T, Kiriyama M, Yamakawa Y, Maeda M, Fujii Y. Developmentally regulated expression of survivin in the human thymus. Hum Immunol. 2002;63:101-107. [PubMed] [DOI] |
| 13. | Blum B, Bar-Nur O, Golan-Lev T, Benvenisty N. The anti-apoptotic gene survivin contributes to teratoma formation by human embryonic stem cells. Nat Biotechnol. 2009;27:281-287. [PubMed] [DOI] |
| 14. | Fan L, Lin C, Zhuo S, Chen L, Liu N, Luo Y, Fang J, Huang Z, Lin Y, Chen J. Transplantation with survivin-engineered mesenchymal stem cells results in better prognosis in a rat model of myocardial infarction. Eur J Heart Fail. 2009;11:1023-1030. [PubMed] [DOI] |
| 15. | Yie SM, Lou B, Ye SR, He X, Cao M, Xie K, Ye NY, Lin R, Wu SM, Xiao HB. Clinical significance of detecting survivin-expressing circulating cancer cells in patients with non-small cell lung cancer. Lung Cancer. 2009;63:284-290. [PubMed] [DOI] |
| 16. | Vallböhmer D, Drebber U, Schneider PM, Baldus S, Bollschweiler E, Brabender J, Warnecke-Eberz U, Mönig S, Hölscher AH, Metzger R. Survivin expression in gastric cancer: Association with histomorphological response to neoadjuvant therapy and prognosis. J Surg Oncol. 2009;99:409-413. [PubMed] [DOI] |
| 17. | Lodi G, Franchini R, Bez C, Sardella A, Moneghini L, Pellegrini C, Bosari S, Manfredi M, Vescovi P, Carrassi A. Detection of survivin mRNA in healthy oral mucosa, oral leucoplakia and oral cancer. Oral Dis. 2010;16:61-67. [PubMed] [DOI] |
| 18. | Khan S, Aspe JR, Asumen MG, Almaguel F, Odumosu O, Acevedo-Martinez S, De Leon M, Langridge WH, Wall NR. Extracellular, cell-permeable survivin inhibits apoptosis while promoting proliferative and metastatic potential. Br J Cancer. 2009;100:1073-1086. [PubMed] [DOI] |
| 19. | Villapol S, Acarin L, Faiz M, Castellano B, Gonzalez B. Survivin and heat shock protein 25/27 colocalize with cleaved caspase-3 in surviving reactive astrocytes following excitotoxicity to the immature brain. Neuroscience. 2008;153:108-119. [PubMed] [DOI] |
| 20. | Ma J, Zhao M, Yu XD, Wang ZH. [MS-275, a histone deacetylase inhibitor, induces apoptosis and alters survivin gene expression in human myeloma cell line U266]. Ai Zheng. 2009;28:466-471. [PubMed] [DOI] |
| 21. | Suzuki A, Hayashida M, Ito T, Kawano H, Nakano T, Miura M, Akahane K, Shiraki K. Survivin initiates cell cycle entry by the competitive interaction with Cdk4/p16(INK4a) and Cdk2/cyclin E complex activation. Oncogene. 2000;19:3225-3234. [PubMed] [DOI] |
| 22. | Saleem M, Murtaza I, Witkowsky O, Kohl AM, Maddodi N. Lupeol triterpene, a novel diet-based microtubule targeting agent: disrupts survivin/cFLIP activation in prostate cancer cells. Biochem Biophys Res Commun. 2009;388:576-582. [PubMed] [DOI] |
| 23. | Dallaglio K, Palazzo E, Marconi A, Dumas M, Truzzi F, Lotti R, Bontè F, Pincelli C. Endogenous survivin modulates survival and proliferation in UVB-treated human keratinocytes. Exp Dermatol. 2009;18:464-471. [PubMed] [DOI] |
| 24. | Sun SC, Wei L, Li M, Lin SL, Xu BZ, Liang XW, Kim NH, Schatten H, Lu SS, Sun QY. Perturbation of survivin expression affects chromosome alignment and spindle checkpoint in mouse oocyte meiotic maturation. Cell Cycle. 2009;8:3365-3372. [PubMed] [DOI] |
| 25. | Xia F, Canovas PM, Guadagno TM, Altieri DC. A survivin-ran complex regulates spindle formation in tumor cells. Mol Cell Biol. 2008;28:5299-5311. [PubMed] [DOI] |
| 26. | Yamamoto T, Tanigawa N. The role of survivin as a new target of diagnosis and treatment in human cancer. Med Electron Microsc. 2001;34:207-212. [PubMed] [DOI] |
| 27. | Wang J, Jin Y, Xu Z, Zheng Z, Wan S. Involvement of caspase-3 activity and survivin downregulation in cinobufocini-induced apoptosis in A 549 cells. Exp Biol Med (Maywood). 2009;234:566-572. [PubMed] [DOI] |
| 28. | Carter BZ, Wang RY, Schober WD, Milella M, Chism D, Andreeff M. Targeting Survivin expression induces cell proliferation defect and subsequent cell death involving mitochondrial pathway in myeloid leukemic cells. Cell Cycle. 2003;2:488-493. [PubMed] [DOI] |
| 29. | Liu T, Biddle D, Hanks AN, Brouha B, Yan H, Lee RM, Leachman SA, Grossman D. Activation of dual apoptotic pathways in human melanocytes and protection by survivin. J Invest Dermatol. 2006;126:2247-2256. [PubMed] [DOI] |
| 30. | Suzuki A, Ito T, Kawano H, Hayashida M, Hayasaki Y, Tsutomi Y, Akahane K, Nakano T, Miura M, Shiraki K. Survivin initiates procaspase 3/p21 complex formation as a result of interaction with Cdk4 to resist Fas-mediated cell death. Oncogene. 2000;19:1346-1353. [PubMed] [DOI] |
| 31. | Delvaeye M, De Vriese A, Zwerts F, Betz I, Moons M, Autiero M, Conway EM. Role of the 2 zebrafish survivin genes in vasculo-angiogenesis, neurogenesis, cardiogenesis and hematopoiesis. BMC Dev Biol. 2009;9:25. [PubMed] [DOI] |
| 32. | Ueda M, Yamashita Y, Takehara M, Terai Y, Kumagai K, Ueki K, Kanda K, Yamaguchi H, Akise D, Hung YC. Survivin gene expression in endometriosis. J Clin Endocrinol Metab. 2002;87:3452-3459. [PubMed] [DOI] |
| 33. | Jiang LB, Liu XQ, Li B, He XJ, Jin YL, Li LQ, Gao F, Wang NL. Heat shock proteins and survivin: relationship and effects on proliferation index of retinoblastoma cells. Histol Histopathol. 2008;23:827-831. [PubMed] |
| 34. | Marusawa H, Matsuzawa S, Welsh K, Zou H, Armstrong R, Tamm I, Reed JC. HBXIP functions as a cofactor of survivin in apoptosis suppression. EMBO J. 2003;22:2729-2740. [PubMed] [DOI] |
| 35. | Zhang X, Dong N, Yin L, Cai N, Ma H, You J, Zhang H, Wang H, He R, Ye L. Hepatitis B virus X protein upregulates survivin expression in hepatoma tissues. J Med Virol. 2005;77:374-381. [PubMed] [DOI] |