修回日期: 2010-04-17
接受日期: 2010-04-27
在线出版日期: 2010-06-08
目的: 检测溃疡性结肠炎大鼠在药物治疗前后β2AR、β-arrestin2、NF-κB p65的表达水平.
方法: SD大鼠随机分为4组: 空白组、模型组、美莎拉嗪西药组和乌梅丸中药组. 模型成功建立后空白组和模型组以生理盐水3 mL灌胃, 美莎拉嗪组用50 g/L的美莎拉嗪混悬液50 mg/100 g灌胃, 乌梅丸组给予0.515 g/mL的乌梅丸液3 mL灌胃, 各组均连续给药15 d后, 取脾脏和结肠组织分别用Western blot法和免疫组织化学法检测β2AR、β-arrestin2、NF-κB p65的表达.
结果: 在正常组织中β2AR、β-arrestin2的表达增加(15.28%±1.71%, 15.28%±1.58%), 模型组二者的表达明显下降(12.54%±1.28%, 12.67%±1.42%), 经治疗后, 乌梅丸组和美莎拉嗪组中二者的表达显著增加(16.27%±1.40%, 16.18%±1.12%; 17.05%±1.48%, 16.77%±1.40%), 免疫组织化学法检测显示表达率有统计学意义. 而NF-κB p65在正常组织中表达较少, 模型组NF-κB p65的表达明显增加(17.79%±1.24%), 经药物治疗后其在乌梅丸组和美莎拉嗪组中表达明显下降(16.61%±1.42%, 15.39%±1.21%), 免疫组织化学法检测显示表达率有统计学意义.
结论: 对于溃疡性结肠炎的治疗, 乌梅丸和美莎拉嗪均有明显疗效.
引文著录: 梁丽, 范恒, 段雪云, 陈小艳, 张丽娟, 唐庆, 廖奕, 刘星, 钟敏. β2AR、β-arrestin2、NF-κB p65在溃疡性结肠炎大鼠中的表达及乌梅丸的干预作用. 世界华人消化杂志 2010; 18(16): 1650-1655
Revised: April 17, 2010
Accepted: April 27, 2010
Published online: June 8, 2010
AIM: To investigate the effects of Wumeiwan treatment on the expression of β2-adrenergic receptor (β2AR), β-arrestin 2, NF-κB p65 in ulcerative colitis in rats.
METHODS: Sprague-Dawley rats were randomly divided into four groups: control group, model group, mesalazine group and Wumeiwan group. Ulcerative colitis was induced in rats with 2, 4, 6-trinitrobenzenesulfonic acid. The control group and model group were administered intragastrically with 3 mL of normal saline, while the mesalazine group and Wumeiwan group were intragastrically given mesalazine at a dose of 50 mg/100 g body weight and 3 mL of Wumeiwan (0.515 g/mL), respectively. All rats were treated for 15 d. Spleen and colon tissue samples were taken to detect the expression of β2AR, β-arrestin 2 and NF-κB p65 by Western blot and immunohistochemistry.
RESULTS: The expression levels of β2AR and β-arrestin 2 were significantly lower in the model group than in the control group (12.54% ± 1.28% vs 15.28% ± 1.71%, 12.67% ± 1.42% vs 15.28% ± 1.58%). Treatment with either Wumeiwan or mesalazine significantly increased the expression of β2AR and β-arrestin 2 (16.27% ± 1.40%, 16.18% ± 1.12%; 17.05% ± 1.48%, 16.77% ± 1.40%), and there were no significant differences in the expression levels of β2AR and β-arrestin 2 between the Wumeiwan and mesalazine groups. The expression level of NF-κB p65 was significantly higher in the model group than in the control group (17.79% ± 1.24% vs 13.82% ± 1.13%). Treatment with either Wumeiwan or mesalazine significantly decreased the expression of NF-κB p65 (16.61% ± 1.42%, 15.39% ± 1.21%), and there was no significant difference in the expression level of NF-κB p65 between the Wumeiwan and mesalazine groups.
CONCLUSION: Both Wumeiwan and mesalazine have significant efficacy in the treatment of ulcerative colitis in rats.
- Citation: Liang L, Fan H, Duan XY, Chen XY, Zhang LJ, Tang Q, Liao Y, Liu X, Zhong M. Wumeiwan treatment alters the expression of β2AR, β-arrestin 2 and NF-κB p65 in rat ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2010; 18(16): 1650-1655
- URL: https://www.wjgnet.com/1009-3079/full/v18/i16/1650.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i16.1650
溃疡性结肠炎是慢性炎症性肠病的一种, 其确切的发病原因和机制还不明确, 是发生于遗传易感个体的异常免疫应答反应, 也是环境、微生物及肠道免疫系统相互作用的结果[1]. 近年来在炎症性肠病发病机制的研究主要集中在免疫方面, 在炎性消化系黏膜中存在的大量单核细胞及有活性的巨噬细胞是细胞因子的主要来源. 促炎症反应细胞因子如IL-1、IL-2、IL-6、IL-8、IFN、TNF等, 抗炎细胞因子如IL-4、IL-10、IL-13等均与溃疡性结肠炎的发病及病程进展有关[2]. NF-κB的活化可以控制各种促炎性细胞因子的基因转录, 这证明他在溃疡性结肠炎的发病中起重要作用[3]. NF-κB是一种转录因子, 在基因表达的先天免疫应答、细胞增殖和分化中起重要作用. β-arrestins是Arrestin家族中普遍表达的一员, 是G蛋白偶联受体信号的主要调节剂, 可以与活化的G蛋白偶联受体结合导致受体失敏感化和内化. 近来发现β-arrestin在调节多种信号途径及介导信号途径间的交叉对话中起重要作用. 而且许多证据显示β-arrestin2可在脾脏中表达, 并参与许多重要的免疫反应过程. 同时β2AR可通过β-arrestin2稳定胞质中IKBa来抑制NF-κB的活化, 而NF-κB的活化依赖于胞质中NF-κB/IKBa复合物的水平, 因此β2AR的减少会导致β-arrestin2的下调[4]. β2AR既可以促进炎症反应又可以抑制炎症反应这依赖于β-arrestin2的表达, 而且β-arrestin依赖的β2AR信号的选择性活化作用可以作用于抗炎药物的治疗中[5]. 本实验通过验证药物治疗前后β2AR, β-arrestin2, NF-κB p65表达水平的变化来证实乌梅丸在免疫机制方面的疗效. 为溃疡性结肠炎提供新的有效的治疗途径和方法.
24只♂SPF级SD大鼠, 购自华中科技大学同济医学院实验动物中心, 体质量300 g±50 g; 2, 4, 6-三硝基苯磺酸(50 g/L)购自Sigma公司. 美莎拉嗪(0.5 g/袋)购自武汉协和医院, 乌梅丸各味中药生药购自武汉协和医院, 在湖北省中医院药剂科经药用砂锅, 煎药器, 挥发油提取器煎煮浓缩并消毒后备用.
1.2.1 造模及药物干预: 将24只大鼠随机分为4组: 空白对照组、模型组、美莎拉嗪西药组和乌梅丸中药组. 除空白对照组外, 其他组大鼠均在禁食不禁饮24 h条件下, 给予2, 4, 6-三硝基苯磺酸灌肠, 具体方法为: 用1%的水合氯醛以3 mL/Kg分别从腹腔注射进行麻醉后, 将导尿管缓缓插入大鼠肛门8 cm将抽取好的50%的乙醇溶液注入0.25 mL后继续注入2, 4, 6-三硝基苯磺酸液0.6 mL, 使药液缓慢进入肠道, 将大鼠提尾倒置30 s, 待清醒后自由饮食, 自由进水. 模型建立成功后, 空白对照组和模型组每组每只均以蒸馏水3 mL灌胃, 美莎拉嗪组以50 g/L的美莎拉嗪混悬液50 mg/100 g灌胃, 乌梅丸组予以乌梅丸液(0.515 g/mL)3 mL灌胃, 各组均灌胃15 d.
1.2.2 Western blot法检测大鼠脾脏β2AR、β-arrestin2、NF-κB p65的表达: 将脾脏组织加HANK液充分研磨后, 加1.8%氯化钠溶液裂解红细胞, 用双蒸水中和后, 1 200 r/min离心2 min, 弃上清获得T淋巴细胞, 加入1 mL RIPA, 充分吹打, 然后冰上放置20 min后, 再吹10 min, 将匀浆液吸出放到1.5 mL离心管中. 超声3次, 每次3 s; 9 000 r/min, 离心10 min, 取适量上清置于新的1.5 mL离心管中, 得到T淋巴细胞细胞核蛋白. 将提取的T淋巴细胞细胞核蛋白在200 V电压下进行SDS-PAGE电泳; 转膜后使一抗与靶蛋白的结合再用酶标记二抗与一抗的结合后进行化学发光.
1.2.3 免疫组织化学法检测大鼠结肠组织β2AR、β-arrestin2、NF-κB p65的表达: 将各组大鼠结肠组织制备厚度3 μm切片, 65 ℃烤片4 h后, 依次用二甲苯Ⅰ、二甲苯Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、90%乙醇、85%乙醇、75%乙醇各10 min脱蜡、水化; 然后用1×PBS缓冲液(0.01 mol/L, pH7.2)洗涤切片3次, 每次5 min; 高压抗原修复后待修复液自然冷却, 再用1×PBS缓冲液(0.01 mol/L, pH7.2)洗涤切片3次, 每次5 min; 3% H2O2(以PBS缓冲液或甲醇配置)滴加在组织切片上, 室温(24 ℃)静置10 min; PBS洗3次各5 min; 滴加正常山羊血清封闭液, 室温10 min. 甩去多余液体. 滴加第一抗体50 μL, 置于湿盒内, 4 ℃过夜; 1×PBS洗3次各5 min; 滴加复合二抗, 室温静置20 min; 1×PBS洗3次各5 min; DAB显色, 在显微镜下掌握染色程度约3-5 min; 自来水终止显色; 苏木精复染, 1%盐酸酒精分化(分化时间为1 s); 自来水冲洗10 min; 脱水, 透明; 中性树胶封片, 镜检. 其中黄色或棕黄色染色为阳性染色.
造模后24 h大鼠出现稀便、脓血便、竖毛、毛色欠光滑、喜扎堆、懒动、活动迟缓, 眼球转动不灵活. 用放大镜(50×)观察病变肠黏膜可发现充血糜烂面, 并有溃疡形成. 进行组织病理学分析可观察到固有膜有弥漫性、慢性炎症细胞及中性粒细胞、嗜酸性粒细胞浸润; 上皮细胞间有中性粒细胞浸润及隐窝炎, 甚至形成隐窝脓肿; 隐窝上皮增生、杯状细胞减少; 黏膜表面糜烂、溃疡形成和肉芽组织增生.
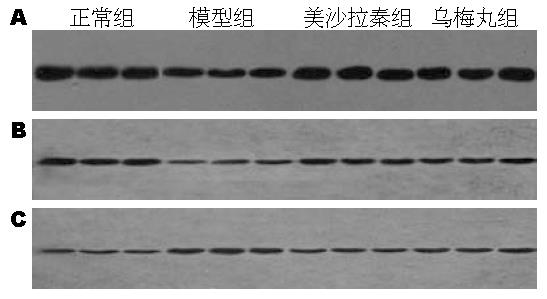
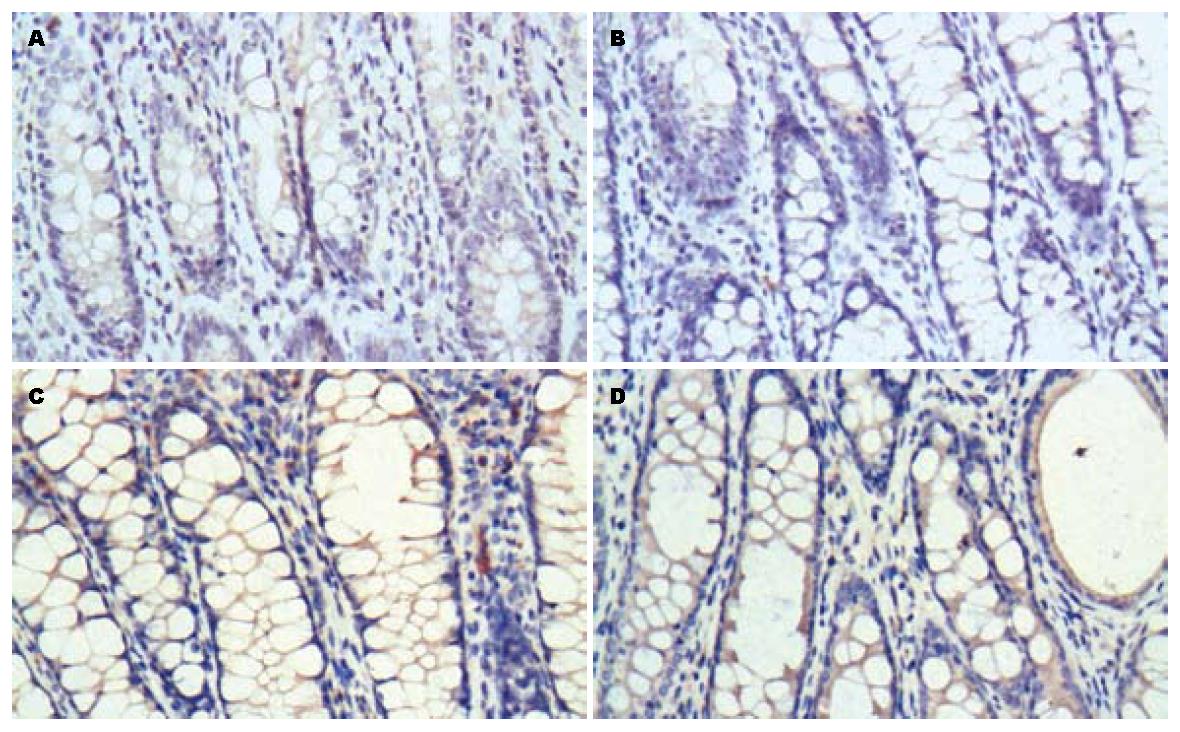
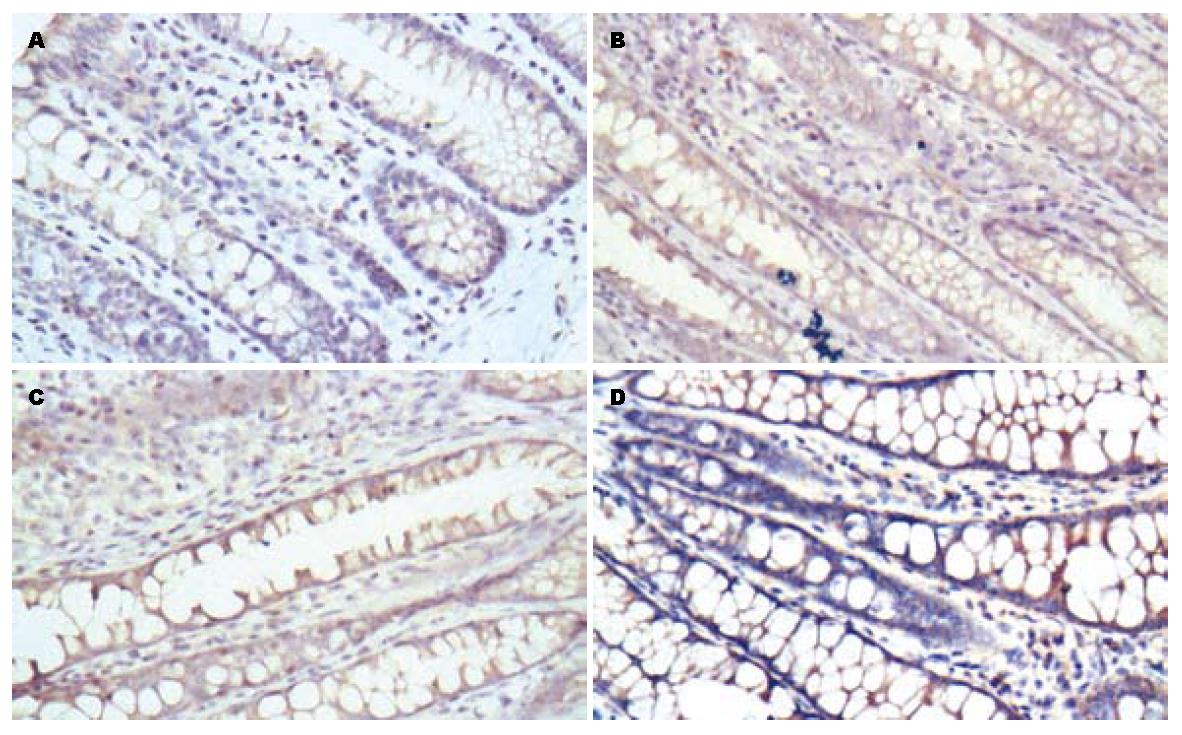
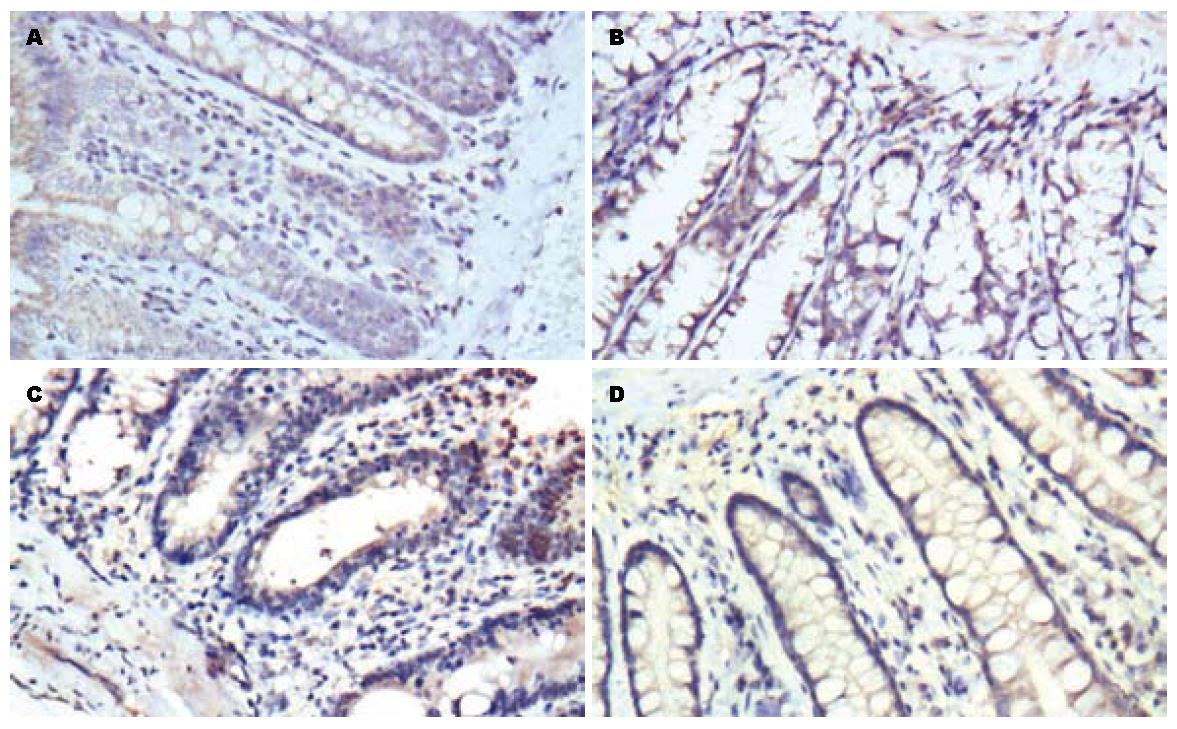
在正常组织中β2AR的表达较高, 模型组其表达明显下降. 经乌梅丸和美莎拉嗪治疗后, β2AR的表达显著增加(图1A). 在正常组织中β-arrestin2的表达增加, 模型组中其表达明显下降, 经治疗后, β-arrestin2的表达增加, 其中乌梅丸组与美莎拉嗪组无显著差异(图1B). NF-κB p65在正常组织中表达较少, 模型组NF-κB p65的表达明显增加, 经药物治疗后其表达下降, 而乌梅丸组与美莎拉嗪组比较无显著差异(图1C).
对照组、模型组、美莎拉嗪组和乌梅丸组结肠黏膜β2AR的表达率分别为15.28%±1.71%、12.54%±1.28%、16.18%±1.12%和16.27%±1.40%. 美莎拉嗪组和乌梅丸组治疗后结肠黏膜β2AR的表达率明显高于治疗前, 且美莎拉嗪西药组和乌梅丸组表达差异无统计学意义(P>0.05, 图2). 各组结肠黏膜β-arrestin2的表达率分别为15.28%±1.58%、12.67%±1.42%、16.77%±1.40%和17.05%±1.48%. 美莎拉嗪西药组和乌梅丸组治疗后结肠黏膜β-arrestin2的表达率明显高于治疗前, 且美莎拉嗪西药组和乌梅丸组表达差异无统计学意义(P>0.05, 图3). 各组结肠黏膜NF-κB p65的表达率分别为13.82%±1.13%、17.79%±1.24%、15.39%±.21%和16.61%±1.42%. 美莎拉嗪西药组和乌梅丸组治疗后结肠黏膜NF-κB p65的表达率明显高于治疗前, 且美莎拉嗪西药组和乌梅丸组表达差异无统计学意义(P>0.05, 图4).
Arrestin也称为48 kDa蛋白或S抗原, 具有视觉和非视觉两种结构形式, 其家族有4个成员, 其中β-arrestin2是一种多功能适应性蛋白, 在哺乳动物组织中普遍表达[6]. β-arrestin能以不同的形态与不同的受体相互作用发生在不同的结合场所, 其构象变化会影响β-arrestin与不同结合配体的易接受性[7]. Arrestin与20多种不同蛋白如; SRC家族激酶、泛素连接酶、蛋白磷酸酶等相互作用, 并作为支架蛋白使信号易于进入两种MAP激酶级联, 导致ERK1/2和JNK3的活化[8]. 不同的细胞作用, 从分化、增殖到迁移、炎症都由MAPK信号来调节, 因此Arrestin是决定细胞存亡与行为的关键因子[8,9]. β-arrestin是多功能构架蛋白, 参与G蛋白偶联受体多信号作用[10]. G蛋白偶联受体通过磷酸化调节引起Arrestin募集反应导致受体失敏感化及Arrestin依赖途径的激活[11]. Arrestin又可作为接头或支架蛋白, 与活化的磷酸化G蛋白偶联受体合成来终止G蛋白的活化及信号转导[12]. β-arrestin起初被认为是G蛋白偶联受体信号的终止子, 他们结合受体并抑制与G蛋白的结合而导致效应器如第二信使产生的酶失活, 后来发现其有信号转导作用, 可介导抗细胞凋亡的细胞保护作用[13].
β-arrestin2可以作为支架蛋白在GPCR诱导的NF-κB活性中起重要作用[14]. β2AR能通过β-arrestin依赖途径传递信号[15]β2AR又可以活化或抑制NF-κB活性. NF-κB是转录因子家族中的一员, 可作为同源或异源二聚体存在, 在基因表达的先天免疫应答、细胞增殖和分化中起重要作用. 在转染细胞研究中发现, β-arrestin的N端可以与IFκB直接相互作用阻止IFκB的降解而抑制NF-κB的活性. IFκB与β-arrestin2的相互作用可通过β2AR的活化来增强. β2AR既可以促进炎症反应又可以抑制炎症反应, 这依赖于β-arrestin2的表达[5]. 脱磷酸后的β-arrestin2又可以抑制NF-κB的活性而促进细胞凋亡[13]. 因此β-arrestin依赖的β2AR信号的选择性活化作用可以作用于抗炎药物的治疗中[5].
几种GPCR配体也能有效的诱导NF-κB的活化. β-arrestin2在GPCR诱导的NF-κB的活化中起正性作用. β2AR诱导的IKBa稳定性可通过β-arrestin2来实现[14]. 刺激可以抑制β2AR的表达而导致β-arrestin2表达的下调, 稳定了胞质IKBa并抑制NF-κB的活化. β2AR受刺激后在巨噬细胞中可通过抑制IKBa的降解来作为负调节蛋白活化NF-κB. 证实β-arrestin2的表达由β2AR来调节. β2AR的被动表达可抑制IKBa稳定作用引起NF-κB活化抑制[4]. 这与本实验研究结果相一致, 即经药物治疗后β2AR和β-arrestin2的表达水平明显上升而促进NF-κB表达下降最终引起NF-κB活化抑制而使得促炎性细胞因子表达下降而抑制炎症反应起到治疗溃疡性结肠炎的作用. 选择性NF-κB活化途径可能与多种炎症性疾病包括溃疡性结肠炎相关, 因此选择性途径抑制剂可有效应用于炎症性疾病的治疗[16].
乌梅丸由乌梅、细辛、干姜、黄连、当归、附子、蜀椒、桂枝、党参、黄柏组成[17]. 乌梅丸出自仲景《伤寒论·厥阴病篇》, 方中以乌梅酸敛收固, 附子、干姜、桂枝扶阳以胜寒, 蜀椒、细辛通阳以破阴, 附子、干姜、蜀椒、桂枝、细辛, 辛热以助其阳, 温以祛寒; 黄连、黄柏之苦寒以坚其阴, 清以泻热, 党参、当归益气养血, 诸药合用, 使寒热邪去, 阴阳协调, 气血恢复. 全方酸收熄风, 辛热助阳, 酸苦坚阴, 寒热温凉, 温清敛补, 攻补兼施, 诸药配伍, 调理阴阳寒热虚实, 使之归复于平和. 本实验研究发现, 乌梅丸治疗后溃疡性结肠炎大鼠病变结肠黏膜明显修复好转, 其改善程度相当于美莎拉嗪, 可升高大鼠淋巴细胞β-arrestin2、β2AR的表达水平, 降低大鼠结肠黏膜中NF-κB的水平, 起到了对免疫功能的调节和对结肠黏膜的保护作用. 本研究发现, 乌梅丸对于改善腹泻、稀便、黏液脓血便、竖毛等临床症状也具有良好的作用.
促炎症介质在炎症性肠病的发病中是重要的, 可通过活化NF-κB来调节. NF-κB在免疫和炎症反应中起重要作用, 在炎症性肠病患者结肠上皮细胞和巨噬细胞中NF-κB可被活化. 乌梅丸可通过抑制促炎症分子的表达及转录因子NF-κB的表达来减轻2, 4, 6, 三硝基苯磺酸诱导的大肠炎的炎症反应. 可通过抑制NF-κB的活化来减轻结肠损伤, 改善大肠炎症状. 总之, 由于其显著的抗炎作用, 乌梅丸可作为一种有效的治疗溃疡性结肠炎的药物[18].
溃疡性结肠炎是慢性炎症性肠病的一种, 其确切的发病原因和机制还不明确, 治疗上也比较棘手, 因此对本病发病机制和治疗上的研究显得尤为重要.
刘占举, 教授, 同济大学附属第十人民医院胃肠内科
在转染细胞研究中发现, β-arrestin的N端可以与IFκB直接相互作用阻止IFκB的降解而抑制NF-κB的活性.
本文通过研究结肠和脾脏组织中β2AR、β-arrestin2、NF-κB p65的表达来阐明溃疡性结肠炎的发病机制, 并进行药物治疗疗效比较.
本研究发现乌梅丸和美莎拉嗪均可以有效治疗溃疡性结肠炎, 药物安全, 疗效理想, 值得临床研究.
本研究为临床上开展中药治疗溃疡性结肠炎提供了重要理论依据.
编辑: 李军亮 电编: 何基才
| 1. | Stefanelli T, Malesci A, Repici A, Vetrano S, Danese S. New insights into inflammatory bowel disease pathophysiology: paving the way for novel therapeutic targets. Curr Drug Targets. 2008;9:413-418. [PubMed] [DOI] |
| 2. | Polińska B, Matowicka-Karna J, Kemona H. [The cytokines in inflammatory bowel disease]. Postepy Hig Med Dosw (Online). 2009;63:389-394. [PubMed] |
| 3. | Li Z, Zhang DK, Yi WQ, Ouyang Q, Chen YQ, Gan HT. NF-kappaB p65 antisense oligonucleotides may serve as a novel molecular approach for the treatment of patients with ulcerative colitis. Arch Med Res. 2008;39:729-734. [PubMed] [DOI] |
| 4. | Kizaki T, Izawa T, Sakurai T, Haga S, Taniguchi N, Tajiri H, Watanabe K, Day NK, Toba K, Ohno H. Beta2-adrenergic receptor regulates Toll-like receptor-4-induced nuclear factor-kappaB activation through beta-arrestin 2. Immunology. 2008;124:348-356. [PubMed] [DOI] |
| 5. | Defea K. Beta-arrestins and heterotrimeric G-proteins: collaborators and competitors in signal transduction. Br J Pharmacol. 2008;153 Suppl 1:S298-S309. [PubMed] [DOI] |
| 6. | Barki-Harrington L, Rockman HA. Beta-arrestins: multifunctional cellular mediators. Physiology (Bethesda). 2008;23:17-22. [PubMed] [DOI] |
| 7. | DeFea KA. Beta-arrestin multimers: does a crowd help or hinder function? Biochem J. 2008;413:e1-e3. [PubMed] [DOI] |
| 8. | Gurevich VV, Gurevich EV, Cleghorn WM. Arrestins as multi-functional signaling adaptors. Handb Exp Pharmacol. 2008;15-37. [PubMed] |
| 9. | Brown MD, Sacks DB. Protein scaffolds in MAP kinase signalling. Cell Signal. 2009;21:462-469. [PubMed] [DOI] |
| 10. | Patel PA, Tilley DG, Rockman HA. Physiologic and cardiac roles of beta-arrestins. J Mol Cell Cardiol. 2009;46:300-308. [PubMed] [DOI] |
| 11. | Tobin AB, Butcher AJ, Kong KC. Location, location, location...site-specific GPCR phosphorylation offers a mechanism for cell-type-specific signalling. Trends Pharmacol Sci. 2008;29:413-420. [PubMed] [DOI] |
| 12. | Raghuwanshi SK, Nasser MW, Chen X, Strieter RM, Richardson RM. Depletion of beta-arrestin-2 promotes tumor growth and angiogenesis in a murine model of lung cancer. J Immunol. 2008;180:5699-5706. [PubMed] [DOI] |
| 13. | Ahn S, Kim J, Hara MR, Ren XR, Lefkowitz RJ. {beta}-Arrestin-2 Mediates Anti-apoptotic Signaling through Regulation of BAD Phosphorylation. J Biol Chem. 2009;284:8855-8865. [PubMed] [DOI] |
| 14. | Sun J, Lin X. Beta-arrestin 2 is required for lysophosphatidic acid-induced NF-kappaB activation. Proc Natl Acad Sci U S A. 2008;105:17085-17090. [PubMed] [DOI] |
| 15. | Drake MT, Violin JD, Whalen EJ, Wisler JW, Shenoy SK, Lefkowitz RJ. beta-arrestin-biased agonism at the beta2-adrenergic receptor. J Biol Chem. 2008;283:5669-5676. [PubMed] [DOI] |
| 16. | Dejardin E. The alternative NF-kappaB pathway from biochemistry to biology: pitfalls and promises for future drug development. Biochem Pharmacol. 2006;72:1161-1179. [PubMed] [DOI] |
| 18. | Li JH, Yu JP, Yu HG, Xu XM, Yu LL, Liu J, Luo HS. Melatonin reduces inflammatory injury through inhibiting NF-kappaB activation in rats with colitis. Mediators Inflamm. 2005;2005:185-193. [PubMed] [DOI] |