修回日期: 2010-04-30
接受日期: 2010-05-10
在线出版日期: 2010-05-28
目的: 探讨MTHFR C677T多态性对HBV感染后疾病转归的关系.
方法: 采用TaqMan SNP基因分型和基因测序的方法检测152例健康对照人群、161例感染HBV后自愈者、173例慢性乙型肝炎患者、138例乙型肝炎肝硬化患者以及181例HBV相关性肝癌患者的MTHFR基因C677T位点的基因型及等位基因的分布及其差异.
结果: 805例研究对象的基因型分布为CT基因型占47.09%、TT占30.43%、CC占22.48%; 等位基因频率: C为46.02%, T为53.98%, 此结果明显不同于以往报道. 等位基因和基因型分布在各肝病组无统计学差异. 分析不同性别在各组中的分布特征表明, 男性患者TT在各组中显示风险降低, 特别在肝硬化组TT和CT的OR值最低(与自愈组比较: 0.675, 95%CI: 0.308-1.479; 0.510, 95%CI: 0.248-1.050); 而在女性的自愈、慢乙型肝炎和肝硬化组, TT和CT显示风险度增加, 特别在肝硬化组OR值最高(与自愈组比较: 3.542, 95%CI: 0.885-14.171; 3.167, 95%CI: 0.821-12.211), 具有统计学差异(P = 0.022). 同时, 在女性肝癌组却显示风险度降低(0.638, 95%CI: 0.213-1.904; 0.500, 95%CI: 0.175-1.432).
结论: 本研究显示MTHFR C677T多态性在中国天津汉族人中显示了较高的TT基因型频率, 同时提示MTHFR C677T多态性在HBV感染后疾病发展的过程中发挥重要作用.
引文著录: 刘娟娟, 高英堂, 杜智, 杨斌, 经翔, 王毅军, 王凤梅, 景丽. 亚甲基四氢叶酸还原酶基因C677T多态性与H B V感染后疾病转归的关系. 世界华人消化杂志 2010; 18(15): 1555-1562
Revised: April 30, 2010
Accepted: May 10, 2010
Published online: May 28, 2010
AIM: To investigate the relationship between the methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism and the outcome of hepatitis B virus (HBV) infection.
METHODS: TaqMan SNP genotyping and sequencing assays were employed to determine the genotypes of MTHFR C677T and the distribution of alleles at this locus in 152 healthy control subjects, 161 self-limited HBV patients, 173 patients with chronic hepatitis B, 138 patients with HBV-induced liver cirrhosis and 181 cases with HBV-related HCC.
RESULTS: Of the 805 subjects, 47.09% had the CT genotype, 30.43% had the TT genotype, and 22.48% had the CC genotype. The frequencies of C and T allele were 46.02% and 53.98%, respectively, which are significantly different from those reported previously. Males with the TT genotype had a reduced risk of liver diseases. The odds ratio (OR) of TT and CT was lowest in the liver cirrhosis group versus the self-limited group (0.675, 95%CI: 0.308-1.479; 0.510, 95%CI: 0.248-1.050). In contrast, females with the TT and CT genotypes had an increased risk of self-limited HBV infection, chronic hepatitis and liver cirrhosis. The liver cirrhosis group had the highest OR value versus the self-limited group (3.542, 95%CI: 0.885-14.171; 3.167, 95% CI: 0.821-12.211; P = 0.022). Females with the TT and CT genotypes had a reduced risk of HCC (OR = 0.638, 95% CI: 0.213-1.904; OR = 0.500, 95%CI: 0.175-1.432).
CONCLUSION: A relatively high frequency of the TT genotype is noted in a Chinese Han population in Tianjin. The MTHFR C677T polymorphism may play a role in influencing disease progression in patients with HBV infection.
- Citation: Liu JJ, Gao YT, Du Z, Yang B, Jing X, Wang YJ, Wang FM, Jing L. Relationship between the MTHFR C677T polymorphism and the outcome of hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2010; 18(15): 1555-1562
- URL: https://www.wjgnet.com/1009-3079/full/v18/i15/1555.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i15.1555
乙型肝炎病毒(hepatitis B virus, HBV)感染可引起多种临床表现, 包括病毒清除后自愈、无症状病毒携带和持续感染进展为慢性肝炎、肝硬化或原发性肝癌等严重肝病[1,2]. 近年研究表明, 宿主基因亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase, MTHFR)的多态性能够影响HBV感染后的疾病进程[3-10]. MTHFR是叶酸代谢的关键酶, 其在DNA甲基化修饰和DNA合成修复过程中均发挥重要作用[11,12]. MTHFR第677位核苷酸的C→T转换可使Ala变为Val, 使CT和TT基因型的酶活性仅为CC基因型的65%和30%[13]. 酶活性的降低可在DNA甲基化和DNA合成两个途径促进或抑制肿瘤的发生[12,14]. 尽管许多研究报道了MTHFR C677T多态性与肿瘤易感性的关系, 但其结果在不同肿瘤间差异较大, 甚至同一种肿瘤在不同地区或民族中的研究结果也不尽相同[15-19]. 同样, MTHFR C677T多态性与肝病相关性研究的结果也存在明显差别[3-10]. 中国学者研究发现在江苏地区TT基因型携带者有更高的HCC发生风险[5], 同样, 来自意大利的3篇报道也认为TT基因型增加欧洲白人发生HCC的风险[4,8,9]; 与此相反, Yuan等[6]结果表明TT基因型降低肝癌发生的风险, Saffroy等[3]报道CC基因型增加肝癌发生的风险, 韩国学者Kwak等[20]研究显示C677T多态性与HCC无关联. 如此复杂而矛盾的结果可能既与MTHFR多态性对DNA甲基化及DNA合成作用的平衡相关, 也与其他环境因子的相互作用相关. 目前尚无HBV感染后不同肝病阶段(如自愈、携带、慢肝、肝硬化和HCC等)的MTHFR C677T多态性分布的详细报道, 因此, 本研究通过检测其在各类HBV感染者中的分布特点, 进一步探讨其与HBV感染后疾病转归的关系.
参照2005年中华医学会《慢性乙型肝炎防治指南》和2009年《原发性肝癌规范化诊治专家共识》的诊断标准, 收集天津市第三中心医院2003-12/2009-06期间慢性乙型肝炎患者173例、乙型肝炎肝硬化患者138例和HBV相关性肝癌患者181例. 健康对照组152例和乙型肝炎自愈组161例来自天津市第三中心医院健康查体, 健康对照组HBV免疫学标志物均为阴性, 且血常规、生化指标均正常; 自愈者均无肝病史, 具有曾感染HBV证据(HBsAb、HBeAb和HBcAb三种抗体至少两种阳性, HBsAg、HBeAg和HBV DNA均为阴性)且未经治疗而健康者. 各研究对象均抽取空腹外周静脉血3 mL, 血清用于检测HBV免疫学指标、肝功能、HBV DNA和AFP等临床指标, 血凝块用于提取白细胞DNA. 以上所有对象均为天津地区汉族人. 本研究经天津市第三中心医院伦理委员会批准, 所有患者均签署知情同意书.
1.2.1 DNA提取: 用牙签将血凝块捣碎, 吸取100 μL置于离心管中, 加入800 μL溶血试剂(0.3 mol/L蔗糖, 1 mmol/L Tris-HCl(pH8.0), 5 mmol/L MgCl2, 20 mmol/L Triton X-100), 震荡后8 000 r/min离心5 min; 吸出上清, 将沉淀捣碎并加入500 μL消化液(0.1 mol/L NaCl, 10 mmol/L Tris-HCl(pH8.0), 30 mmol/L EDTA, 20 mmol/L SDS)和13.5 μL蛋白酶K(5.4 μmol/L), 震荡后60 ℃水浴3 h; 再加500 μL Tris饱和酚, 混匀, 12 000 r/min离心5 min; 吸取上层水相, 加入300 μL氯仿: 异戊醇(24:1), 12 000 r/min离心10 min; 吸取上清, 加入1/10体积NaAC(3 mol/L, pH5.2)和等体积预冷的异丙醇, 12 000 r/min离心15 min, 弃上清, 沉淀加入250 μL乙醇(700 mL/L)洗涤; 12 000 r/min离心5 min弃上清, DNA沉淀溶于50 µL TE(pH8.0), 取2 µL进行1.5%琼脂糖凝胶电泳检测其质量, 紫外分光光度计测定DNA浓度.
1.2.2 PCR扩增: 参照TaqMan® SNP Genotyping Assays Protocol(美国应用生物系统公司), PCR扩增体系为10 µL, 含DNA模板1.5 µL、2×TaqMan Genotyping Master Mix 5 µL、40×TaqMan SNP Genotyping Assay Mix(rs1801133, C_1202883_20) 0.25 µL和dH2O 3.25 µL. 采用ABI PRISM® 7000 SDS进行PCR扩增, 每96孔板设置三个空白对照(NTC). 反应条件为: 95 ℃热变性10 min; 92 ℃变性15 s, 60 ℃退火1 min, 共40个循环.
1.2.3 MTHFR C677T基因型分析: 在上述PCR基础上, 利用ABI PRISM® 7000 SDS进行等位基因识别分析, 设置FAM、VIC探针和样品孔、3个NTC, 点击Post-Read按钮, 读取荧光信号, 通过xy轴散点图分析各样本的基因型.
1.2.4 DNA测序分析: 为验证TaqMan® SNP基因分型方法的准确性, 随机挑取CC、TT和CT基因型各10个样品进行测序. 参照人MTHFR序列(GenBank Accession No. NC_000001)设计引物, 正向引物: 5'-TCCCTCGCCTTGAACAGGTG-3'(9 603-9 622 nt); 反向引物: 5'-CCAAGCAACGCTGTGCAAGTT-3'(10 003 nt -9 983 nt). PCR扩增体系为100 µL, 包括2×PCR Master Mix 50 µL、上下游引物各2 µL、酶4µL(1 U/μL)、DNA模板2 µL和dH2O 40 µL. PCR扩增条件: 94 ℃预变性2 min; 94℃变性45 s, 58 ℃退火45 s, 72 ℃延伸45 s, 共35个循环; 72 ℃延伸5 min. 扩增产物长度为401 bp, 取5 µL进行2.5%琼脂糖凝胶电泳, 剩余产物由上海Invitrogen公司测序.
统计学处理 采用SPSS13.0软件进行统计学分析, 总体和各组样本基因型分布均经Hardy-Weinberg平衡检验. 以行×列或连续校正卡方(χ2)检验分析基因型和等位基因在不同组别之间的差异, 双侧检验P<0.05表示差异显著, P<0.01表示差异极显著.
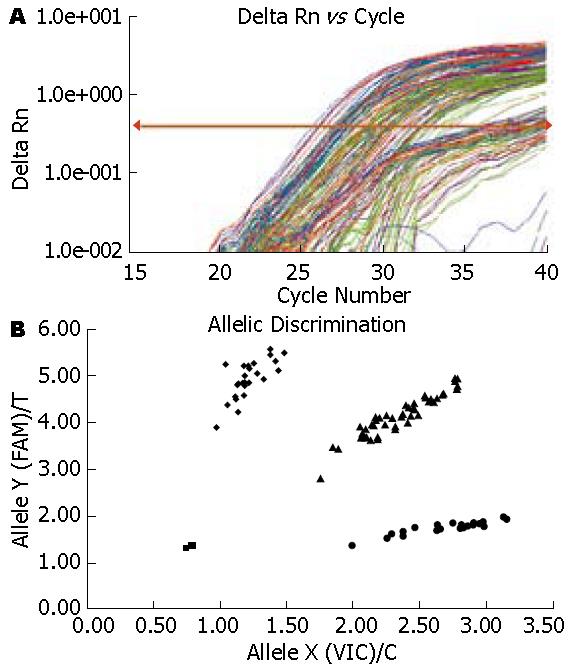
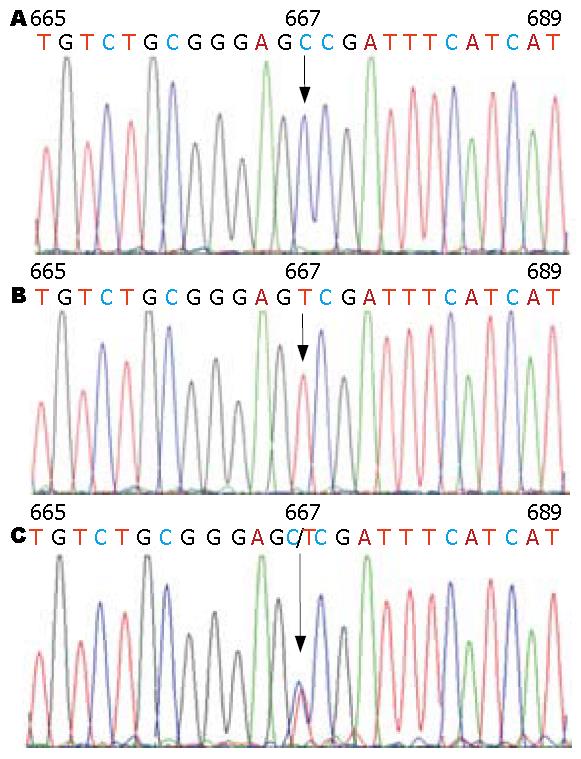
基因组DNA的MTHFR C677T双探针PCR扩增曲线良好(图1A). SNP基因分型见图1B, 根据美国应用生物系统公司提供的信息, 等位基因分型图谱中X轴代表VIC探针(C), Y轴代表FAM探针(T), 样品集中分布在4个区域, 3个NTC空白对照在接近原点的对角线上, 靠近两轴的两组代表2种纯合子(CC或TT), 对角线上的一组为杂合子(CT). 参照空白对照, 各样本均能明确分析基因型. 为验证TaqMan® SNP基因分型方法的准确性, 随机挑取3种基因型的30个样品进行DNA测序, 测序结果与TaqMan SNP基因分型结果完全一致(图1).
| CC | CT | TT | C | T | ||
| 健康对照组 | 男 | 14(17.50) | 36(45.00) | 30(37.50) | 64(40.00) | 96(60.00) |
| 女 | 23(31.94) | 28(38.89) | 21(29.17) | 74(51.39) | 70(48.61) | |
| 自愈组 | 男 | 18(20.93) | 43(50.00) | 25(29.07) | 79(45.93) | 93(54.07) |
| 女 | 17(22.67) | 34(45.33) | 24(32.00) | 68(45.37) | 82(54.67) | |
| 慢乙肝组 | 男 | 21(18.75) | 65(58.04) | 26(23.21) | 107(47.77) | 117(52.23) |
| 女 | 14(22.95) | 30(49.18) | 17(27.87) | 58(47.54) | 64(52.46) | |
| 肝硬化组 | 男 | 32(31.68) | 39(38.62) | 30(29.70) | 103(50.99) | 99(49.01) |
| 女 | 3(8.11) | 19(51.35) | 15(40.54) | 25(33.78) | 49(66.22) | |
| 肝癌组 | 男 | 29(19.08) | 75(49.34) | 48(31.58) | 133(43.75) | 171(56.25) |
| 女 | 10(34.48) | 10(34.48) | 9(31.04) | 30(51.72) | 28(48.28) |
各组MTHFR C677T基因型和等位基因分布情况见表2, 各组样本及总体均符合Hardy-Weinberg平衡. 全部805例研究对象的基因型分布: CT基因型占47.09%、TT占30.43%、CC占22.48%; 等位基因频率: C为46.02%, T为53.98%. 各组的等位基因和基因型分布无统计学差异. 以健康人群为对照计算其他各组的OR值, CT基因型对慢乙型肝炎患者的风险度增加(OR = 1.569, 95%CI = 0.896-2.748). 当以自愈组为对照计算其他组的OR值时, CT对慢乙型肝炎患者的风险度有所减缓(OR = 1.234, 95%CI = 0.707-2.153), 其他组OR值无显著变化.
| MTHFR C677T | 健康对照组n(%) | 自愈组 | 慢乙型肝炎组 | 肝硬化组 | 肝癌组 | 总体n(%) | ||||
| n(%) | OR(95%CI) | n(%) | OR(95%CI) | n(%) | OR(95%CI) | n(%) | OR(95%CI) | |||
| CC | 37(24.34) | 35(21.74) | 1.0(-) | 35(20.23) | 1.0(-) | 35(25.36) | 1.0(-) | 39(21.55) | 1.0(-) | 181(22.48) |
| CT | 64(42.11) | 77(47.83) | 1.272(0.720-2.246) | 95(54.91) | 1.569(0.896-2.748) | 58(42.03) | 0.958(0.535-1.716) | 85(46.96) | 1.260(0.724-2.194) | 379(47.09) |
| TT | 51(33.55) | 49(30.43) | 1.016(0.554-1.862) | 43(24.86) | 0.891(0.482-1.649) | 45(32.61) | 0.933(0.506-1.720) | 57(31.49) | 1.060(0.589-1.908) | 245(30.43) |
| C | 138(45.39) | 147(45.65) | 1.0(-) | 165(47.69) | 1.0(-) | 128(46.38) | 1.0(-) | 163(45.03) | 1.0(-) | 741(46.02) |
| T | 166(54.61) | 175(54.35) | 0.990(0.722-1.356) | 181(52.31) | 0.912(0.670-1.242) | 148(53.62) | 0.961(0.693-1.333) | 199(54.97) | 1.015(0.747-1.379) | 869(53.98) |
| χ2值 | 3.44 | 0.20 | 1.75 | 3.32 | 0.48 | 2.21 | ||||
| P值 | 0.05-0.1 | 0.5-0.75 | 0.1-0.25 | 0.05-0.1 | 0.25-0.50 | 0.1-0.25 | ||||
性别因素分层分析表明, 三种基因型在男/女中的分布(表1): CT为48.59%/44.16%、TT为29.94%/31.39%、CC占21.47%/24.45%, 无统计学差异. 进一步分析不同性别在各组中的分布特征, 以健康人群为对照计算其他各组的OR值, 男性患者TT在各组中显示风险降低, 特别在肝硬化组TT和CT的OR值最低(表3); 而在女性的自愈、慢乙肝和肝硬化组, CT和TT显示风险度增加, 特别在肝硬化组OR值最高, 具有统计学差异(P = 0.022)(表4). 当以自愈组为对照计算其他肝病组的OR值时, TT和CT在男性肝硬化组仍显示风险降低(表3), 而在女性肝硬化组仍显示风险度增加, 同时, 在女性肝癌组却显示风险降低(表4).
| 自愈组 | 慢乙肝组 | 肝硬化组 | 肝癌组 | |
| 与健康对照比较 | ||||
| CC | 1.0(-) | 1.0(-) | 1.0(-) | 1.0(-) |
| CT | 0.929(0.406-2.124) | 1.204(0.547-2.651) | 0.474(0.218-1.028) | 1.006(0.474-2.132) |
| TT | 0.648(0.270-1.558) | 0.578(0.245-1.360) | 0.438(0.195-0.980) | 0.772(0.353-1.692) |
| C | 1.0(-) | 1.0(-) | 1.0(-) | 1.0(-) |
| T | 0.785(0.508-1.214) | 0.729(0.483-1.099) | 0.641(0.421-0.975) | 0.857(0.581-1.625) |
| 与自愈组比较 | ||||
| CC | 1.0(-) | 1.0(-) | 1.0(-) | |
| CT | 1.296(0.619-2.710) | 0.510(0.248-1.050) | 1.083(0.539-2.175) | |
| TT | 0.891(0.387-2.055) | 0.675(0.308-1.479) | 1.192(0.557-2.552) | |
| C | 1.0(-) | 1.0(-) | 1.0(-) | |
| T | 0.929(0.624-1.383) | 0.816(0.543-1.227) | 1.092(0.750-1.590) |
| 自愈组 | 慢乙肝组 | 肝硬化组 | 肝癌组 | |
| 与健康对照比较 | ||||
| CC | 1.0(-) | 1.0(-) | 1.0(-) | 1.0(-) |
| CT | 1.643(0.737-3.663) | 1.760(0.759-4.080) | 5.202(1.367-19.804) | 0.821(0.292-2.314) |
| TT | 1.546(0.656-3.646) | 1.330(0.529-3.344) | 5.476(1.387-21.627) | 0.986(0.336-2.895) |
| C | 1.0(-) | 1.0(-) | 1.0(-) | 1.0(-) |
| T | 1.275(0.806-2.016) | 1.167(0.720-1.890) | 2.072(1.158-3.708) | 0.987(0.536-1.816) |
| 与自愈组比较 | ||||
| CC | 1.0(-) | 1.0(-) | 1.0(-) | |
| CT | 1.071(0.453-2.535) | 3.167(0.821-12.211) | 0.500(0.175-1.432) | |
| TT | 0.860(0.335-2.205) | 3.542(0.885-14.171) | 0.638(0.213-1.904) | |
| C | 1.0(-) | 1.0(-) | 1.0(-) | |
| T | 0.915(0.567-1.478) | 1.625(0.911-2.900) | 0.774(0.422-1.420) |
如表5所示, 在已知HBsAg状况的439例肝病患者中, 三种基因型分布在HBsAg+/-患者中具统计学差异(P = 0.005), 阴性患者的C等位基因频率显著高于阳性患者(P = 0.001), C更有利于HBsAg血清转化. 当加入161例自愈组(HBsAg阴性)之后进行分析时, 未发现HBsAg+/-之间有统计学差异. 另外, 基因型和等位基因在肝癌和肝硬化组的229例不同Child-Pugh肝功能分级、299例不同AFP水平以及所有患者组的433例不同DNA拷贝数之间的比较无统计学差异.
| 按临床特征分组 | CC | CT | TT | C | T |
| HBsAg(不含自愈组) | |||||
| (-) | 15(42.86) | 15(42.86) | 5(14.28) | 45(64.29) | 25(35.71) |
| (+) | 82(20.30) | 195(48.27) | 127(31.43) | 359(44.43) | 359(44.44) |
| P值 | 0.005 | 0.001 | |||
| χ2值 | 10.767 | 10.223 | |||
| HBsAg(含自愈组) | |||||
| (-) | 50(25.51) | 92(46.94) | 54(27.55) | 192(48.98) | 200(51.02) |
| (+) | 82(20.30) | 195(48.27) | 127(31.43) | 359(44.43) | 449(55.57) |
| P值 | 0.310 | 0.138 | |||
| χ2值 | 2.339 | 2.199 | |||
| AFP(ng/mL) | |||||
| <400 | 104(45.41) | 77(33.63) | 200(43.67) | 258(56.33) | |
| >400 | 17(24.28) | 31(44.29) | 22(31.43) | 65(46.43) | 75(53.57) |
| P值 | 0.833 | 0.331 | |||
| χ2值 | 0.366 | 0.565 | |||
| Child-Pugh分级 | |||||
| A | 20(22.99) | 44(50.57) | 23(26.44) | 84(48.28) | 90(51.72) |
| B | 28(19.72) | 62(43.66) | 52(36.62) | 116(41.14) | 166(58.86) |
| P值 | 0.281 | 2.229 | |||
| χ2值 | 2.540 | 0.135 | |||
| DNA(拷贝/mL) | |||||
| <1000 | 119(49.17) | 70(28.93) | 225(46.49) | 259(53.51) | |
| ≥1000 | 88(46.07) | 56(29.32) | 182(47.64) | 200(52.36) | |
| P值 | 0.756 | 0.735 | |||
| χ2值 | 0.559 | 0.115 | |||
MTHFR作为叶酸代谢的关键酶, 一方面通过催化5,10-亚甲基四氢叶酸转化为5-甲基四氢叶酸为下游各种甲基化反应提供甲基; 另一方面, 通过其底物5,10-亚甲基四氢叶酸提供的甲基使单磷酸脱氧尿苷(2'-deoxyuridine 5'-monophosphate, dUMP)转化为单磷酸脱氧胸苷(deoxythymidine monophosphate, dTMP)[11,12]. 当MTHFR酶活性降低时, 随着5,10-亚甲基四氢叶酸转化为5-甲基四氢叶酸的减少, 参与各种甲基化反应的通用供体S-腺苷蛋氨酸(S-adenosylmethionine, SAM)也减少, 最终导致基因组DNA低甲基化而增加患癌风险[14]; 而另一方面, 其活性降低可使5,10-亚甲基四氢叶酸水平升高, 导致dUMP/dTMP的比值下降, 在一定程度上减少尿嘧啶错误掺入DNA, 避免DNA双链断裂而加强DNA稳定性[12,14,21]. 因此, 从理论上分析, MTHFR酶活性降低的影响是双向的, 既有增加患病风险的可能, 也有降低患病风险的可能[22].
由于MTHFR C677T多态性影响酶活性而得到广泛研究, 现有资料表明, MTHFR C677T 的等位基因和基因型分布具有较强的地域和人种特征, T等位基因频率由低到高依次为非洲人(<10%)[23]、欧洲白人(25.1%-46.0%, 由北向南呈增加趋势)[24]、中东人(17.4%-25.7%)[23,24]、中国汉族人(21.0%-44.8%, 由南向北呈增加趋势)[5,6,24]和墨西哥人(57.0%)[24], 不同民族后裔的美国人与其原祖先有相近的频率[5,24]. 基因型分布在各地区或民族均以CC和CT为主, TT仅在墨西哥(32.2%)、意大利坎帕尼亚区(26.4%)和西西里岛(20.1%)、中国北方(19.8%)显著升高[24]. 本文分析中国天津市152例健康汉族人的T等位基因频率为54.6%, CT、TT和CC基因型频率分别为42.1%、33.6%和24.3%; 同样, 全部805例汉族人的等位基因和基因型分布与此相近(无统计学差异), 而显著高于其他汉族人的报道. 此结果表明C677T在天津市汉族人中有一个独特的分布, 其成因还有待深入研究, 可能相关遗传因素、环境因素和生活习惯等选择压力导致其在各地区及民族间的显著不同. 另一方面, 从方法学分析, 多数研究采用PCR-RFLP方法, 此限制性内切酶位点是T等位基因, 如果酶切效率不能保证100%的话, 会使基因型原本为TT的误认为CT, 导致TT基因型频率的实测值小于真实值. 本研究采用AB公司的SNP基因分型结合测序的方法, 其准确性要高于PCR-RFLP[25].
人体感染HBV后病程如何演化是宿主和病毒等多种因素共同作用的结果, MTHFR作为DNA甲基化和DNA合成/修复的关键酶之一, 也越来越得到重视. 本文研究结果显示, MTHFR C677T基因型和等位基因频率在健康对照组与自愈组、慢乙型肝炎、肝硬化和肝癌组之间无统计学差异. 这一点不同于以往关于T等位增加发生肝癌风险的分析[4,5,8,9], 而与韩国学者Kwak等[20]结果相似. 各研究结果的不一致性可能与MTHFR基因本身在影响DNA甲基化和DNA复制之间的平衡情况有关.
然而, 令人感兴趣的是, 在性别因素分层分析时, 尽管三种基因型在总体男、女性中的分布无统计学差异, 但在各类肝病组中男、女性显示了不同的分布特征和风险. 考虑到并不清楚健康人将来若感染HBV会如何进展, 因此, 以感染HBV后自愈者作为对照组分析可能更合理, 更能准确说明在感染HBV这一共同环境因子时不同基因型对肝病的风险. 通过对比分析以健康人群和自愈组为对照计算的OR值, TT和CT在男性肝硬化组显示风险降低, 而在女性肝硬化组则显示风险度增加, 同时, 在女性肝癌组却显示风险降低. 此结果表明, MTHFR C677T多态性对感染HBV的男、女性患者进展为肝硬化、肝癌的作用是不同的. 目前尚不清楚造成这种差别的原因, 可能由于性激素、血清同型半胱氨酸浓度、男女生活方式(如饮酒)以及基因-环境作用等在男/女性别中的差异[26-28], 导致TT型在不同性别的HBV感染者中参与甲基化和DNA合成的双向作用是不同的, 进而表现为患肝病的风险也不相同甚至相反, 更明确的机制尚需更深入的研究阐明.
总之, MTHFR C677T多态性在中国天津汉族人中显示了较高的TT基因型, 明显不同以往汉族人的分布特点; 同时, 分析MTHFR C677T多态性在不同性别肝病患者的分布, 提示TT和CT基因型降低男性HBV感染者患肝硬化的风险和女性HBV感染者患肝癌的风险, 而增加女性HBV感染者患肝硬化的风险. 为进一步验证此结果的准确性和探讨其机制, 我们正在收集更多各类肝病患者进行MTHFR C677T多态性分析并检测MTHFR底物或代谢物的血清水平.
HBV感染是急、慢性肝病发生的最主要原因之一, 部分感染者将最终发展为慢性肝炎、肝硬化或原发性肝癌. 随着SNP与疾病易感性研究工作的进展, 基因多态性的研究有望为筛选HBV感染高危人群以及肝病的预防工作提供可靠依据.
张凤春, 教授, 上海交通大学医学院附属仁济医院肿瘤中心.
基因多态性与HBV感染研究一直是国内外学者研究的热点, 其分布具有较强的地域和种族特征, 因此对二者进行研究可能会为HBV感染后疾病转归的机制提供一定线索.
Stern等通过对MTHFR 与肿瘤的关系进行分析表明, MTHFR C677T多态性可导致酶活性的降低, 从DNA甲基化和DNA合成两个途径促进或抑制肿瘤的发生.
MTHFR C677T多态性在中国天津汉族人中显示了较高的TT基因型, 明显不同于以往汉族人的分布特点; 而且其多态性对不同性别的人群感染HBV后疾病转归的影响有很大差别.
分析MTHFR基因多态性对天津地区汉族人感染HBV后疾病进展的影响, 有助于对本地区肝病发生的病因学进行深入研究, 在筛选HBV感染易感人群并采取有效的保护和干预措施等方面都具有潜在的应用前景.
基因多态性: 指基因组序列上的变异, 他是决定人体对疾病易感性与抵抗力、疾病临床表现及多样性、疾病进展以及不同个体对药物反应性的重要因素.
本研究阐述了MTHFR C677T多态性在中国天津汉族人中显示了较高的TT基因型频率, 同时提示MTHFR C677T多态性在HBV感染后疾病发展的过程中发挥重要作用, 是一篇较好的文章.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Rizzetto M, Ciancio A. Chronic HBV-related liver disease. Mol Aspects Med. 2008;29:72-84. [PubMed] [DOI] |
| 2. | Shi YH, Shi CH. Molecular characteristics and stages of chronic hepatitis B virus infection. World J Gastroenterol. 2009;15:3099-3105. [PubMed] [DOI] |
| 3. | Saffroy R, Pham P, Chiappini F, Gross-Goupil M, Castera L, Azoulay D, Barrier A, Samuel D, Debuire B, Lemoine A. The MTHFR 677C > T polymorphism is associated with an increased risk of hepatocellular carcinoma in patients with alcoholic cirrhosis. Carcinogenesis. 2004;25:1443-1448. [PubMed] [DOI] |
| 4. | Ventura P, Rosa MC, Abbati G, Marchini S, Grandone E, Vergura P, Tremosini S, Zeneroli ML. Hyperhomocysteinaemia in chronic liver diseases: role of disease stage, vitamin status and methylenetetrahydrofolate reductase genetics. Liver Int. 2005;25:49-56. [PubMed] [DOI] |
| 5. | Mu LN, Cao W, Zhang ZF, Cai L, Jiang QW, You NC, Goldstein BY, Wei GR, Chen CW, Lu QY. Methylenetetrahydrofolate reductase (MTHFR) C677T and A1298C polymorphisms and the risk of primary hepatocellular carcinoma (HCC) in a Chinese population. Cancer Causes Control. 2007;18:665-675. [PubMed] [DOI] |
| 6. | Yuan JM, Lu SC, Van Den Berg D, Govindarajan S, Zhang ZQ, Mato JM, Yu MC. Genetic polymorphisms in the methylenetetrahydrofolate reductase and thymidylate synthase genes and risk of hepatocellular carcinoma. Hepatology. 2007;46:749-758. [PubMed] [DOI] |
| 7. | Bronowicki JP, Abdelmouttaleb I, Peyrin-Biroulet L, Venard V, Khiri H, Chabi N, Amouzou EK, Barraud H, Halfon P, Sanni A. Methylenetetrahydrofolate reductase 677 T allele protects against persistent HBV infection in West Africa. J Hepatol. 2008;48:532-539. [PubMed] [DOI] |
| 8. | Fabris C, Toniutto P, Falleti E, Fontanini E, Cussigh A, Bitetto D, Fornasiere E, Fumolo E, Avellini C, Minisini R. MTHFR C677T polymorphism and risk of HCC in patients with liver cirrhosis: role of male gender and alcohol consumption. Alcohol Clin Exp Res. 2009;33:102-107. [PubMed] [DOI] |
| 9. | D'Amico M, Pasta L, Sammarco P. MTHFR C677TT, PAI1 4G-4G, V Leiden Q506, and prothrombin G20210A in hepatocellular carcinoma with and without portal vein thrombosis. J Thromb Thrombolysis. 2009;28:70-73. [PubMed] [DOI] |
| 10. | Jin F, Qu LS, Shen XZ. Association between the methylenetetrahydrofolate reductase C677T polymorphism and hepatocellular carcinoma risk: a meta-analysis. Diagn Pathol. 2009;4:39. [PubMed] [DOI] |
| 11. | Rozen R. Genetic predisposition to hyperhomocysteinemia: deficiency of methylenetetrahydrofolate reductase (MTHFR). Thromb Haemost. 1997;78:523-526. [PubMed] |
| 12. | Blount BC, Mack MM, Wehr CM, MacGregor JT, Hiatt RA, Wang G, Wickramasinghe SN, Everson RB, Ames BN. Folate deficiency causes uracil misincorporation into human DNA and chromosome breakage: implications for cancer and neuronal damage. Proc Natl Acad Sci U S A. 1997;94:3290-3295. [PubMed] [DOI] |
| 13. | Frosst P, Blom HJ, Milos R, Goyette P, Sheppard CA, Matthews RG, Boers GJ, den Heijer M, Kluijtmans LA, van den Heuvel LP. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat Genet. 1995;10:111-113. [PubMed] [DOI] |
| 14. | Stern LL, Mason JB, Selhub J, Choi SW. Genomic DNA hypomethylation, a characteristic of most cancers, is present in peripheral leukocytes of individuals who are homozygous for the C677T polymorphism in the methylenetetrahydrofolate reductase gene. Cancer Epidemiol Biomarkers Prev. 2000;9:849-853. [PubMed] |
| 15. | Boccia S, Hung R, Ricciardi G, Gianfagna F, Ebert MP, Fang JY, Gao CM, Götze T, Graziano F, Lacasaña-Navarro M. Meta- and pooled analyses of the methylenetetrahydrofolate reductase C677T and A1298C polymorphisms and gastric cancer risk: a huge-GSEC review. Am J Epidemiol. 2008;167:505-516. [PubMed] [DOI] |
| 16. | Sun L, Sun YH, Wang B, Cao HY, Yu C. Methylenetetrahydrofolate reductase polymorphisms and susceptibility to gastric cancer in Chinese populations: a meta-analysis. Eur J Cancer Prev. 2008;17:446-452. [PubMed] [DOI] |
| 17. | Kono S, Chen K. Genetic polymorphisms of methylenetetrahydrofolate reductase and colorectal cancer and adenoma. Cancer Sci. 2005;96:535-542. [PubMed] [DOI] |
| 18. | Pereira TV, Rudnicki M, Pereira AC, Pombo-de-Oliveira MS, Franco RF. 5,10-Methylenetetrahydrofolate reductase polymorphisms and acute lymphoblastic leukemia risk: a meta-analysis. Cancer Epidemiol Biomarkers Prev. 2006;15:1956-1963. [PubMed] [DOI] |
| 19. | Mao R, Fan Y, Jin Y, Bai J, Fu S. Methylenetetrahydrofolate reductase gene polymorphisms and lung cancer: a meta-analysis. J Hum Genet. 2008;53:340-348. [PubMed] [DOI] |
| 20. | Kwak SY, Kim UK, Cho HJ, Lee HK, Kim HJ, Kim NK, Hwang SG. Methylenetetrahydrofolate reductase (MTHFR) and methionine synthase reductase (MTRR) gene polymorphisms as risk factors for hepatocellular carcinoma in a Korean population. Anticancer Res. 2008;28:2807-2811. [PubMed] |
| 21. | Machover D, Zittoun J, Saffroy R, Broët P, Giraudier S, Magnaldo T, Goldschmidt E, Debuire B, Orrico M, Tan Y. Treatment of cancer cells with methioninase produces DNA hypomethylation and increases DNA synthesis. Cancer Res. 2002;62:4685-4689. [PubMed] |
| 22. | Lin J, Spitz MR, Wang Y, Schabath MB, Gorlov IP, Hernandez LM, Pillow PC, Grossman HB, Wu X. Polymorphisms of folate metabolic genes and susceptibility to bladder cancer: a case-control study. Carcinogenesis. 2004;25:1639-1647. [PubMed] [DOI] |
| 23. | Schneider JA, Rees DC, Liu YT, Clegg JB. Worldwide distribution of a common methylenetetrahydrofolate reductase mutation. Am J Hum Genet. 1998;62:1258-1260. [PubMed] [DOI] |
| 24. | Wilcken B, Bamforth F, Li Z, Zhu H, Ritvanen A, Renlund M, Stoll C, Alembik Y, Dott B, Czeizel AE. Geographical and ethnic variation of the 677C>T allele of 5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide. J Med Genet. 2003;40:619-625. [PubMed] [DOI] |
| 25. | Wong FL, Wang MK, Boo NY, Hamidah NH, Ainoon BO. Rapid detection of the UGT1A1 single nucleotide polymorphism G211A using real-time PCR with Taqman minor groove binder probes. J Clin Lab Anal. 2007;21:167-172. [PubMed] [DOI] |
| 26. | Dierkes J, Jeckel A, Ambrosch A, Westphal S, Luley C, Boeing H. Factors explaining the difference of total homocysteine between men and women in the European Investigation Into Cancer and Nutrition Potsdam study. Metabolism. 2001;50:640-645. [PubMed] [DOI] |
| 27. | Kluijtmans LA, Young IS, Boreham CA, Murray L, McMaster D, McNulty H, Strain JJ, McPartlin J, Scott JM, Whitehead AS. Genetic and nutritional factors contributing to hyperhomocysteinemia in young adults. Blood. 2003;101:2483-2488. [PubMed] [DOI] |
| 28. | Adinolfi LE, Ingrosso D, Cesaro G, Cimmino A, D'Antò M, Capasso R, Zappia V, Ruggiero G. Hyperhomocysteinemia and the MTHFR C677T polymorphism promote steatosis and fibrosis in chronic hepatitis C patients. Hepatology. 2005;41:995-1003. [PubMed] [DOI] |