修回日期: 2010-05-05
接受日期: 2010-05-10
在线出版日期: 2010-05-28
目的: 探讨缺血性脑卒中大鼠小肠动力的改变及与血清Ghrelin变化的关系.
方法: 48只♂Wistar大鼠随机分为对照组(n = 8)和实验组(n = 40), 实验组按照3、6、12、24、48 h随机分为5个亚组, 每组大鼠8只. 采用Longa线栓法建立大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型(对照组组大鼠仅切开皮肤, 不放线栓), 所有大鼠进行神经生物学评分, MCAO组进行脑组织TTC染色. 美蓝染色法检测肠动力; 酶联免疫法测定血清Ghrelin水平; 取距回盲部5 cm处小肠, 光镜及电镜下观察肠黏膜组织的变化.
结果: 对照组大鼠神经生物评分为0分, MCAO组大鼠神经生物评分为1-3分, MCAO组大鼠脑组织TTC染色可见缺血坏死区. MCAO各亚组的小肠推进比均明显低于对照组(P<0.05), 脑缺血后24 h降至最低. MCAO各亚组血清Ghrelin水平均明显高于对照组(P<0.05), 血清Ghrelin水平于术后3 h即升高, 24 h达峰值. 相关性分析显示缺血性脑卒中大鼠血清Ghrelin水平与小肠推进比之间呈线性关系(r = -0.841, P<0.05). 光镜下MCAO组肠黏膜上皮细胞受损, 电镜下可见大量线粒体肿胀、嵴断裂, 细胞器空泡变性, 细胞间紧密连接偶见增宽, 可见凋亡细胞.
结论: MCAO大鼠局灶性脑缺血后出现肠动力改变、血清Ghrelin水平变化, 脑缺血24 h内小肠动力显著下降, 考虑可能与脑缺血应激后多种因素共同作用的结果, 其机制仍需进一步研究.
引文著录: 啜佳然, 朱玉群, 徐立新, 袁芳, 安博, 徐有青. 缺血性脑卒中大鼠小肠动力异常及与血清Ghrelin变化的关系. 世界华人消化杂志 2010; 18(15): 1550-1554
Revised: May 5, 2010
Accepted: May 10, 2010
Published online: May 28, 2010
AIM: To determine the changes in serum ghrelin and small intestinal motility in rats with cerebral arterial thrombosis and to explore their relationship.
METHODS: Forty-eight Wistar rats were randomly divided into two groups: control group (n = 8) and middle cerebral artery occlusion (MCAO) group (n = 40). The MCAO group was further equally divided into 5 subgroups for testing at 3, 6, 12, 24 and 48 h after cerebral arterial thrombosis. MCAO was induced in rats using the thread occlusion method proposed by Longa. Neurologic examinations were conducted and neurologic findings were scored at each time point. Triphenyltetrazolium chloride (TTC) staining of brain tissue was performed. The content of serum ghrelin was determined by enzyme-linked immunosorbent assay, and small intestinal motility was measured by methylene blue staining. The ileum tissue was examined by light and electron microscopy.
RESULTS: The neurologic scores were 0 for all the rats in the control group and 1-3 for those in the MCAO group. Small intestinal motility was significantly lower in the MCAO group than in the control group (P < 0.05), reaching the lowest level at 24 h. Serum ghrelin level increased at 3 h and reached the peak at 24 h. Serum ghrelin level was significantly higher in the MCAO group than in the control group (P < 0.05). Correlation analysis showed a linear relationship between serum ghrelin levels and small intestinal motility (r = -0.841, P < 0.05) in rats with MCAO. Intestinal mucosal injury could be seen by light and electron microscopy, such as intestinal villus swelling, chondrosome swelling, vacuolar degeneration, apoptosis, etc.
CONCLUSION: Changes in serum ghrelin and small intestinal motility occur in rats with MCAO. The change of intestinal motility is significant at 24 h after cerebral ischemia.
- Citation: Chuai JR, Zhu YQ, Xu LX, Yuan F, An B, Xu YQ. Changes in serum ghrelin and small intestinal motility in rats with cerebral arterial thrombosis. Shijie Huaren Xiaohua Zazhi 2010; 18(15): 1550-1554
- URL: https://www.wjgnet.com/1009-3079/full/v18/i15/1550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i15.1550
缺血性脑卒中在近几年的发病率有明显升高趋势, 不但给患者带来痛苦, 而且引起一系列并发症, 造成患者预后不良、生活质量降低, 甚至死亡. 其中, 胃肠道反应不容忽略, 多数学者认为, 胃肠道通常是全身应激性炎症反应的始动和扩大器官, 因此, 胃肠动力障碍的病因和发病机制成为提高疗效、改善预后的一个突破口. 然而胃肠动力障碍的发病机制是复杂的、多因素参与的病理生理过程, 其发病机制至今尚未完全阐明. 本研究仅在一种胃肠激素Ghrelin与小肠动力之间作初步探讨.
1.1 材料
健康♂Wistar大鼠48只(购自北京维通利华实验动物技术有限公司), 体质量200-220 g, 尼龙栓线(购自北京沙东生物技术有限公司), Ghrelin试剂盒(购自北京康泰生物科技有限公司), 亚甲蓝(methylthioninium, 购自北京化学试剂有限公司).
1.2 方法
1.2.1 实验动物分组及模型建立: 实验动物分为6组. 对照组(假手术组)8只, 仅切开皮肤, 不放线栓; 实验组(MCAO模型组)40只, 随机分为3、6、12、24、48 h组, 每组8只. 采用Longa线栓法建立大鼠大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型[1]. 各组手术时间相同, 无菌操作, 室温恒定为26 ℃.
1.2.2 神经生物学评分及脑组织TTC染色: 本研究MCAO模型, 实验动物行神经生物学评分及脑组织TTC染色, 模型成功者进行下一步实验研究, 大鼠清醒后参考Longa等[1]的方法进行神经生物学评分, 确定MCAO模型的建立.
1.2.3 亚甲蓝染色法测小肠推进比: 预先用蒸馏水配制成50%的亚甲蓝染色剂, 所有大鼠术前正常进食、饮水, 将实验组大鼠分别于相应时间点前30 min自大鼠口腔插入鼠胃管, 注入染色剂1.0 mL, 30 min后麻醉大鼠, 开腹, 标志染料终末端, 测量幽门括约肌至蓝染小肠末端距离与整个小肠长度之比(幽门括约肌至回盲部), 为小肠推进比.
1.2.4 血清Ghrelin含量: 10%水合氯醛腹腔麻醉(4 mL/kg), 心脏取血3-4 mL, 采用酶联免疫法检测血清Ghrelin值. 操作按试剂盒说明书进行.
1.2.5 病理组织学观察: 取回肠末段(距回盲部5 cm)组织, 光镜、电镜下观察肠黏膜组织学变化.
统计学处理 用SPSS13.0统计软件对数据进行方差分析, 实验数据以mean±SD表示, 以P<0.05为差异有统计学意义; MCAO组小肠推进比和血清Ghrelin水平之间采用直线相关进行统计学分析.
大鼠清醒后, 对照组大鼠未见神经生物学异常表现. MCAO组大鼠均出现行为学障碍, 主要表现为对侧肢体无力、触觉减低, 提尾时对侧前肢屈曲, 或不能直行仅向对侧转圈, 患侧出现Horner 征, 神经生物学评分为1-3分. 其中, 对照、3、6、12、24、48 h的平均分分别为: 0、1.00、2.00、2.00、2.00、2.25. 将MCAO组大鼠断头取脑, 行TTC染色, 可见脑组织存在未染色区域, 为缺血坏死区. MCAO模型建立成功.
MCAO组各时间点的小肠推进比均明显低于对照组, 差异具有统计学意义(P<0.05). 脑缺血后24 h小肠动力降至最低, 至48 h有所恢复但仍未恢复正常(表1).
MCAO组各时间点血清Ghrelin水平均明显高于对照组, 差异具有统计学意义(P<0.05). MCAO早期血清Ghrelin水平逐渐升高, 于缺血后24 h达高峰, 此后下降, 至48 h未恢复正常(表1).
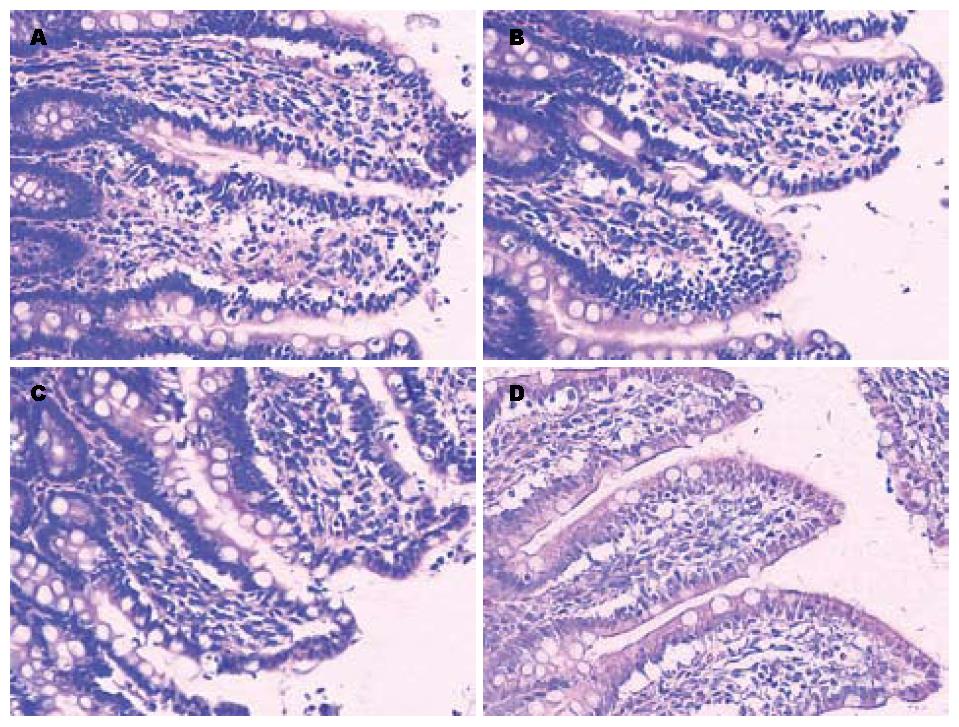
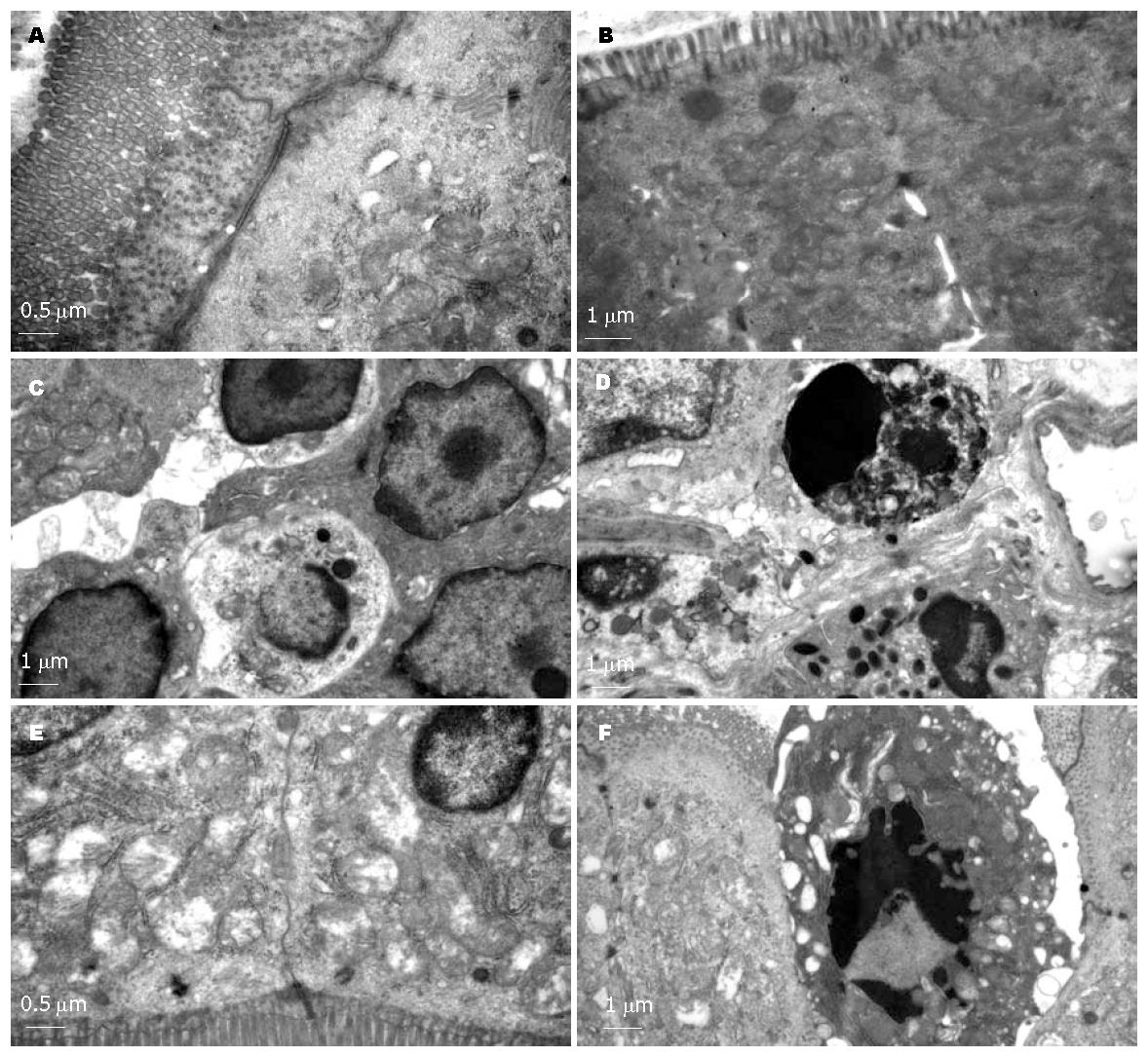
对照组在光镜、电镜下小肠黏膜结构基本完整. 光镜下MCAO组术后可见小肠绒毛肿胀、增粗、缩短, 绒毛顶端破损、剥脱, 固有层裸露. 电镜下MCAO组可见大量线粒体肿胀、嵴断裂, 随者时间推移细胞器空泡变性程度加重, 细胞间紧密连接偶见增宽, 偶见凋亡细胞. 对照组在光镜、电镜下小肠黏膜结构基本完整(图1, 图2).
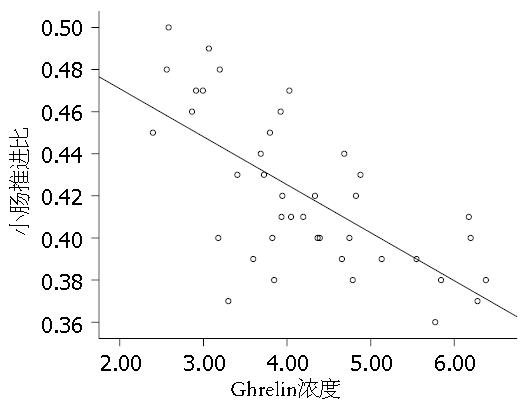
结果显示, MCAO大鼠血清Ghrelin水平与小肠推进比之间呈线性关系(相关系数r = -0.841, P<0.05), 二者呈负相关(图3).
临床和动物实验研究发现, 缺血性脑卒中可引起胃肠动力的改变. 多数实验结果显示, 应激状态下结肠运动显著增强, 而应激对胃和小肠运动的影响尚存在争议. 本实验通过观察小肠推进比来反映肠道运动情况, 结果显示MCAO各亚组小肠推进比均显著低于对照组, 支持在缺血性脑卒中早期存在小肠运动功能障碍.
对于缺血性脑卒中后胃肠动力改变的机制尚不十分清楚. 一些研究证明, 应激后胃肠动力的改变可能与某些胃肠激素的改变有关. 刘婧等[2]在临床中观察了烧、烫伤急性期出现腹胀、恶心、呕吐等胃肠动力功能紊乱的患者, 发现促胃肠动力的胆囊收缩素-8(CCK-8)、生长抑素(SS)、胃动素(GAS)水平显著升高, 而起抑制作用的血管活性肠肽(VIP)水平降低; 在动物实验研究发现, 应激使大鼠胃窦的规则收缩消失、运动加强, VIP对增强的胃运动有明显的抑制效应, 大鼠血浆内VIP含量在应激后1-2 h显著升高, CCK-8含量于应激后即刻升高, 随后恢复正常. Nakade等[3]通过动物实验发现, 束缚应激下的大鼠可以通过促肾上腺皮质激素释放因子(CRF)的作用延缓胃排空. 急性胰腺炎时小肠肌间神经丛和黏膜下层非肾上腺非胆碱能神经元中一氧化氮合酶(nNOS)表达增加、活性增强进而产生大量一氧化氮, 引起胃肠电生理紊乱, 抑制胃肠运动[4].
Ghrelin作为新近发现的脑肠肽, 参与胃肠动力的调节, 但与缺血性脑卒中胃肠动力变化的相关研究不多. Ghrelin又叫胃促生长素, 是生长激素促分泌剂(GH-Ss)受体的内源性配体. 研究发现Ghrelin对大鼠的采食量和胃酸分泌有促进作用[5,6]. Masada等[7]描述了小鼠静脉内注射Ghrelin所出现的胃的收缩反应加强, 阿托品和迷走神经切断术可以阻断这种效应. Tebbe等[8]研究提示Ghrelin在下丘脑室旁核可通过神经肽Y1受体和非选择性的促肾上腺激素释放因子1受体发挥胃肠动力的中枢调节作用. Ghrelin受营养状况和激素因素调节. 高脂饮食、高体质量指数、摄食增加可以抑制Ghrelin的分泌. 而饥饿、低蛋白饮食、体质量减轻则可以使Ghrelin分泌增多[9-11].
大量的研究证明[8,12], Ghrelin具有促进胃排空及肠运动的作用. 而本实验结果显示, MCAO组大鼠血清Ghrelin水平均明显高于对照组, 与小肠推进比呈负相关, 这与我们最初的设想不一致. 其原因可能是: 脑缺血应激可能使多种促进和/或抑制胃肠运动的激素水平发生变化, 他们共同作用的结果导致小肠运动减慢, 与此同时, 小肠平滑肌形态学改变以及小肠电生理的变化亦是影响其运动的重要因素. 虽然在脑缺血24 h内血清Ghrelin水平代偿性升高, 但是仍不能逆转小肠运动减慢的最终结果. Masada等[7]研究证实, 短时间(15 min)的大脑中动脉闭塞能诱导HSP70大量合成, 以减轻再次缺血造成的脑水肿和脑血管损伤, 外源性给予Ghrelin亦可提高HSP70的细胞保护作用.
从本研究可以看到MCAO组大鼠脑缺血早期即发生肠动力和血清Ghrelin水平的明显变化, 血清Ghrelin水平上升, 小肠运动功能降低, 二者呈明显的背向趋势, 我们考虑, 在脑缺血早期机体以代偿为主, 血清Ghrelin水平反应性上调以减轻脑损伤, 同时力求加快肠道蠕动, 以减轻肠黏膜屏障的损害, 体现了机体自身抗损伤能力. 脑缺血后小肠运动功能降低, 表明机体的代偿仍不能维持肠道正常的生理功能, 同时也表明脑缺血后肠运动功能障碍可能是由多种因素共同作用的结果, 血清Ghrelin水平变化可能不是其主要或者唯一的影响因素. 另外, 本实验光镜下观察小肠绒毛可见形态学异常改变, 透射电镜下肠黏膜细胞的超微结构亦出现异常改变. 其中, 线粒体的损伤提示肠黏膜细胞损伤的过程, 可能与小肠动力下降有关.
中国缺血性脑卒中发病率位居世界第一, 具有高致死率、高复发率、高致残率的特点. 多数研究认为胃肠道是全身应激性炎症反应和多器官功能障碍的始动和扩大器官.
李勇, 副教授, 上海中医药大学附属市中医医院消化科.
针对Ghrelin促进胃肠动力以及保护神经细胞的作用, Ghrelin可能对改善脑缺血后胃肠功能障碍、减轻脑损伤具有一定意义, 亟待解决的问题是Ghrelin在人类患者中的可用性、剂量及给药时机.
本研究显示, 脑缺血早期血清Ghrelin代偿性升高, 但不足以维持肠动力, 考虑外源性给予适量Ghrelin是否可以改善脑缺血后肠动力障碍, 可能为脑缺血患者的早期临床干预提供依据, 从而缩短疗程, 改善预后.
本文思路清晰, 实验设计合理, 技术手段以及统计学方法使用较为恰当, 具有一定的科学性.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Longa EZ, Weinstein PR, Carlson S, Cummins R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 1989;20:84-91. [PubMed] [DOI] |
| 3. | Nakade Y, Tsuchida D, Fukuda H, Iwa M, Pappas TN, Takahashi T. Restraint stress delays solid gastric emptying via a central CRF and peripheral sympathetic neuron in rats. Am J Physiol Regul Integr Comp Physiol. 2005;288:R427-R432. [PubMed] [DOI] |
| 5. | Asakawa A, Inui A, Fujimiya M, Sakamaki R, Shinfuku N, Ueta Y, Meguid MM, Kasuga M. Stomach regulates energy balance via acylated ghrelin and desacyl ghrelin. Gut. 2005;54:18-24. [PubMed] [DOI] |
| 6. | Toshinai K, Yamaguchi H, Sun Y, Smith RG, Yamanaka A, Sakurai T, Date Y, Mondal MS, Shimbara T, Kawagoe T. Des-acyl ghrelin induces food intake by a mechanism independent of the growth hormone secretagogue receptor. Endocrinology. 2006;147:2306-2314. [PubMed] [DOI] |
| 7. | Masada T, Hua Y, Xi G, Ennis SR, Keep RF. Attenuation of ischemic brain edema and cerebrovascular injury after ischemic preconditioning in the rat. J Cereb Blood Flow Metab. 2001;21:22-33. [PubMed] [DOI] |
| 8. | Tebbe JJ, Mronga S, Tebbe CG, Ortmann E, Arnold R, Schäfer MK. Ghrelin-induced stimulation of colonic propulsion is dependent on hypothalamic neuropeptide Y1- and corticotrophin-releasing factor 1 receptor activation. J Neuroendocrinol. 2005;17:570-576. [PubMed] [DOI] |
| 9. | Lee HM, Wang G, Englander EW, Kojima M, Greeley GH. Ghrelin, a new gastrointestinal endocrine peptide that stimulates insulin secretion: enteric distribution, ontogeny, influence of endocrine, and dietary manipulations. Endocrinology. 2002;143:185-190. [PubMed] [DOI] |
| 10. | Monteleone P, Serritella C, Martiadis V, Scognamiglio P, Maj M. Plasma obestatin, ghrelin, and ghrelin/obestatin ratio are increased in underweight patients with anorexia nervosa but not in symptomatic patients with bulimia nervosa. J Clin Endocrinol Metab. 2008;93:4418-4421. [PubMed] [DOI] |
| 11. | Mager U, Degenhardt T, Pulkkinen L, Kolehmainen M, Tolppanen AM, Lindström J, Eriksson JG, Carlberg C, Tuomilehto J, Uusitupa M. Variations in the ghrelin receptor gene associate with obesity and glucose metabolism in individuals with impaired glucose tolerance. PLoS One. 2008;3:e2941. [PubMed] [DOI] |
| 12. | Xu L, Depoortere I, Tomasetto C, Zandecki M, Tang M, Timmermans JP, Peeters TL. Evidence for the presence of motilin, ghrelin, and the motilin and ghrelin receptor in neurons of the myenteric plexus. Regul Pept. 2005;124:119-125. [PubMed] [DOI] |