修回日期: 2010-04-24
接受日期: 2010-04-27
在线出版日期: 2010-05-28
目的: 检测非酒精性脂肪肝大鼠肝脏中L-FABP、PPAR-α mRNA的动态变化, 探讨非酒精性脂肪肝的发病机制.
方法: ♂大鼠84只, 体质量180 g±10 g, 随机分为饮食基础饲料的正常对照组和饮食高脂饲料的实验组; 各组又随机分为0、2、4、8、12、16、18 wk 7个时相组, 其中高脂饲料组在12 wk以后饮食正常饲料, 使其脂肪肝处于自然恢复状态. 分别于不同时相从心脏取血, 测定血清中ALT、TG、CHOL、HDL-C和LDL-C的含量; 收集肝脏标本, 分别进行病理学检测和L-FABP和PPAR-α mRNA的动态变化检测.
结果: 对照组大鼠肝脏L-FABP和PPAR-α mRNA在不同时相间的表达无显著性变化. 高脂饮食脂肪肝大鼠第2周时病理切片没有观察到脂肪变性. L-FABP mRNA在第4周升高(0.59±0.06 vs 0.52±0.03, P<0.05), 第8、12周显著升高(0.91±0.07, 0.92±0.08 vs 0.52±0.03, 均P<0.01), 正常饮食6 wk后显著下降(0.59±0.04 vs 0.92±0.08, P<0.01), 但是与对照组比较仍升高(P<0.05). PPAR-α mRNA在第4周下降(1.05±0.09 vs 1.13±0.07, P<0.05), 第8、12周显著下降(0.89±0.04, 0.85±0.07 vs 1.13±0.07, 均P<0.01), 正常饮食6 wk后显著升高(1.04±0.07 vs 0.85±0.07, P<0.01), 但是与对照组比较仍下降(P<0.05). 脂肪变性面积在第12周时最大, 但未见明显的炎症反应, 正常饮食6 wk后脂肪变性明显好转.
结论: 高脂饮食脂肪肝大鼠模型L-FABP mRNA表达阈值的出现和PPAR-α mRNA表达下调可能在脂肪变性形成过程中起到重要作用, 且单纯脂肪变性在一定程度上是可以通过饮食调节自然恢复的.
引文著录: 朱金玲, 张虎, 张淑红, 姚海涛, 张金波, 祝丽玲. 非酒精性脂肪肝大鼠L-FABP和PPAR-α mRNA的动态表达. 世界华人消化杂志 2010; 18(15): 1525-1530
Revised: April 24, 2010
Accepted: April 27, 2010
Published online: May 28, 2010
AIM: To establish a rat model of nonalcoholic fatty liver disease (NAFLD) to detect the changes in the expression of liver fatty acid-binding protein (L-FABP) and peroxisome proliferator-activated receptor-α (PPAR-α) mRNAs in NAFLD and to explore the mechanism underlying the pathogenesis of the disease.
METHODS: Eighty-four male Wistar rats were randomly and equally divided into two groups: control group (fed a normal diet for 18 weeks) and model group (fed a high-fat diet for 12 wk and a normal diet for another 6 wk). Each group was further divided into 7 subgroups for testing at weeks 0, 2, 4, 8, 12, 16 and 18. Rats in the two groups were sacrificed at each time point. Blood samples were taken to measure serum ALT, TG, CHOL, HDL-C and LDL-C. Liver samples were taken for HE staining and for detection of the expression of L-FABP and PPAR-α mRNAs by real-time fluorescence quantitative RT-PCR.
RESULTS: The expression of L-FABP and PPAR-α mRNAs in control rats showed no obvious changes. No steatosis was observed at week 2 in rats fed a high-fat diet. The expression of L-FABP mRNA increased obviously in rats fed a high-fat diet at week 4 (0.59 ± 0.06 vs 0.52 ± 0.03, P < 0.05), reaching the peak at weeks 8 and 12 (0.91 ± 0.07 and 0.92 ± 0.08 vs 0.52 ± 0.03, respectively; both P < 0.01). At week 18, the expression level of L-FABP mRNA declined significantly (0.59 ± 0.04 vs 0.92 ± 0.08, P < 0.01) but was still higher than that in the control group (P < 0.05). The expression of PPAR-α mRNA decreased obviously in rats fed a high-fat diet at week 4 (1.05 ± 0.09 vs 1.13 ± 0.07, P < 0.05), reaching the lowest level at weeks 8 and 12 (0.89 ± 0.04 and 0.85 ± 0.07 vs 1.13 ± 0.07, respectively; both P < 0.01). At week 18, the expression level of PPAR-α mRNA was elevated obviously (1.04 ± 0.07 vs 0.85 ± 0.07, P < 0.01) but was still lower than that in the control group. Steatosis become worst at week 12 but was improved greatly at week 18.
CONCLUSION: In the progression of rat NAFLD, PPAR-α mRNA expression decreases and L-FABP mRNA expression increases as steatosis becomes worse. Steatosis can be improved through diet.
- Citation: Zhu JL, Zhang H, Zhang SH, Yao HT, Zhang JB, Zhu LL. Dynamic expression of L-FABP and PPAR-α mRNAs in nonalcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(15): 1525-1530
- URL: https://www.wjgnet.com/1009-3079/full/v18/i15/1525.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i15.1525
肝型脂肪酸结合蛋白(liver fatty acid binding protein, L-FABP)是脂肪酸结合蛋白(fatty acid binding proteins, FABPs)家族成员之一. L-FABP主要表达于肝脏组织, 介导脂肪酸及多种疏水基团转运, 涉及脂类代谢疾病的发病机制. 多年来其转运机制备受关注[1-4]. 过氧化物酶体增殖物激活受体-α(peroxisome proliferator-activated receptor-α, PPAR-α)是一种由配体激活的核转录因子, 属于核受体超家族成员, 具有调节脂肪代谢、炎症、免疫以及细胞分化的作用, 从而参与脂肪性肝病的发病机制[5-7]. 本文结合非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)大鼠模型建立及恢复过程中肝脏病理变化及血清指标的变化, 探讨L-FABP和PPAR-α可能的作用机制.
清洁级Wistar大鼠, ♂, 体质量180 g±10 g, 购自佳木斯大学实验动物中心, 实验动物中心许可证编号: SYXK(黑)2006-004. 胆固醇、胆酸盐购自北京奥博星生物技术责任有限公司, 猪油自制. TRIzol购自Invitrogen公司, TaqMan® Reverse Transcription Reagents, TaqMan® Gene Expression Master Mix, TaqMan® Gene Expression Assays, Power SYBR® Green PCR Master Mix, Rnase抑制剂均购自美国ABI公司. PPAR-α引物引自文献[8], β-actin引物由TaKaRa公司设计并合成.
1.2.1 造模及分组: 大鼠84只饲养1 wk后, 随机分为正常对照组和高脂饮食组, 每组42只, 各组又分为0、2、4、8、12、16、18 wk 7个时相组, 每时相组6只. 正常对照组给予基础饲料, 高脂饮食组饲料配比如下: 基础饲料87.8%、猪油10%、胆固醇2%、胆盐0.2%, 自然采食.分别于不同时相以0.1 g/kg体质量氯胺酮麻醉大鼠, 腹主动脉采血, 切取肝脏右叶0.5 cm×0.4 cm×0.5 cm大小组织块浸泡在100 g/L酸性甲醛固定液中, 剩余肝脏储存于液氮中备用.
1.2.2 血清中指标测定: 3 000 r/min离心血液10 min, 取上层血清, 通过采用自动生化学分析仪测定丙氨酸氨基转移酶(alanine amiotransferase, ALT)、三酰甘油(triglyceride, TG)、胆固醇(cholesterol, CHOL)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C).
1.2.3 病理学检查: 甲醛固定后进行石蜡切片, HE染色, 观察脂肪肝程度.
1.2.4 荧光定量RT-PCR: (1)RNA提取: 从液氮中取出肝脏组织, 研钵中边加液氮边研磨, 充分研磨, 取小米粒大小粉末放入Eppendorf管中, 加入1 mL TRIzol, 充分混匀. 加入0.2 mL氯仿, 剧烈震荡15 s, 室温孵育5 min. 4 ℃, 10 000 g, 离心15 min, 将0.4 mL无色水相移至另一Eppendorf管. 加入0.4 mL异丙醇, 静置10 min, 4 ℃ 10 000 g离心10 min, 弃上清. 沉淀加入750 mL/L乙醇1 mL, 洗涤沉淀物. 4℃ 7 500 r/min离心5 min, 弃上清. 自然干燥10 min, 加入10 μL DEPC处理的双蒸水溶解, 55 ℃-60 ℃孵育10 min. 取1 μL溶解好的RNA溶液, DEPC水稀释至100 μL, 微量分光光度计检测RNA纯度和浓度, 1%甲醛变性琼脂糖凝胶电泳检测RNA的完整性. (2)反转录: 依据说明书取总RNA 2 μg, 10×反转录缓冲液2 μL, 100 mmol/L dNTP 0.8 μL, 10×反转录随机引物2 μL, 50 U/μL反转录酶1 μL, 40 U/μL RNA酶抑制剂0.5 μL, DEPC处理过的去离子水补至20 μL. 25 ℃ 10 min, 37 ℃ 120 min, 85 ℃ 5 s, -20 ℃保存待用. (3)荧光定量PCR: 取500 ng cDNA依次梯度稀释1倍、10倍、102倍、103倍、104倍, 分别作为模板按照以下反应体系和反应条件进行扩增, 7300 PCR仪自动生成标准曲线, 通过R2值检验标准曲线的可行性. 每一个待测指标对应一条标准曲线, 且标准曲线的模板来自同一管cDNA. 依据说明书取cDNA 50 ng, 2×TAQMEN PCR预混液10 μL, 20×基因表达试剂盒1 μL, 灭菌去离子水补至20 μL, 50 ℃ 2 min预热, 95 ℃ 10 min预变性, 然后95 ℃ 15 s, 60 ℃ 1 min, 40个循环. L-FABP和Actb的引物序列和探针序列均购自美国ABI公司, 编号分别为: Rn00664587_m1, Fabp1, rCG56226, 扩增产物大小129 bp; Rn00667869_m1, Actb, rCG42822, 扩增产物大小91 bp. 依据说明书取cDNA 50 ng, 2×SYBR GREEN PCR预混液10 μL, 10 μmol/L的上下游引物各0.4 μL, 灭菌去离子水补至20 μL, 50 ℃ 2min预热, 95 ℃ 10 min预变性, 然后95 ℃ 15 s, 58 ℃ 1 min, 40个循环, 每个循环均设置荧光收集步骤: 95 ℃ 15 s, 60℃ 30 s, 95 ℃ 15 s. β-actin上游引物: 5'-CATCCGTAAAGACCTCTATGCCAAC-3', 下游引物: 5'-ATGGAGCCACCGATCCACA- 3', 扩增产物长度171 bp. PPAR-α上游引物: 5'-TGAACAAAGACGGGATG-3', 下游引物: 5'-TCAAACTTGGGTTCCATGAT-3', 扩增产物长度106 bp.
统计学处理 实验所得计量资料用mean±SD表示, 应用SPSS15.0软件进行单因素方差分析(One-way ANOVA), P<0.05表示差异有统计学意义. 两两比较采用LSD检验.
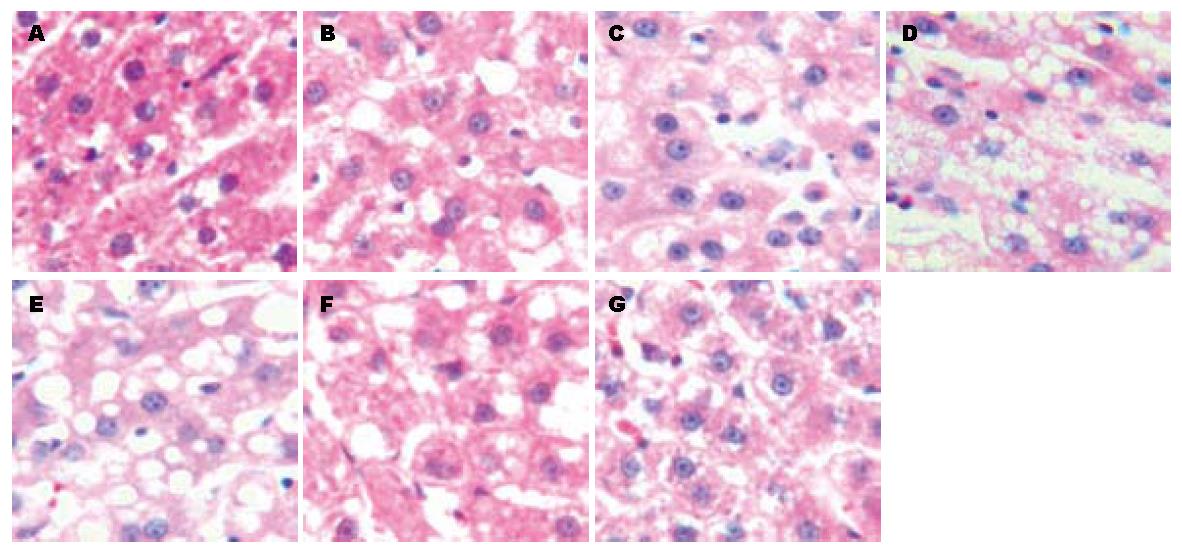
高脂饮食脂肪肝大鼠造模过程中及恢复正常饮食过程中肝脏病理学变化见图1. 第4周时出现轻微脂肪变性, 第8周脂肪变性增强, 第12周时脂肪变性最严重, 但是并未发现明显的炎症反应. 恢复正常饮食4 wk后, 即第16周时还有较轻微的脂肪变性, 第18周恢复明显.
高脂饮食脂肪肝大鼠造模过程中及恢复正常饮食过程中血清指标的动态变化(表1).
| 指标 | 对照组(0 wk) | 高脂饮食组 | 恢复正常饮食组 | ||||
| 第2周 | 第4周 | 第8周 | 第12周 | 第16周 | 第18周 | ||
| ALT(U/L) | 42.67±2.52 | 49.67±3.05 | 61.00±2.00b | 79.00±8.72b | 72.33±5.86b | 55.33±3.21bd | 48.67±1.53d |
| TG(mmoL/L) | 0.62±0.04 | 0.64±0.04 | 0.72±0.03a | 0.75±0.05b | 0.86±0.04b | 0.76±0.07ac | 0.67±0.03d |
| CHOL(mmoL/L) | 1.10±0.08 | 1.17±0.05 | 1.45±0.05b | 1.77±0.07b | 1.94±0.07b | 1.22±0.06ad | 1.17±0.02d |
| HDL-C(mmoL/L) | 0.87±0.04 | 0.79±0.02a | 0.74±0.06b | 0.59±0.02b | 0.62±0.04b | 0.77±0.04ad | 0.81±0.03d |
| LDL-C(mmoL/L) | 0.32±0.03 | 0.47±0.06 | 1.06±0.07b | 1.59±0.18b | 1.85±0.09b | 0.58±0.09ad | 0.38±0.03d |
NAFLD是一种与代谢综合征(metabolic syndrome, MS)有关的肝病, 其病程包括单纯性脂肪肝、脂肪性肝炎、脂肪性肝纤维化和肝硬化[9]. 最常见的危险因子是肥胖、糖尿病和高TG血症. 其他诱因包括毒性物质、药物、先天性代谢障碍[10-12]. NAFLD的病理生理学仍需深入研究, 但是实质的证据已经揭示了几种机制. 由胰岛素抵抗(insulin resistance, IR)引起的过量的肝脏脂质聚积是"二次打击"学说的第一步. 线粒体脂肪酸氧化引起的氧化应激, NF-κB-依赖的炎症细胞因子表达和脂肪细胞因子是所有的被认为是导致第二次打击产生肝细胞损伤、炎症和纤维化的潜在因素[13-16].
L-FABP是一种与遗传有关的脂肪酸连接蛋白家族成员, 大量存在于胞质中. 在许多代谢有关的疏水基团转运过程中起到重要作用, 包括多不饱和脂肪酸、饱和脂肪酸、胆固醇和胆汁酸, 还可以结合脂溶性肝细胞毒性物质[17]. 基因控制小鼠表明L-FABP-/-小鼠体内长链脂肪酸(long-chain fatty acids, LCFA)的吸收、氧化和酯化水平都有所降低[18-20]. PPAR-α结合L-FABP基因启动子区是其体内表达调控所必要的, 却不是足够的条件[21].
近来L-FABP通过增加PPAR-α活性或者表达水平来影响LCFA代谢的可能性引起重视[22-26]. PPAR作为核受体超家族的一员, 其作用广泛, 他涉及脂质和脂蛋白代谢、葡萄糖代谢、细胞增殖分裂和凋亡. PPAR-α在肝中高表达, 通过诱导线粒体和过氧化物酶体氧化水平及L-FABP基因表达来刺激脂肪酸分解代谢, 保护肝脏免受脂肪变性[27]. ApoA-Ⅳ是人类肝脏中新发现的高度敏感性的PPAR-α调节基因, 可能是PPAR-α激动剂引导TG降低和HDL上升的机制之一[28]. L-FABP与PPAR-α有着相似的配给结合特性, 体内体外的一系列实验[22,23]证明L-FABP很有可能作为脂肪酸和降脂类药物等PPAR-α激动剂进入核的通道. Hostetler等[29]首次发现葡萄糖可以直接结合PPAR-α, 改变构象. 数据表明PPAR-α通过脂类和葡萄糖的浓度调节能量平衡, PPAR-α介导的糖类和葡萄糖损伤不只是间接地通过增加长链脂肪酸的水平而且还可以通过葡萄糖直接作用于PPAR-α来调节.
本实验观察脂肪肝形成及恢复过程中的病理变化, 同时检测L-FABP与PPAR-α mRNA在不同时期的动态表达. 病理切片在第4周时有轻微脂肪变性, 血清中ALT、TG、CHOL和LDL-C在脂肪肝形成过程中均有不同程度的升高直至饮食结构改变, 各指标才有所下降. HDL-C造模过程中显著下降直至饮食结构改变才有所上升. 血清指标显著性改变伴随甚至早于病理学明显改变, 说明血清指标变化可以作为脂肪肝发生的一个重要参考. L-FABP和PPAR-α mRNA的表达与脂肪变性程度有关, 伴随脂肪变性的严重程度L-FABP mRNA首先表现为适应性升高, 升高至一定程度停止升高, 而脂肪变性则继续加重. 如果可以刺激L-FABP继续高表达, 使脂肪酸流动通畅, 可能在一定程度上减轻脂肪肝程度, 或者延迟脂肪肝的发生. PPAR-α mRNA伴随脂肪变性的严重程度一直降低直至饮食结构改变. 通过药物诱导PPAR-α表达, 调节脂肪酸代谢相关基因的表达, 改善IR, 减缓脂肪变性, 可以作为治疗脂肪变性的一个途径. L-FABP介导配基进入细胞核激活PPAR-α转录进而增加脂类物质燃烧, 影响脂类和葡萄糖的代谢和储存[23], 但本实验高脂饮食过程中L-FABP mRNA的升高与PPAR-α mRNA的降低似乎是矛盾的. PPAR-α配基的载体可能不止L-FABP一种, PPAR-α的表达调控也没有揭示清楚. 脂肪变性机制将为患者早期发现和治疗靶位提供帮助, 且合理饮食可以有效改善肝脏脂肪变性程度.
在我国, 近年来非脂肪肝发病率成逐年上升趋势, 并且通常伴随并发症发生. 其发病机制得到广泛研究, 脂肪酸转运机制越来越受到重视.
陈其奎, 教授, 中山大学附属第二医院消化内科.
脂类在肝脏、血液和脂肪组织的储存、降解平衡调控机制成为研究热点与重点.
Schroeder等提出L-FABP介导支链脂肪酸至PPAR-α, 从而调控基因转录. Landrier等发现他汀类药物诱导L-FABP表达实验表明其表达水平上调机制中有PPAR-α参与, 甚至PPAR-α可能是他汀类药物的靶基因.
本文动态监测了高脂饮食导致脂肪肝形成过程中L-FABP和PPAR-α mRNA的表达变化, 生理水平上揭示了其在脂类代谢中表达变化的相关性.
本研究提示脂类代谢网络中可能存在调控关键点, 为药物治疗提供靶点. 且单纯性脂肪肝病可以通过饮食和体育锻炼逐渐好转.
本文具有一定的探索价值, 对非酒精性脂肪肝发病机制提供了一些有价值的信息.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Rajaraman G, Roberts MS, Hung D, Wang GQ, Burczynski FJ. Membrane binding proteins are the major determinants for the hepatocellular transmembrane flux of long-chain fatty acids bound to albumin. Pharm Res. 2005;22:1793-1804. [PubMed] [DOI] |
| 2. | Hung DY, Burczynski FJ, Chang P, Lewis A, Masci PP, Siebert GA, Anissimov YG, Roberts MS. Fatty acid binding protein is a major determinant of hepatic pharmacokinetics of palmitate and its metabolites. Am J Physiol Gastrointest Liver Physiol. 2003;284:G423-G433. [PubMed] [DOI] |
| 3. | Hung DY, Siebert GA, Chang P, Burczynski FJ, Roberts MS. Reduced hepatic extraction of palmitate in steatosis correlated to lower level of liver fatty acid binding protein. Am J Physiol Gastrointest Liver Physiol. 2005;288:G93-G100. [PubMed] [DOI] |
| 6. | 石 巧娟, 刘 月环, 楼 琦, 卢 领群, 周 莎桑, 柯 贤福, 萨 晓婴. 非酒精性脂肪肝大鼠PPAR-α基因表达及脂代谢和胰岛素水平的变化. 中国比较医学杂志. 2009;19:26-31. |
| 7. | Kersten S, Desvergne B, Wahli W. Roles of PPARs in health and disease. Nature. 2000;405:421-424. [PubMed] [DOI] |
| 8. | Hoekstra M, Kruijt JK, Van Eck M, Van Berkel TJ. Specific gene expression of ATP-binding cassette transporters and nuclear hormone receptors in rat liver parenchymal, endothelial, and Kupffer cells. J Biol Chem. 2003;278:25448-25453. [PubMed] [DOI] |
| 9. | Duvnjak M, Lerotić I, Barsić N, Tomasić V, Virović Jukić L, Velagić V. Pathogenesis and management issues for non-alcoholic fatty liver disease. World J Gastroenterol. 2007;13:4539-4550. [PubMed] [DOI] |
| 10. | Bayard M, Holt J, Boroughs E. Nonalcoholic fatty liver disease. Am Fam Physician. 2006;73:1961-1968. [PubMed] |
| 11. | Abdelmalek MF, Diehl AM. Nonalcoholic fatty liver disease as a complication of insulin resistance. Med Clin North Am. 2007;91:1125-1149, ix. [PubMed] [DOI] |
| 12. | Charlton M. Nonalcoholic fatty liver disease: a review of current understanding and future impact. Clin Gastroenterol Hepatol. 2004;2:1048-1058. [PubMed] [DOI] |
| 13. | 田 培营, 王 炳芳. 非酒精性脂肪肝研究进展. 同济大学学报(医学版). 2006;27:46-48. |
| 14. | Hanley AJ, Williams K, Festa A, Wagenknecht LE, D'Agostino RB, Haffner SM. Liver markers and development of the metabolic syndrome: the insulin resistance atherosclerosis study. Diabetes. 2005;54:3140-3147. [PubMed] [DOI] |
| 15. | Marchesini G, Bugianesi E, Forlani G, Cerrelli F, Lenzi M, Manini R, Natale S, Vanni E, Villanova N, Melchionda N. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology. 2003;37:917-923. [PubMed] [DOI] |
| 17. | Chuang S, Velkov T, Horne J, Porter CJ, Scanlon MJ. Characterization of the drug binding specificity of rat liver fatty acid binding protein. J Med Chem. 2008;51:3755-3764. [PubMed] [DOI] |
| 18. | Binas B, Erol E. FABPs as determinants of myocellular and hepatic fuel metabolism. Mol Cell Biochem. 2007;299:75-84. [PubMed] [DOI] |
| 19. | Newberry EP, Kennedy SM, Xie Y, Sternard BT, Luo J, Davidson NO. Diet-induced obesity and hepatic steatosis in L-Fabp / mice is abrogated with SF, but not PUFA, feeding and attenuated after cholesterol supplementation. Am J Physiol Gastrointest Liver Physiol. 2008;294:G307-G314. [PubMed] [DOI] |
| 20. | Newberry EP, Xie Y, Kennedy S, Han X, Buhman KK, Luo J, Gross RW, Davidson NO. Decreased hepatic triglyceride accumulation and altered fatty acid uptake in mice with deletion of the liver fatty acid-binding protein gene. J Biol Chem. 2003;278:51664-51672. [PubMed] [DOI] |
| 21. | Fujishiro K, Fukui Y, Sato O, Kawabe K, Seto K, Motojima K. Analysis of tissue-specific and PPARalpha-dependent induction of FABP gene expression in the mouse liver by an in vivo DNA electroporation method. Mol Cell Biochem. 2002;239:165-172. [PubMed] [DOI] |
| 22. | Wolfrum C, Borrmann CM, Borchers T, Spener F. Fatty acids and hypolipidemic drugs regulate peroxisome proliferator-activated receptors alpha - and gamma-mediated gene expression via liver fatty acid binding protein: a signaling path to the nucleus. Proc Natl Acad Sci U S A. 2001;98:2323-2328. [PubMed] [DOI] |
| 23. | Schroeder F, Petrescu AD, Huang H, Atshaves BP, McIntosh AL, Martin GG, Hostetler HA, Vespa A, Landrock D, Landrock KK. Role of fatty acid binding proteins and long chain fatty acids in modulating nuclear receptors and gene transcription. Lipids. 2008;43:1-17. [PubMed] [DOI] |
| 24. | Huang H, Starodub O, McIntosh A, Kier AB, Schroeder F. Liver fatty acid-binding protein targets fatty acids to the nucleus. Real time confocal and multiphoton fluorescence imaging in living cells. J Biol Chem. 2002;277:29139-29151. [PubMed] [DOI] |
| 25. | Erol E, Kumar LS, Cline GW, Shulman GI, Kelly DP, Binas B. Liver fatty acid binding protein is required for high rates of hepatic fatty acid oxidation but not for the action of PPARalpha in fasting mice. FASEB J. 2004;18:347-349. [PubMed] |
| 26. | Landrier JF, Thomas C, Grober J, Duez H, Percevault F, Souidi M, Linard C, Staels B, Besnard P. Statin induction of liver fatty acid-binding protein (L-FABP) gene expression is peroxisome proliferator-activated receptor-alpha-dependent. J Biol Chem. 2004;279:45512-45518. [PubMed] [DOI] |
| 27. | Tanaka T, Masuzaki H, Nakao K. [Role of PPARs in the pathophysiology of nonalcoholoic fatty liver disease]. Nihon Rinsho. 2005;63:700-706. [PubMed] |
| 28. | Nagasawa M, Akasaka Y, Ide T, Hara T, Kobayashi N, Utsumi M, Murakami K. Highly sensitive upregulation of apolipoprotein A-IV by peroxisome proliferator-activated receptor alpha (PPARalpha) agonist in human hepatoma cells. Biochem Pharmacol. 2007;74:1738-1746. [PubMed] [DOI] |
| 29. | Hostetler HA, Huang H, Kier AB, Schroeder F. Glucose directly links to lipid metabolism through high affinity interaction with peroxisome proliferator-activated receptor alpha. J Biol Chem. 2008;283:2246-2254. [PubMed] [DOI] |