修回日期: 2010-04-23
接受日期: 2010-04-27
在线出版日期: 2010-05-18
目的: 研究在糖尿病进程中突触后致密蛋白95(PSD95), 突触蛋白-Ⅰ(Synapsin-Ⅰ)及其磷酸化状态P-Synapsin-Ⅰ在胃窦的表达变化和作用, 探讨肠神经系统(ENS)的可塑性.
方法: 将SD♂大鼠随机分为糖尿病组(n = 32)和对照组(n = 15). 应用Real-time PCR、Western blot方法检测胃窦组织中PSD95, Synapsin-Ⅰ, P-Synapsin-Ⅰ在糖尿病进程2, 4, 8, 12 wk时表达的变化.
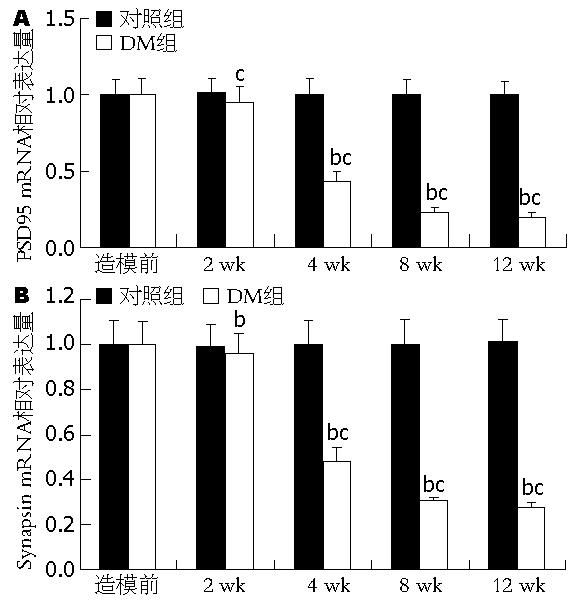
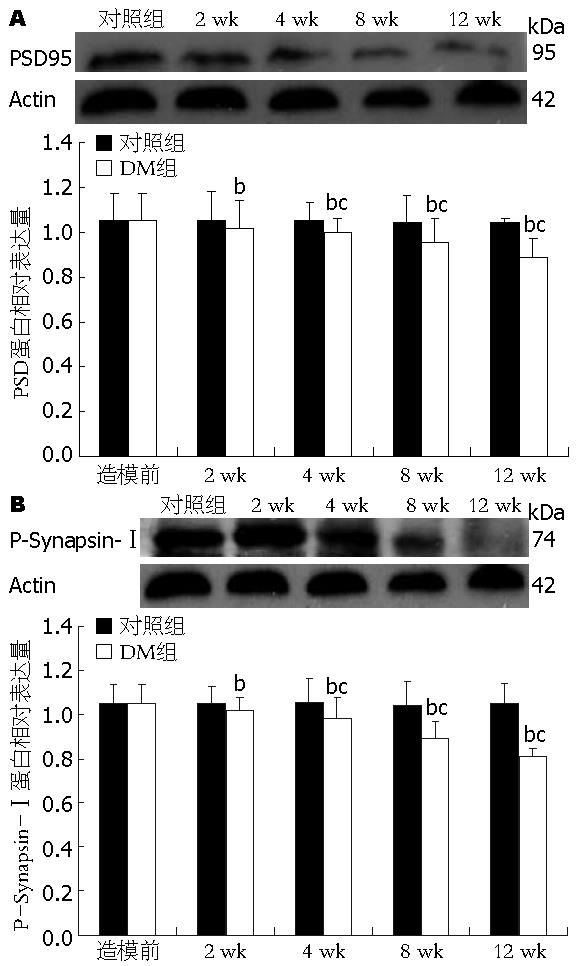
结果: 从4 wk开始糖尿病大鼠组的PSD95, Synapsin-Ⅰ mRNA表达相比同期对照组显著下降(t = 2.92, 3.15, 4.21; t = 3.01, 3.74, 4.53, 均P<0.01); 且随着病程进展逐渐降低(P<0.05). 从4 wk开始糖尿病大鼠组的PSD95和P-Synapsin-Ⅰ蛋白表达比同期对照组均显著下降(t = 2.87, 2.95, 3.37; t = 2.97, 3.11, 3.23, 均P<0.01); 且随着病程进展逐渐降低(P<0.05).
结论: 在糖尿病的进程中, 胃窦PSD95, Synapsin-Ⅰ和P-Synapsin-Ⅰ的表达降低可能与糖尿病胃轻瘫的发生有关, 为胃轻瘫的治疗提供了新的前景.
引文著录: 田爱霞, 钱伟, 刘诗. 糖尿病胃轻瘫大鼠胃窦PSD95和Synapsin-Ⅰ的表达和意义. 世界华人消化杂志 2010; 18(14): 1417-1421
Revised: April 23, 2010
Accepted: April 27, 2010
Published online: May 18, 2010
AIM: To investigate the expression of postsynaptic density-95 (PSD95) and synapsin I in the gastric antrum of rats with diabetic gastroparesis and to explore the plasticity of the enteric nervous system (ENS).
METHODS: Forty-seven Sprague-Dawley rats were randomly divided into two groups: diabetic group (n = 32) and control group (n = 15). Diabetes was induced by intraperitoneal injection of streptozotocin. The mRNA and protein expression of PSD95, synapsin-I and P-Synapsin-I in the gastric antrum of rats at weeks 2, 4, 8 and 12 wk after diabetes induction was detected by real-time PCR and Western blot, respectively.
RESULTS: In the diabetic group, the mRNA and protein expression levels of PSD95 and synapsin-I at all time points after week 4 were significantly lower than those in the control group (mRNA: t = 2.92, 3.15, 4.21; t = 3.01, 3.74, 4.53; Protein: t = 2.87, 2.95, 3.37; t = 2.97, 3.11, 3.23, all P < 0.01). As the disease progressed, the mRNA and protein expression levels of PSD95 and synapsin-I decreased gradually (both P < 0.05). No significant differences were detected in the mRNA and protein expression levels of PSD95 and synapsin-I among different time points in the control group (all P > 0.05).
CONCLUSION: The expression of PSD95 and synapsin-I decreases with the progression of diabetes, which may contribute to the development of diabetic gastroparesis.
- Citation: Tian AX, Qian W, Liu S. Significance of PSD95 and synapsin-I expression in the gastric antrum of rats with diabetic gastroparesis. Shijie Huaren Xiaohua Zazhi 2010; 18(14): 1417-1421
- URL: https://www.wjgnet.com/1009-3079/full/v18/i14/1417.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i14.1417
糖尿病已成为一种常见病, 其发病率呈上升趋势, 而糖尿病胃轻瘫(diabetic gastroparesis, DGP)[1]的发生严重影响了广大糖尿病患者的生活质量. DGP是由于胃肠运动功能障碍所致胃排空受损, 其发病涉及到多方面, 其中胃肠道肠神经系统(enteric nervous system, ENS)病变[2,3], 其突触传递功能严重减退在DGP胃肠功能障碍中起着关键作用. 本课题对于ENS突触的研究选取了两种与突触可塑性紧密相关的突触相关蛋白. 一种为突触后致密蛋白95(postsynaptic density protein 95, PSD95), 是突触后致密区内含量最多的蛋白之一, 影响着突触结构和功能的重塑[4,5]. 另一种突触蛋白Ⅰ(Synapsin-Ⅰ)是突触蛋白中的主要蛋白之一, 通过磷酸化(P-Synapsin-Ⅰ)和非磷酸化作用来调节神经递质的释放, 并对神经元的发育和再生起着重要的作用[6]. 本文通过研究糖尿病病程中胃窦组织中PSD95和Synapsin-Ⅰ及其磷酸化状态P-Synapsin-Ⅰ的表达变化和作用, 来探讨糖尿病病程中ENS突触的可塑性, 从而寻求治疗DGP神经病变的可行办法.
♂SD大鼠47只, 体质量200-250 g, SPF级, 购自华中科技大学同济医学院动物中心; 链脲佐菌素(STZ)购自美国Alexis公司; 鼠尾血糖用美国强生的One Touch Ultratm测量; 兔PSD95抗体(PSD95, AB9708)购自Chemicon公司; 兔P-Synapsin-Ⅰ抗体(P-Synapsin-Ⅰ, ab47767-100)购自Abcam公司; 小鼠β-actin抗体购自武汉博士德公司; 羊抗兔二抗, 羊抗小鼠二抗购自Invitrogen公司.
1.2.1 动物分组及模型建立: 随机分为糖尿病组(n = 32)和对照组(n = 15). 糖尿病组禁食12 h后, 按55 mg/kg的剂量腹腔注射1% STZ诱导1型糖尿病(DM), 制备的模型具有糖尿病典型三多一少症状, 可用于糖尿病慢性并发症的研究[7]. 3 d后若连续2次鼠尾非禁食血糖值>13.87 mmol/L, 可视为糖尿病(DM)模型建立成功[8]. Song等研究认为糖尿病造模4, 8, 12 wk组大鼠可作为DGP模型进行研究[9]. 随后继续监测血糖, 在造模后第2、4、8及12周分别颈椎脱臼处死糖尿病组大鼠8只, 留取大鼠胃窦标本. 对照组大鼠给予柠檬酸-柠檬酸钠缓冲液1.5 mL腹腔注射, 分别与同期糖尿病大鼠一起处死, 每期各3只, 留取标本.
1.2.2 PSD95和Synapsin-Ⅰ mRNA转录水平检测: 采用Real-time PCR技术进行检测. (1)从GenBank中查出大鼠PSD95, Synapsin-Ⅰ, GAPDH的mRNA全长序列, 应用引物设计软件Primer5.0, Blast设计相对应的专一性引物, 由Invitrogen公司合成. PSD95上游引物: 5'-CAAAGACCGTGCCAACGAT-3', 下游引物: 5'-GGGACACAGGAT CCAAACTTGT-3', Synapsin-Ⅰ上游引物: 5'-TTCAGCATGGCACGTAATGG-3', 下游引物5'-CCAGCATACTGCAGCCCAAT-3'. 以GAPDH为内参, 上游引物: 5'-CCACATCGCTCAGACACCAT-3', 下游引物: 5'-GACCAGGCGCCCAAT-3'. (2)总RNA提取: 每100 mg胃组织标本中加入500 µL TRIzolTM(Invitrogen, USA)匀浆; 匀浆液4 ℃、12 000 g离心10 min; 取上清, 加200 µL氯仿, 混匀后室温静置10 min, 12 000 g离心10 min; 取上清, 加500 µL异丙醇, 混匀后-20 ℃静置30 min, 12 000 g离心10 min; 弃上清, 加750 mL/L乙醇1 mL混匀洗涤后, 8 000 g离心10 min; 弃上清、干燥后提取出组织总RNA. (3)逆转录聚合酶链式反应(RT-PCR): 先在EP管中加入DEPC水5.5 µL, DEPC水溶解的RNA 6 µL, 50 mg/L的Oligo(dT)1 µL, 置入PCR仪(PTC-150 MiniCyclerTM, MJ Research, USA)70 ℃反应5min后, 取出置冰浴中再加入20 U/µL RNsin 0.5 µL, 10 mmol/L的dNTP 2 µL, 5×逆转录缓冲液4 µL, 200 U/mL逆转录酶1 µL, 再次置入PCR仪, 37 ℃ 60 min、95 ℃ 5 min后合成cDNA, 置于-20 ℃保存. (4)荧光定量PCR反应在Step One Real-time PCR system(AB Applied Biosystems)中进行, 反应体系中20 µL包括Fast SYBR Green PCR Master Mix(Applied Biosystems)10 µL, cDNA 2 µL, 相应的10 pmol/L的上、下游引物(Invitrogen, USA)各3 µL及ddH2O 2 µL. 反应条件: 95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 1 min, 40个循环. (5)结果分析: 在控制一定的试验条件[10], 保证扩增效率一致的条件下, 记录系统所得CT值, 分别以糖尿病造模前大鼠各指标mRNA表达为参照[11,12], 设定其-ΔΔCT值为0, 从而计算出各组PSD95和Synapsin-Ⅰ mRNA相对表达量2-ΔΔCT.
1.2.3 PSD95和P-Synapsin-Ⅰ蛋白表达检测: 胃组织Western blot实验步骤: (1)每100 mg胃组织标本中加入392 µL单去污裂解液、4 µL PMSF, 4 µL Aprotin及4 µL复合磷酸酶抑制剂进行匀浆, 4 ℃、12 000 g离心10 min后, 分光光度计检测上清中蛋白浓度. (2)上清加入上样缓冲液后99 ℃ 10 min变性, 置于-70 ℃保存. (3)制作10% SDS-PAGE, 按100 µg/孔蛋白加样, 100 V电泳2.5 h分离蛋白后, 200 mA 60-70 min将分离的蛋白转印至硝酸纤维素膜(NC膜)上. (4)NC膜用含0.1% Tween 20的TBS液溶解的5% BSA室温封闭1 h, 分别加入兔PSD95(1:300) 抗体和兔P-Synapsin抗体(1:200)4 ℃孵育过夜, 以小鼠β-actin抗体(1:400)作为内参. (5)用含0.1% Tween 20的TBS溶液洗膜10 min×3次, 加入相应二抗室温孵育1 h. (6)洗膜10 min×3次, ECL(PIERCE, USA)显色、曝光. Qunantity-One图像分析软件分析条带A值, 目的蛋白A值/Actin A值为该蛋白的相对表达强度.
统计学处理 数据以mean±SD表示, 应用SPSS13.0软件进行方差齐性检验和单因素方差分析(ANOVA)比较各组间差异. 以P<0.05为差异有统计学意义.
糖尿病病程中对照组各期大鼠的PSD95和Synapsin-Ⅰ mRNA表达无显著变化. 糖尿病组中2 wk组PSD95 mRNA表达与造模前正常大鼠无明显差异, 从4 wk组开始糖尿病组大鼠PSD95 mRNA表达均较同期对照组大鼠显著下降(P<0.01, t = 2.92, 3.15, 4.21), 且随着病程进展, 表达呈明显下降趋势(P<0.05, F = 2.79)(图1A). 同样, 2 wk组大鼠Synapsin-Ⅰ mRNA与造模前没有明显差异, 从4 wk组开始糖尿病大鼠Synapsin-Ⅰ mRNA表达逐渐下降(P<0.05, F = 3.13), 与同期对照组大鼠相比糖尿病大鼠Synapsin-Ⅰ mRNA表达显著减少(P<0.01, t = 3.01, 3.74, 4.53)(图1B).
糖尿病组中2 wk组PSD95蛋白表达均与造模前正常大鼠无明显差异, 从4 wk组开始糖尿病组大鼠PSD95蛋白表达相比同期对照组大鼠显著减少(P<0.01, t = 2.87, 2.95, 3.37), 且随着病程进展, 表达呈明显下降趋势(P<0.05, F = 3.41)(图2A). 同样, 2 wk组大鼠P-Synapsin-Ⅰ蛋白表达与造模前没有明显差异, 从4 wk组开始糖尿病大鼠P-Synapsin-Ⅰ蛋白表达逐渐下降(P<0.05, F = 3.27), 与同期对照组大鼠相比糖尿病大鼠P-Synapsin-Ⅰ蛋白表达显著减少(F<0.01, t = 2.97, 3.11, 3.23)(图2B). 糖尿病病程中对照组之间, 各期大鼠的PSD95和P-Synapsin-Ⅰ蛋白表达无显著变化.
相关研究显示, 1型糖尿病超过50%而2型糖尿病约30%的患者存在胃排空障碍[13,14], 但是目前DGP的治疗方法并不理想, 有待于进一步深入研究. 考虑到糖尿病胃排空障碍的主要发病机制之一是ENS发生病变[2], 神经细胞之间, 神经细胞与平滑肌细胞间神经递质及电信号传递障碍造成的胃肠动力紊乱. 既往的研究[15]认为脑神经和外周神经具有神经突触可塑性, 即突触[16]在一定条件下调整功能, 改变形态和增减数目的能力, 在结构和功能上有自身修复的能力. 那么ENS突触是否同样具有可塑性? 需要我们进一步研究, 探索ENS突触形态功能的可塑性, 探讨糖尿病DGP和ENS突触可塑性的关系, 进而寻求致ENS突触重塑的治疗方法.
在既往对糖尿病DGP造模的研究中, 腹腔注射1% STZ破坏胰腺β细胞诱1型糖尿病的造模方法已被广泛认可, 制备的模型具有糖尿病典型三多一少症状, 且具有稳定不可逆性, 适合用于糖尿病慢性并发症的研究. Ordög等的研究认为糖尿病大鼠饲养过程中, 具备下列两种情况之一者视为糖尿病DGP模型: (1)大鼠大便量和性状与对照组有持续性的明显差别; (2)胃肠推进指标检测和正常对照组有显著差异[17,18]. Song等研究认为糖尿病小鼠病程4-5 wk后胃排空显著延迟, 故糖尿病大鼠造模4, 8, 12 wk组可视为DGP模型组[9]. 刘劲松等[8]研究也证实, STZ给药6 wk后糖尿病大鼠肌间神经丛基本无nNOS染色阳性神经, 已经存在神经病变, 可作为DGP模型进行研究. 因此, 本研究采取STZ造模的方法作为DGP模型来研究ENS突触可塑性机制具有一定的代表性. 又因为胃组织胃窦的肠神经从比较丰富, 选取了糖尿病DGP大鼠胃窦组织进行比较研究.
本课题选取了PSD95和Synapsin-Ⅰ两个在突触可塑性研究方面具有重要意义的突触相关蛋白进行研究. Synapsin-Ⅰ是与突触囊泡相关的特异性磷酸蛋白, 主要是通过磷酸化和去磷酸化作用调节神经递质的释放[19], 因此检测Synapsin-Ⅰ的磷酸化水平可以间接反映突触的神经递质传递功能. 既往的研究[20,21]多局限于脑缺血再灌注, 长时程增强, 抑郁症等神经分化的领域. 糖尿病其他并发症如糖尿病视网膜病变、糖尿病脑病也有相关的研究, 其重要性获得广泛肯定, 但是尚未见Synapsin-Ⅰ在糖尿病DGP、ENS方面的相关报道. 本研究发现糖尿病DGP大鼠胃窦组织中P-Synapsin-Ⅰ的表达量下降, 且随着疾病进展逐渐减少. 提示了在糖尿病进程中ENS突触发生了可塑性变化, 从而导致了胃动力的减弱, 且Synapsin-Ⅰ在糖尿病DGP ENS病变发生过程中起着重要的作用, ENS突触结构和功能的减退与Synapsin-Ⅰ的表达减少密切相关.
PSD是神经细胞质膜下的细胞骨架网, Ziff等研究报道其位于神经递质引发的突触区离子流及第二信使级联反应的关口途径, 介导着突触后信号分子, 调节分子和靶分子之间的相互作用[22]. PSD形态结构[23]具有很大的可塑性或易变性, 在突触后的结构发育及功能活动依赖性的可塑性中都有重要意义. 其中PSD95作为重要的骨架蛋白是突触敏感的结构和形态学指标[24]. 电镜免疫组织化学技术显示PSD-95紧靠突触后膜, 离突触后膜平均距离仅12 mm, 因此更易于与突触后膜各种蛋白分子相互作用, 起着影响神经递质传递的关键作用[25]. 既往的研究报道,在创伤性脑损伤[26], 老年痴呆等疾病的预后转归中, PSD95通过影响突触结构和功能的重塑发挥着重要的作用[4]. 本研究显示了PSD95在糖尿病DGP大鼠胃窦组织的表达量减少, 提示其不仅主导着中枢神经系统中突触功能的维持, 而且在外周神经系统, ENS突触病变所致胃肠功能减弱中同样发挥着重要作用.
本研究还显示糖尿病大鼠早期2 wk组时Synapsin-Ⅰ和PSD95表达上与正常大鼠没有明显区别, 从第4周开始无论是基因表达还是蛋白表达均显著降低, 并随着病程进展有明显下降趋势. 这与本课题组之前在形态学电镜方面的研究报道, 糖尿病大鼠第4周开始, 胃内ENS出现明显形态学改变相一致.
杨小军等[27]曾研究报道, 慢性感染大鼠模型中, 突触可塑性变化与肠道的内脏高敏感性, 肠道动力增强有关. 而本研究也发现Synapsin-Ⅰ和PSD95在糖尿病DGP大鼠胃窦组织中的表达量减少, 在糖尿病的发病机制中起着重要的作用, 糖尿病DGP与ENS突触可塑性变化密切相关. 由此推测ENS也具有突触功能形态可塑性. 然而这种可塑性改变是否能作为治疗靶点, 从中期待通过某些治疗方法促进胃窦组织中Synapsin-Ⅰ和PSD95恢复表达, ENS突触的形态和功能能得到相应改善, 实现对ENS突触的重塑还需进一步研究. 寻找能上调ENS中Synapsin-Ⅰ和PSD95表达的药物[28]或者其他治疗方法, 如胃电刺激[29,30], 电针治疗[31,32]等, 将成为糖尿病DGP治疗的前景.
糖尿病胃轻瘫(DGP)严重影响糖尿病患者生活质量, 常依赖于促胃肠动力药的使用, 但是长期使用会失效, 临床上欠缺良好的治疗办法. DGP主要发病机制是由于代谢原因导致肠神经系统发生神经突触病变, 引起胃排空障碍, 故研究糖尿病模型病程中肠神经系统的突触可塑性, 探讨突触重塑的可能, 从而为治疗DGP提供可行办法.
高国全, 教授, 中山大学中山医学院生化系
目前研究表明, PSD95是突触敏感的结构和形态学指标, 其形态结构具有很大的可塑性或易变性. 在中枢神经系统疾病的预后转归中, PSD95通过影响突触结构和功能的重塑而发挥重要的作用. Synapsin-Ⅰ是与突触囊泡相关的特异性磷酸蛋白, 其磷酸化水平可以间接反映突触的神经递质传递功能, 在脑神经和糖尿病某些并发症的研究中, Synapsin-Ⅰ的重要性获得了关肯定. 两种蛋白与肠神经系统突触可塑性的关系还有待深入探讨.
目前关于突触可塑性研究多局限于中枢神经系统, 而本文选取了相应的指标PSD95和Synapsin-Ⅰ, 运用定量的方法取代形态学观察研究, 更客观地从功能和形态方面探讨了肠神经系统的神经突触可塑性.
本研究提示DGP胃排空障碍与肠神经系统突触功能障碍相关, 肯定了两种突触相关蛋白PSD95和P-Synapsin-Ⅰ在DGP病理机制中的重要性, 为今后的治疗研究提供了观察指标, 从而进一步探讨ENS的突触重塑可能性.
突触可塑性: 神经系统内进行信息传递的结构基础-突触在其结构以及功能方面的可变性被称为突触可塑性. 突触可塑性与神经系统的发育、损伤后的修复以及学习记忆等重要脑功能的完成密切相关. 在各种生理和病理因素作用下, 突触的结构、数量和功能可发生变化从而影响信号强度.
本文具有较好的创新性, 数据充分, 具有较好的参考价值.
编辑: 李军亮 电编: 何基才
| 4. | 李 小黎, 田 金洲, 盛 树力, 赵 志炜, 徐 意, 姬 志娟. 复方金思维对阿尔茨海默病大鼠脑组织突触后致密区蛋白95表达的影响与安慰剂及盐酸多奈哌齐干预效果的比较. 中国临床康复. 2005;9:139-141. |
| 9. | Song GQ, Chen JD. Synchronized gastric electrical stimulation improves delayed gastric emptying in nonobese mice with diabetic gastroparesis. J Appl Physiol (1985). 2007;103:1560-1564. [PubMed] [DOI] |
| 11. | Bensaid M, Melko M, Bechara EG, Davidovic L, Berretta A, Catania MV, Gecz J, Lalli E, Bardoni B. FRAXE-associated mental retardation protein (FMR2) is an RNA-binding protein with high affinity for G-quartet RNA forming structure. Nucleic Acids Res. 2009;37:1269-1279. [PubMed] [DOI] |
| 12. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 13. | Horowitz M, O'Donovan D, Jones KL, Feinle C, Rayner CK, Samsom M. Gastric emptying in diabetes: clinical significance and treatment. Diabet Med. 2002;19:177-194. [PubMed] [DOI] |
| 14. | Lin Z, Forster J, Sarosiek I, McCallum RW. Treatment of diabetic gastroparesis by high-frequency gastric electrical stimulation. Diabetes Care. 2004;27:1071-1076. [PubMed] [DOI] |
| 15. | Singer W. Development and plasticity of cortical processing architectures. Science. 1995;270:758-764. [PubMed] [DOI] |
| 18. | Ordög T, Takayama I, Cheung WK, Ward SM, Sanders KM. Remodeling of networks of interstitial cells of Cajal in a murine model of diabetic gastroparesis. Diabetes. 2000;49:1731-1739. [PubMed] [DOI] |
| 20. | Ferreira A, Rapoport M. The synapsins: beyond the regulation of neurotransmitter release. Cell Mol Life Sci. 2002;59:589-595. [PubMed] [DOI] |
| 21. | Kao HT, Song HJ, Porton B, Ming GL, Hoh J, Abraham M, Czernik AJ, Pieribone VA, Poo MM, Greengard P. A protein kinase A-dependent molecular switch in synapsins regulates neurite outgrowth. Nat Neurosci. 2002;5:431-437. [PubMed] [DOI] |
| 25. | Petersen JD, Chen X, Vinade L, Dosemeci A, Lisman JE, Reese TS. Distribution of postsynaptic density (PSD)-95 and Ca2+/calmodulin-dependent protein kinase II at the PSD. J Neurosci. 2003;23:11270-11278. [PubMed] |
| 26. | 费 舟, 章 翔. 弥漫性脑损伤与突触后密度蛋白. 国际神经病学神经外科学杂志. 2006;33:350-353. |
| 28. | 黎 彬如. 蛇毒神经生长因子与神经可塑性. 国际神经病学神经外科学杂志. 2006;33:288-291. |
| 29. | Abell TL. Gastric electric stimulation is a viable option in gastroparesis treatment. Nat Clin Pract Gastroenterol Hepatol. 2009;6:E8-13. [PubMed] [DOI] |
| 30. | Maranki J, Parkman HP. Gastric electric stimulation for the treatment of gastroparesis. Curr Gastroenterol Rep. 2007;9:286-294. [PubMed] [DOI] |