修回日期: 2010-04-23
接受日期: 2010-04-27
在线出版日期: 2010-05-08
目的: 探讨以标记CD127low和Foxp3+两种方法检测肝癌(hepatocellular carcinoma, HCC)患者外周血中CD4+CD25hi-intTregs水平的相关性, 建立两者转换的回归方程.
方法: 流式细胞术同时用CD127low和Foxp3+两种标志物检测31例HCC患者外周血中CD4+CD25hi-intTregs, 检测32例对照组CD4+CD25hi-intFoxp3+Tregs水平.
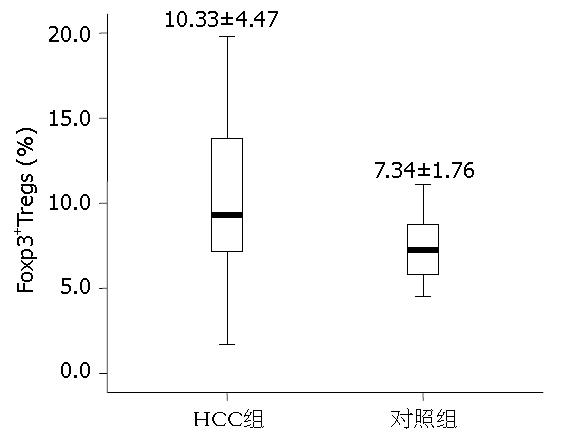
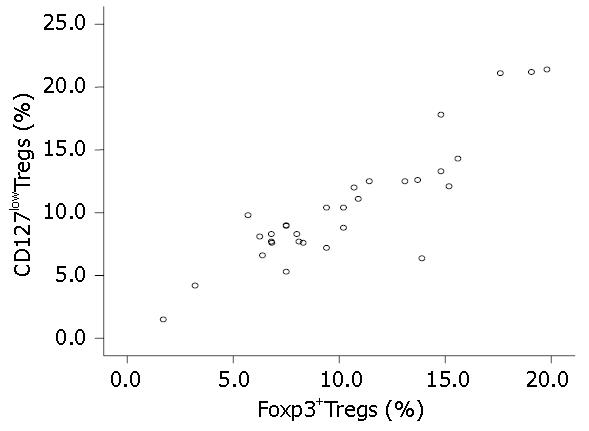
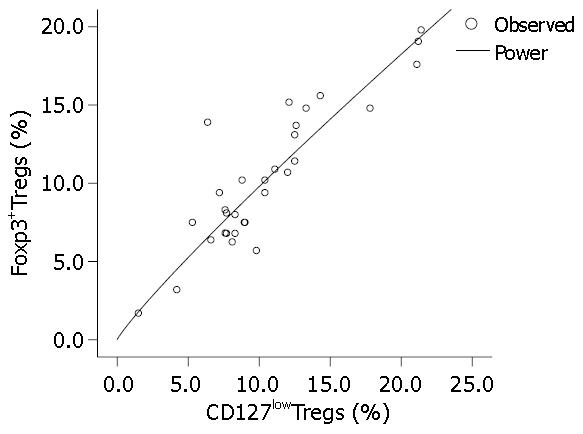
结果: HCC患者与健康对照组外周血中CD4+CD25hi-intFoxp3+Tregs占CD4+ T细胞的比例分别为10.33%±4.47%和7.34%±1.76%,差异有统计学意义(P<0.01). HCC患者外周血中CD4+CD25hi-intCD127lowTregs的比例为10.51%±4.78%, 与Foxp3+Tregs比例呈正相关, Pearson相关系数为0.889,相关有统计学意义(P<0.01). 两者曲线拟合提示幂模型是最优模型, 建立回归方程Y = 1.236×(x0.899)(Y为Foxp3+Tregs, x为CD127lowTregs).
结论: HCC患者外周血中Tregs水平明显升高, 用CD127low和Foxp3+两种方法检测HCC患者外周血Tregs水平呈正相关, 两者之间数值转换可利用回归方程.
引文著录: 王芳, 吕洪敏, 韩涛, 王鹏, 王凤梅, 朱争艳, 向慧玲. 不同方法检测肝癌患者外周血中CD4+CD25hi-intTregs水平的关系及意义. 世界华人消化杂志 2010; 18(13): 1384-1389
Revised: April 23, 2010
Accepted: April 27, 2010
Published online: May 8, 2010
AIM: To explore the correlation between CD127low and Foxp3+ cell labeling-based methods in detecting CD4+CD25hi-int T regulatory cells (Tregs) in peripheral blood of hepatocellular carcinoma (HCC) and to establish a regression equation based on the percentages of CD4+CD25hi-intTregs in total CD4+ T cells obtained with the two methods.
METHODS: The levels of CD4+CD25hi-intTregs were detected by flow cytometry using CD127low and Foxp3+ markers in peripheral blood of 31 HCC patients. The levels of CD4+CD25hi-int Foxp3+Tregs were measured in 32 healthy controls.
RESULTS: The percentage of CD4+CD25hi-int Foxp3+ Tregs in total CD4+ T cells in peripheral blood of HCC patients was significantly higher than that in healthy controls (10.33% ± 4.47% vs 7.34% ± 1.76%, P < 0.01). The percentage of CD4+CD25hi-intCD127lowTregs in peripheral blood of HCC patients (10.51% ± 4.78%) is positively correlated with that of Foxp3+ Tregs (r = 0.889, P < 0.01). Curve fitting showed that power model is the optimal model. According to the power model, the following regression equation was established: Y = 1.236 × (x0.899)(Y and x represent the percentages of Foxp3+Tregs and CD127lowTregs, respectively).
CONCLUSION: Treg level is significantly elevated in peripheral blood of HCC patients. There is a positive correlation between the percentage of CD4+CD25hi-intFoxp3+Tregs and that of CD4+CD25hi-intCD127lowTregs in peripheral blood of HCC patients. The conversion between the percentage of CD4+CD25hi-intFoxp3+Tregs and that of CD4+CD25hi-intCD127lowTregs can be achieved using a regression equation.
- Citation: Wang F, Lv HM, Han T, Wang P, Wang FM, Zhu ZY, Xiang HL. Correlation between two different methods in detecting CD4+CD25hi-int T regulatory cells in peripheral blood of patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1384-1389
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1384.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1384
调节性T细胞(regulatory T cells, Tregs)是一群在维持机体免疫平衡中发挥重要作用的CD4+ T淋巴细胞. 肝脏疾病的发生时常伴随着Tregs的异常改变: 慢性乙型肝炎的进展与Tregs数量增加有关[1], 自身免疫性肝病的发生与Tregs的功能和数量降低相关, 而肝癌的发生也与Tregs密切相关. 此前的研究发现, 循环中Tregs水平在肿瘤和癌症患者是增加的, Tregs参与各种肿瘤包括肝癌的发病机制, 并影响疾病的进展[2]. 近年来, 关于Tregs与肝癌的研究越来越多, 但是在相同的研究对象中得出的结论有所差异, 有的甚至是相反的结论. 导致上述研究结论不同的原因, 很可能是检测Tregs手段的不同所致. Foxp3 (forkhead family transcription factor, forkhead Box p3)被认为是Tregs发育和功能的关键调控基因, 也是Tregs的特异性标记[3]. 不过Foxp3作为人Tregs的特异性标志有一定的局限, 检测结果并不稳定, 而且无法进行后续的细胞培养和进一步的其他检测[4]. CD127是Tregs的表面膜分子的一种, CD127低表达与Foxp3+有高度一致性[5], 故检测CD4+CD25hi-intCD127lowTregs可较好地反映胸腺来源的Tregs的水平, 也有研究[6]认为CD127低表达与Foxp3阳性表达所定义的不是相同的一群细胞. 为探讨两种检测CD4+CD25hi-intTregs方法的相关性, 我们对肝细胞癌(hepatocellular carcinoma, HCC)患者的同一份外周血全血标本同时选用CD127low和Foxp3+两种方法来检测CD4+CD25hi-intTregs占CD4+ T细胞的比例, 并试图建立两者之间的回归方程方便临床应用.
收集2009-07/2009-08我院肝内科住院的HCC患者31例, 其中男25例, 占80.6%, 女6例, 占19.4%, 年龄45-81(平均57.05±10.05)岁. 对照组为健康查体者32例, 其中男23例, 占71.9%, 女9例, 占28.1%, 年龄范围43-69(平均57.47±5.48)岁. 两组年龄及性别比例互相匹配. 对照组肝功能水平、肝病自身抗体、血常规、胸片和腹部B超、心电图、尿常规均无异常. 主要的仪器包括: 流式细胞仪(购自美国Beckman公司), 中佳KDC-1042离心机, CHA-S恒温振荡器. 主要试剂包括: 鼠抗人CD4-FITC抗体、CD25-PECY5抗体、CD127-PE抗体及各自的同型对照购自美国Beckman公司; 鼠抗人Foxp3-PE抗体及其同型对照购自eBioscience公司.
1.2.1 诊断方法: (1)HCC的诊断参照1999年第四届全国肝癌学术会议制定的《原发性肝癌临床诊断标准》[7]. (2)入选条件: 符合上述HCC诊断标准, 且为初次诊断患者, 尚未接受抗肿瘤及免疫调节治疗. 患者基本情况见表1.
| 项目 | n | % |
| 性别 | ||
| 男 | 25 | 80.6 |
| 女 | 6 | 19.4 |
| 病因 | ||
| 慢性乙型肝炎 | 24 | 77.4 |
| 慢性丙型肝炎 | 5 | 16.1 |
| 不明原因 | 2 | 6.5 |
| 常见症状 | ||
| 右上腹不适 | 25 | 80.6 |
| 乏力 | 18 | 58.1 |
| 食欲下降 | 17 | 54.8 |
| AFP值(mg/L) | ||
| ≥400 | 28 | 90.3 |
| <400 | 3 | 9.7 |
| Child-Pugh分级 | ||
| A级 | 21 | 67.7 |
| B级 | 9 | 29 |
| C级 | 1 | 3.2 |
| 有无远处转移 | ||
| 有 | 3 | 9.7 |
| 无 | 28 | 90.3 |
1.2.2 流式细胞仪检测CD4+CD25hi-intFoxp3+Tregs的比例: 取新采集的原发性肝癌患者和健康对照组枸橼酸钠(EDTA)抗凝外周静脉血1 mL. 具体步骤如下: 取流式管2个, 1管为对照管, 1管为检测管. 加入CD4-FITC抗体10 μL, 样品管内加入CD25-PECY5抗体10 μL, 对照管内加入CD25-同型对照PECY5抗体10 μL, 每管内加入新鲜抗凝外周血100 μL, 振荡混匀, 室温避光孵育30 min. 加入溶血素4.5 mL, 振荡混匀, 37 ℃气浴并振荡10 min, 裂解红细胞, 离心机1 600 r/min离心6 min. 弃上清, 可观察到底部白色沉淀. 配制工作浓度破膜剂(原液和稀释液1:3)2 mL, 对照管和样品管分别加入1 mL, 振荡充分混匀后放置于4 ℃冰箱1 h, 破膜. 取出离心, 离心机1 600 r/min离心6 min, 弃上清. 配制破膜缓冲液16 mL, 分别加入对照管和样品管2 mL, 振荡混匀后1 600 r/min离心5 min, 弃上清. 重复上一步骤. 样品管中加入Foxp3-PE抗体5 μL, 对照管内加入Foxp3同型对照-PE抗体5 μL, 4 ℃避光孵育30 min. 各加入2 mL破膜缓冲液, 振荡混匀, 1 600 r/min离心5 min, 弃上清. 重复上一步骤. 加入1%多聚甲醛固定, 流式检测. 流式细胞仪检测, Expo32软件收获细胞并进行分析数据. 结果记录CD4+CD25hi-intFoxp3+Tregs细胞占CD4+ T细胞的百分比.
1.2.3 流式细胞仪检测CD4+CD25hi-intCD127lowTregs的比例: 将采集的原发性肝癌患者枸橼酸钠(EDTA)抗凝外周静脉血同时进行CD4+CD25hi-intCD127lowTregs的检测. 步骤如下: 取流式管2个, 1管为对照管, 1管为检测管. 样品管内加入CD4-FITC抗体、CD25-PECY5抗体、CD127-PE抗体各10 μL, 对照管内加入CD4-FITC抗体、CD25同型对照-PECY5抗体、CD127同型对照-PE抗体各10 μL, 每管内加入新鲜抗凝外周血(EDTA)100 μL, 振荡混匀, 室温避光孵育30 min. 加入溶血素4.5 mL, 振荡混匀, 37 ℃气浴并振荡10 min, 裂解红细胞, 离心机1 600 r/min离心6 min. 弃上清, 可观察到底部白色沉淀. 加入1%多聚甲醛固定, 流式检测. 流式细胞仪检测, Expo32软件收获细胞并进行分析数据. 结果记录CD4+CD25hi-intCD127lowTregs细胞占CD4+ T细胞的百分比.
统计学处理 采用SPSS13.0软件进行统计分析, 计量资料以mean±SD表示, 两组之间对比采用t检验, 相关分析采用Pearson相关检验, 两者之间数量关系采用曲线拟合, P<0.05为有统计学意义.
HCC患者外周血CD4+CD25hi-intFoxp3+Tregs占CD4+T细胞的比例为10.33%±4.47%, 健康对照组CD4+CD25hi-intFoxp3+Tregs占CD4+ T细胞的比例为7.34%±1.76%, 认为两者之间的差异有统计学意义(P<0.05, P = 0.000, 图1).
CD4+CD25hi-intFoxp3+Tregs占CD4+ T细胞的比例为10.33%±4.47%, CD4+CD25hi-intCD127lowTregs占CD4+ T淋巴细胞的比例为10.51%±4.78%, 两者Pearson相关系数为0.889, 两种方法检测Tregs的水平呈正相关(P<0.05, P = 0.000, 图2).
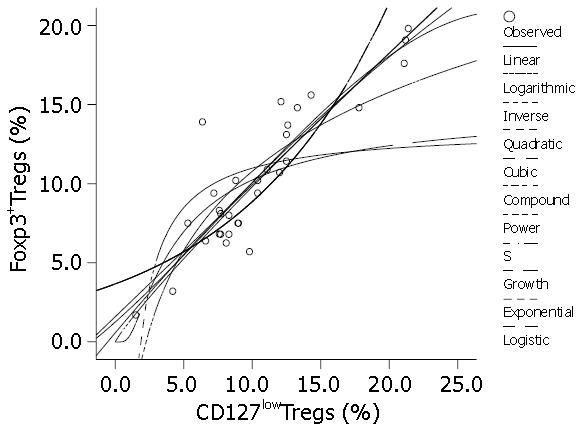
用SPSS软件中的曲线估计过程自动拟合11种模型, 所有模型均有显著性意义(P = 0.000)(表2, 图3), 以Power(幂模型)决定系数R2最高, 为0.810, 故选用幂模型(图4), 回归方程为: Y = 1.236×x0.899(Y为Foxp3+Tregs, x为CD127lowTregs).
| 模型 | 模型主要参数 | 参数估计 | |||||||
| R2 | F | df1 | df2 | P值 | Constant | b1 | b2 | b3 | |
| 线性模型(Linear) | 0.791 | 109.764 | 1 | 29 | 0.000 | 1.590 | 0.832 | ||
| 对数模型(Logarithmic) | 0.697 | 66.573 | 1 | 29 | 0.000 | -5.826 | 7.210 | ||
| 逆模型(Inverse) | 0.369 | 16.941 | 1 | 29 | 0.000 | 13.474 | -24.991 | ||
| 二次模型(Quadratic) | 0.794 | 53.860 | 2 | 28 | 0.000 | 0.571 | 1.027 | -0.008 | |
| 三次(Cubic) | 0.794 | 34.758 | 3 | 27 | 0.000 | 1.253 | 0.771 | 0.018 | -0.001 |
| 复合模型(Compound) | 0.667 | 58.051 | 1 | 29 | 0.000 | 3.663 | 1.092 | ||
| 幂模型(Power) | 0.810 | 123.636 | 1 | 29 | 0.000 | 1.236 | 0.899 | ||
| S型模型(S) | 0.654 | 54.935 | 1 | 29 | 0.000 | 2.710 | -3.848 | ||
| 生长模型(Growth) | 0.667 | 58.051 | 1 | 29 | 0.000 | 1.298 | 0.088 | ||
| 指数模型(Exponential) | 0.667 | 58.051 | 1 | 29 | 0.000 | 3.663 | 0.088 | ||
| logistic模型(Logistic) | 0.667 | 58.051 | 1 | 29 | 0.000 | 0.273 | 0.915 | ||
原发性肝癌在我国较为常见, 缺乏有效的治疗措施, 预后较差. Tregs是具有免疫负调节功能的CD4+ T细胞亚群, 能抑制抗肿瘤效应细胞的活化和增殖, 与肿瘤免疫逃逸有关[8]. Tregs在肿瘤内的聚集会抑制CD8+ T淋巴细胞的功能, 可能对肿瘤进展起促进作用. 我们通过对原发性肝癌和健康对照组外周血CD4+CD25hi-intFoxp3+Tregs占CD4+ T淋巴细胞的比例的研究看出, HCC患者外周血中的CD4+CD25hi-intFoxp3+Tregs比例明显高于健康对照组, 差异有统计学意义. 我们的研究对象是初次诊断的、未经治疗尤其是免疫调节剂治疗的HCC患者, 排除了免疫调节及其他化疗等因素的影响. Fu等[9]观察到肿瘤浸润淋巴细胞中Tregs频率和CD4+ T淋巴细胞频率明显高于癌旁组织及正常组织; 同时肝癌患者外周血Tregs数量明显增加, 而且和疾病进展密切相关; 并发现肝癌患者外周血Tregs频率与其生存期密切相关, 认为Tregs可以作为肝癌患者存活的预测指标. Wo1f等[10]观察到HCC患者外周血Tregs细胞内T细胞受体清除周期的数值明显降低, 在体外扩增没有进一步缩短端粒长度, 可能是由于诱导端粒酶活性, 推测HCC患者外周血Tregs频率增加是由于Tregs增殖而不是Tregs的重分布导致. 这样, 我们通过控制Tregs数量等方式来改变Tregs活性进而控制免疫反应可能作为治疗肝癌的一种新的策略. 但也有一些研究认为原发性肝癌患者外周血中Tregs占总淋巴细胞的比例与健康对照组无差异[11].
目前关于HCC患者外周血中的Tregs水平研究结论不一, 可能是因为检测方法不同. 外周血Tregs数量极少, 仅占CD4+ T细胞的5%-10%, Tregs的检测方法对于进一步有关功能和应用的研究十分重要. 人们早期研究Tregs是通过检测CD4+CD25+, 缺点是活化的T细胞表面也表达CD25, 无法与之区分; 随后研究Tregs是通过检测CD4+CD25hi-int, 缺点是CD4+CD25hi-int无法明确界定, 导致同样的研究可能出现不同的结果; 自从Foxp3被认为Tregs特异性的转录因子以来, 检测CD4+CD25hi-intFoxp3+成为迄今鉴定Tregs细胞特异的标志, 但其检测需要破膜染色, 不能用于细胞功能研究及临床免疫治疗; 近年来有研究[5]提示, 在Ⅰ型糖尿病患者中人类调节性T细胞可通过CD127低表达进行识别. 这一群CD127低表达的细胞主要阳性表达Foxp3, 而且还包括低表达和不表达CD25的细胞, 功能学验证有抑制功能和无能性, 提示可以用CD127低表达来定量Tregs且CD127可以作为Tregs的生物学标志. CD4+CD25hi-intCD127lowTregs的这些细胞多数是Foxp3+, 联合CD4、CD25、CD127作为膜表面标志物可以得到更纯化的Tregs, 他的表达与Foxp3表达极其一致, 并且与CD4细胞中、高表达CD25也相一致, 这个标志更适用于体外培养与分析. 也有研究[6]认为, 在CD127低表达的细胞群中有34.0%±15.1%不表达Foxp3, 而在CD127高表达的细胞群中则有30.3%±7.4%表达Foxp3, 所以CD127低表达与Foxp3阳性表达在人外周血中定义的是不同的Tregs群; 并且以CD127进行检测, 流式细胞图上细胞分群不清楚, 影响检测结果. 所以, 能否用CD127低表达来定义Tregs还有待进一步的研究.
我们的研究表明, 对同一HCC患者的同一份外周血全血标本同时以CD4+CD25hi-intFoxp3+和CD4+CD25hi-intCD127low为表型标志鉴定Tregs, Tregs占CD4+ T细胞的比例数值上讲呈正相关, 也就是说Tregs上膜表面分子CD127的低表达和细胞膜内特异性转录因子Foxp3的阳性表达正相关, 与Liu等[5]的研究结果相似. 但是, 我们也可以看到, 两群细胞并不完全重叠一致, 数值上也不完全相同, 还不能认为CD127lowTregs和Foxp3+Tregs是完全相同的一群细胞. 所以, 我们只能得出结论, 用CD127lowTregs和Foxp3+Tregs在数值上有很好的相关性.
既然用CD127lowTregs和Foxp3+Tregs在数值上有很好的相关性, 我们可否建立模型来描述他们之间的数量关系呢?从二者的散点图可以看出二者存在明显的正相关. 但这种绝对的直线相关并不多见, 且直线是一种特殊的曲线, 为了验证两者之间的关系, 我们用SPSS13.0进行曲线估计, 产生11种拟合模型. 可以看到, Linear(线性模型)的决定系数R2为0.791, 并不是最优模型, 而Power(幂模型)决定系数R2最高, 为0.810, 是最优模型, 故选用幂模型建立两者之间的数值转换的回归方程. 这可方便临床应用, 我们也在进一步验证该模型的有效性.
从经济学和临床应用的角度上讲, 由于使用Foxp3检测Tregs花费相对较高, 检测步骤复杂, 且不能进行下一步的细胞培养和分析, 而使用低表达CD127来检测Tregs检测花费相对较少, 检测步骤相对简单, 可以进行下一步的细胞培养和分析, 且在细胞检出水平上与需要破膜的Foxp3检测有很好的相关性, 我们认为可以使用CD127low作为Tregs的表型标志进行肝癌病情、疗效观察及随访等研究. 在HCC患者的临床随访观察中, 如果同一患者前后检测Tregs使用的方法不一致, 我们可以利用两者数值转换的幂模型得出近似数值, 进行患者外周血Tregs变化的动态观察.
总之, 我们认为: 在HCC患者外周血中的Tregs水平是升高的, 且用CD127低表达和Foxp3阳性表达两种方法检测HCC患者外周全血CD4+CD25hi-intTregs的水平呈正相关, 可利用幂模型得出两者之间近似的数值转换, 方便用外周血中的Tregs为指标对HCC患者进行临床随访观察. 我们也进一步在观察其他患者中使用CD127低表达和Foxp3阳性表达两种方法检测数值的相关性, 并验证两者之间数值幂模型转换的有效性.
肝脏是一个倾向于免疫耐受的器官. 当肝脏肿瘤发生时, 肿瘤之所以能够快速生长并转移的一个重要原因就是机体的免疫系统对肿瘤组织表现出一种耐受性, 即免疫耐受, 肿瘤细胞不能被淋巴细胞有效杀伤. Tregs在HCC患者肿瘤的发生、发展中发挥了重要的作用, 多数人研究表明Tregs在肝癌患者的外周血和肝组织中表达升高. 但是人们检测调节性T细胞方法的不同, 导致关于肝癌的研究结论尚不统一.
高润平, 教授, 吉林大学第一医院肝病科.
目前各种免疫疗法正在用于癌症治疗, 鉴于Tregs在肝癌肿瘤发生、进展中的"免疫抑制"作用, 目前人们正在积极探索如何通过免疫学的改变包括通过Tregs的变化来早期发现肝癌, 以及如何降低Tregs以恢复机体免疫系统对于肿瘤细胞的识别, 从而调动淋巴细胞对肿瘤细胞进行杀伤, 制定有效的免疫治疗策略. 这样, 统一、可以高效识别、花费少的Tregs检测方法的建立就是非常必要的.
对于可否以CD4+CD25hi-intCD127low来定义Tregs以及HCC患者外周血中Tregs是否升高, 目前仍有争议, 且对于Tregs在肝癌患者免疫发病机制中的作用及去除Tregs细胞后是否能有效增强肝癌患者的抗肿瘤免疫尚不能确定.
本研究进一步明确了HCC患者外周血全血中Tregs水平是明显升高的, 且以CD4+CD25hi-intCD127low和CD4+CD25hi-intFoxp3+两种方法检测肝癌患者外周血Tregs水平呈正相关, 两者之间的数值转换可利用回归方程.
本研究比较了Tregs的两种检测方法: 检测Foxp3识别Tregs操作步骤复杂, 费用比较昂贵; 而检测CD127来识别Tregs, 操作步骤相对简单, 费用相对较低, 因此可以使用CD127low为表型标志鉴定Tregs. 并建立了两者之间数值转换的回归方程, 为进一步关于肝癌病情观察、疗效判定、随访研究及探讨进一步的免疫治疗策略提供了前期试验证据.
本研究设计合理, 方法新颖, 实验结果比较可靠, 文中所涉及的研究内容对从事肝脏疾病的临床和基础研究工作者有指导意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | 周 立平, 陈 昕, 巴 静, 赵 连爽, 李 异玲. HBV感染后外周血CD4 CD25 Foxp3 调节性T细胞与疾病进展的相关性. 世界华人消化杂志. 2007;15:2366-2369. [DOI] |
| 2. | Mougiakakos D, Choudhury A, Lladser A, Kiessling R, Johansson CC. Regulatory T cells in cancer. Adv Cancer Res. 2010;107:57-117. [PubMed] [DOI] |
| 3. | Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol. 2003;4:330-336. [PubMed] [DOI] |
| 4. | Hartigan-O'Connor DJ, Poon C, Sinclair E, McCune JM. Human CD4+ regulatory T cells express lower levels of the IL-7 receptor alpha chain (CD127), allowing consistent identification and sorting of live cells. J Immunol Methods. 2007;319:41-52. [PubMed] [DOI] |
| 5. | Liu W, Putnam AL, Xu-Yu Z, Szot GL, Lee MR, Zhu S, Gottlieb PA, Kapranov P, Gingeras TR, Fazekas de St Groth B. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. J Exp Med. 2006;203:1701-1711. [PubMed] [DOI] |
| 6. | Klein S, Kretz CC, Krammer PH, Kuhn A. CD127(low/-) and FoxP3(+) expression levels characterize different regulatory T-cell populations in human peripheral blood. J Invest Dermatol. 2010;130:492-499. [PubMed] [DOI] |
| 8. | Delhem N, Carpentier A, Moralès O, Miroux C, Groux H, Auriault C, Pancré V. [Regulatory T-cells and hepatocellular carcinoma: implication of the regulatory T lymphocytes in the control of the immune response]. Bull Cancer. 2008;95:1219-1225. [PubMed] |
| 9. | Fu J, Xu D, Liu Z, Shi M, Zhao P, Fu B, Zhang Z, Yang H, Zhang H, Zhou C. Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients. Gastroenterology. 2007;132:2328-2339. [PubMed] [DOI] |
| 10. | Wolf D, Rumpold H, Koppelstätter C, Gastl GA, Steurer M, Mayer G, Gunsilius E, Tilg H, Wolf AM. Telomere length of in vivo expanded CD4(+)CD25 (+) regulatory T-cells is preserved in cancer patients. Cancer Immunol Immunother. 2006;55:1198-1208. [PubMed] [DOI] |
| 11. | Unitt E, Rushbrook SM, Marshall A, Davies S, Gibbs P, Morris LS, Coleman N, Alexander GJ. Compromised lymphocytes infiltrate hepatocellular carcinoma: the role of T-regulatory cells. Hepatology. 2005;41:722-730. [PubMed] [DOI] |