修回日期: 2010-04-20
接受日期: 2010-04-27
在线出版日期: 2010-05-08
目的: 研究0.2-0.4 T中强静磁场对肿瘤细胞生长和黏附的影响.
方法: 用0.2-0.4 T静磁场对SMMC-7721、HepG2和MCF-7细胞曝磁处理后, 用噻唑蓝(MTT)法检测中强磁场对SMMC-7721、HepG2和MCF-7细胞生长增殖的影响. 通过结晶紫染色检测细胞对FN黏附能力的变化, 并应用流式细胞技术检测中强磁场对肿瘤细胞周期的影响.
结果: 中强磁场影响SMMC-7721、HepG2和MCF-7细胞的生长和黏附功能. 中强磁场对不同的肿瘤细胞有不同的效应, 对SMMC-7721的生长没有明显的影响, 但降低SMMC-7721黏附能力(1.847±0.342 vs 1.094±0.33, P = 0.012), 与对照组相比SMMC-7721细胞周期的G2/M的百分比降低(12.05%±1.14% vs 3.74%±0.87%, P = 0.018). 而对于MCF-7细胞, 中强磁场促进细胞的增殖, 增强细胞对FN的黏附能力(1.094±0.076 vs 2.177±0.474, P = 0.017), 使其G2/M的百分比降低(4.42%±1.23% vs 12.04%±1.65%, P = 0.004). HepG2细胞在中强磁场中, 细胞的增殖受到抑制, 对FN的黏附能力没有明显的变化(0.305±0.076 vs 0.394±0.089, P = 0.467), 但G2/M的百分比有所升高(1.90%±0.79% vs 0.24%±0.15%, P = 0.046).
结论: 0.2-0.4 T中强静磁场对不同的肿瘤细胞有不同的影响.
引文著录: 曹建平, 骞爱荣, 张维, 商澎. 0.2-0.4 T静磁场对肿瘤细胞生长和黏附功能的影响. 世界华人消化杂志 2010; 18(13): 1337-1343
Revised: April 20, 2010
Accepted: April 27, 2010
Published online: May 8, 2010
AIM: To investigate the effects of exposure to moderate-intensity static magnetic fields on the growth and adhesion of tumor cells.
METHODS: After SMMC-7721, HepG2 and MCF-7 cells were exposed to static magnetic fields (0.2-0.4 T), cell growth was measured by methyl thiazol tetrazolium (MTT) assay, cell adhesion to fibronectin (FN) was detected by crystal violet staining, and cell cycle distribution was evaluated by flow cytometry.
RESULTS: The effects of exposure to static magnetic fields on different cell types differed greatly. Moderate-intensity static magnetic field exposure did not affect cell growth, but reduced cell adhesion to FN (1.847 ± 0.342 vs 1.094 ± 0.33, P = 0.012) and decreased the percentage of cells in G2/M phase (12.05 ± 1.14 vs 3.74 ± 0.87, P = 0.018) in SMMC-7721 cells. In MCF-7 cells, moderate-intensity static magnetic field exposure promoted cell growth, enhanced cell adhesion to FN (1.094 ± 0.076 vs 2.177 ± 0.474, P = 0.017) and increased the percentage of cells in G2/M phase (4.42% ± 1.23% vs 12.04% ± 1.65%, P = 0.004). In HepG2 cells, cell growth was inhibited and cell cycle was blocked in G2 phase (0.305 ± 0.076 vs 0.394 ± 0.089, P = 0.467) after exposure to moderate-intensity static magnetic fields though cell adhesion to FN was not significantly altered (1.90% ± 0.79% vs 0.24% ± 0.15%, P = 0.046).
CONCLUSION: Exposure to moderate-intensity static magnetic fields (0.2-0.4 T) exerts different effects on cell growth, adhesion and cell cycle progression in different types of tumor cells.
- Citation: Cao JP, Qian AR, Zhang W, Shang P. Effects of exposure to static magnetic fields (0.2-0.4 T) on the growth and adhesion of tumor cells. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1337-1343
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1337.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1337
随着科学和技术水平的提高, 人们在自然环境中面临的磁场辐射越来越多, 有低频电磁场、高频电磁场、脉冲磁场、旋转磁场、静磁场、强磁场等, 不同类型磁场的生物效应在多种生物系统上曾有过研究[1]. 不同的磁场对人类的健康有不同的影响[2]. 有研究报道, 由高压线产生的高频电磁场使居住于其附近的未成年人的白血病产生的机会大幅增加[2], 而低频点磁场对细胞的形态、增殖、周期、染色体结构、基因表达等均会产生影响[3]. 但并非电磁场没有有益的方面, 结合静磁场在一些疾病的治疗中已经得到应用. Haddad等[4]运用电磁场来治疗骨质疾病就取到良好的效果. 近几年通过对静磁场生物学效应的研究, 发现其对生命活动的影响也会因不同的生物体而产生不同的效应[5], 虽然磁场对离体培养的肿瘤细胞影响的研究报道较多[6], 磁场抑制肿瘤的动物实验的报道也不少[7,8], 但这些研究主要集中在低频或高频电磁场方面, 而静磁场对离体培养的肿瘤细胞影响的研究比较少.
磁场的细胞生物学效应是磁场和细胞共同作用的结果, 是与两者的参数密切相连的. 磁场参数包括磁场类型、场强大小、均匀性、方向性、作用时间等; 细胞因子包括细胞的磁性、种类、敏感性、作用部位等, 这些参数都是影响磁场细胞生物学效应的主要因素[9,10]. 磁场对肿瘤细胞影响的规律和机制有待进一步深入研究. 本文报道了由大梯度强磁场产生的中强度静磁场(0.2-0.4 T)对不同肿瘤细胞的增殖、细胞周期和黏附能力所产生的影响特征, 期望能对临床利用磁场治疗肿瘤提供理论依据, 并为磁场环境对生命活动的影响机制作一些初步研究.
RPMI 1640培养基(GibcoTM, Invitrogen Corporation)、MEM培养基(Hyclone), L-15培养基(CO2非依赖培养基, GibcoTM, Invitrogen Corporation), 胎牛血清(GibcoTM, Invitrogen Corporation), 胰岛素[诺和灵, 诺和诺德(中国)制药有限公司], 青霉素(Penicillin, Amresco), 链霉素(Streptomycin, Solarbio), 胰蛋白酶(Trypsase, Amresco)、噻唑蓝(MTT, Amresco)、二甲基亚砜(DMSO), 其余试剂皆为国产分析纯制剂. CO2培养箱(Thermo), 超导磁体(JMTA-16T50MF, 日本JASTEC), 酶标仪(Model 680, Bio-Rad), 流式细胞仪(FACSCalibur, BD).
1.2.1 细胞培养: SMMC-7721肝癌细胞、HepG2肝癌细胞和MCF-7乳腺癌细胞均购自上海细胞库. SMMC-7721肝癌细胞培养于10%小牛血清、100 kU/L青霉素及100 kU/L链霉素的RPMI 1640培养基中; HepG2肝癌细胞常规培养于10%小牛血清、100 kU/L青霉素及100 kU/L链霉素的MEM培养基中; MCF-7乳腺癌细胞常规培养于10%小牛血清、0.2 kU/L胰岛素、100 kU/L青霉素及100 kU/L链霉素的MEM培养基中. 在37 ℃、饱和湿度及50 mL/L CO2的细胞培养箱内培养, 2-3 d传代1次, 以维持细胞处于对数成长期.
1.2.2 磁场环境: 超导磁体产生的外周中强磁场(0.2-0.4 T)环境. 超导磁体在其外部环境中产生一个0.2-0.4 T的静磁场环境. 在这一磁场强度区域内, 本研究制作一个铜制的培养箱, 并用热循环水控制其温度于37 ℃. 将培养的对数期SMMC-7721、HepG2和MCF-7细胞用L-15培养基(CO2非依赖培养基)在50 mm培养皿中并置于0.2-0.4 T的中强磁场中, 37 ℃密闭培养. 对照组细胞置于普通培养箱中, 也用L-15培养基与50 mm培养皿中37 ℃密闭培养.
1.2.3 MTT法检测中强磁场对肿瘤细胞生长的影响: 先将SMMC-7721、HepG2和MCF-7细胞以2×104的接种量接种于酶标条中, 37 ℃, 5 mL/L CO2预培养过夜. 将酶标条中的培养基换为L-15培养基, 密封并置于0.2-0.4 T的中强磁场中37 ℃连续培养72 h, 每隔6 h, 加入MTT液继续培养4 h, 然后每孔加入DMSO 100 μL, 振荡混匀后用酶标仪测定每孔A490nm值. 用GraphPad Prism 5.0软件绘制生长曲线. 对照组的处理, 除了在普通培养箱中培养外, 其他均与曝磁组相同.
1.2.4 流式细胞技术检测中强磁场对肿瘤细胞周期的影响: 先将细胞SMMC-7721、HepG2和MCF-7用血清饥饿法进行同步培养, 然后以2×105的接种量接种于50 mm培养皿中, 在37 ℃, 50 mL/L CO2预培养过夜. 换用L-15培养基, 密封并置于0.2-0.4 T的中强磁场中37 ℃培养过夜. 消化后调整细胞浓度为1×106. 离心除去上清液. 加入1 mL的DNA低渗缓冲液(0.1%柠檬酸三钠、0.3% Triton X-100、0.01% PI和0.002%核糖核酶)使细胞悬浮, 4 ℃避光, 30 min后用流式细胞仪检测细胞周期. 对照组的处理, 除了在普通培养箱中培养外, 其他均与曝磁组相同.
1.2.5 结晶紫染色法检测中强磁场对肿瘤细胞黏附的影响: 用FN(1 g/L)包被酶标条: 每孔加入5 μL的FN, 4 ℃过夜. 用0.1% FBS(SMMC-7721用RPMI 1640培养基配制, HepG2和MCF-7细胞用MEM培养基配制)洗3次. 再用0.5% FBS 37 ℃封闭1 h. 然后每孔加入100 μL 5×108/L的细胞, 与0.2-0.4 T的磁场中培养1.5 h, 使细胞与细胞外基质黏附. 然后用PBS清洗加样孔以除去未黏附的细胞. 950 mL/L乙醇固定15 min后, 弃去乙醇, 加入100 μL 0.5%结晶紫, 室温30 min, 弃去结晶紫, 用PBS洗加样孔至无色, 再加入10%乙酸10 min, 最后用酶标仪测定570 nm的吸光度. 对照组除了在37 ℃培养箱中培养外, 其他均与实验组相同. 另外空白对照组, 除了未加细胞外其余的过程与对照组和实验组相同.
统计学处理 测定值以mean±SD表示. 采用GraphPad Prism 5.0软件进行数据分析. 组间比较采用多样本均数的Two-way ANOVA检验. 两组均数比较采t检验. P<0.05表示差异有统计学意义, P<0.01表示有显著性差异.
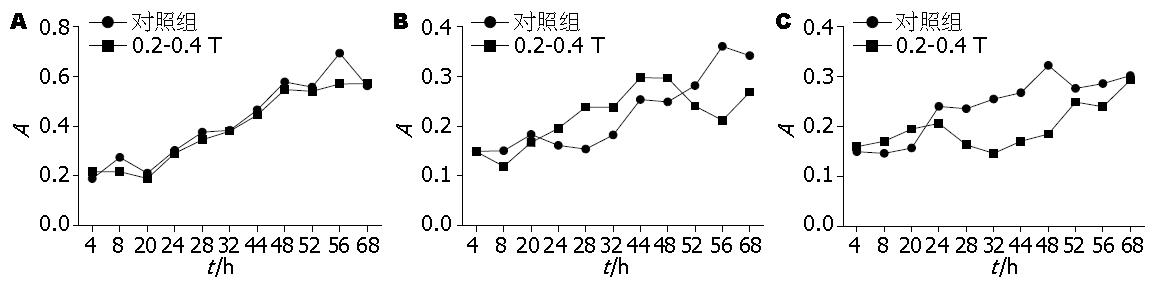
中强磁场对不同的肿瘤细胞的增殖有不同的效应. 从图1中可以看到, 0.2-0.4 T的磁场对SMMC-7721细胞的生长基本上没有影响, 从生长曲线上看对照组和实验组的生长曲线几乎完全重叠. 但是0.2-0.4 T的磁场对HepG2和MCF-7细胞的生长影响却很大. 0.2-0.4 T的静磁场对MCF-7细胞的生长有促进作用, 而对HepG2细胞的生长有抑制作用. 因此可以看到0.2-0.4 T的静磁场对不同的肿瘤细胞的生长会产生有不同的效果.
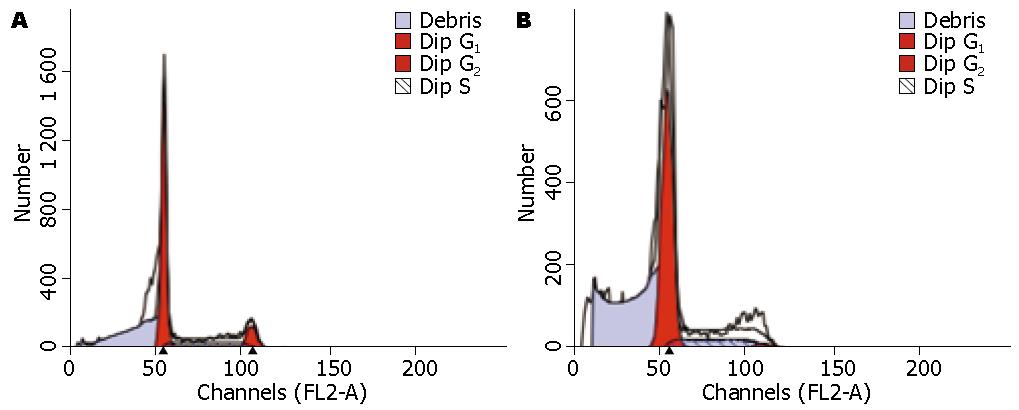
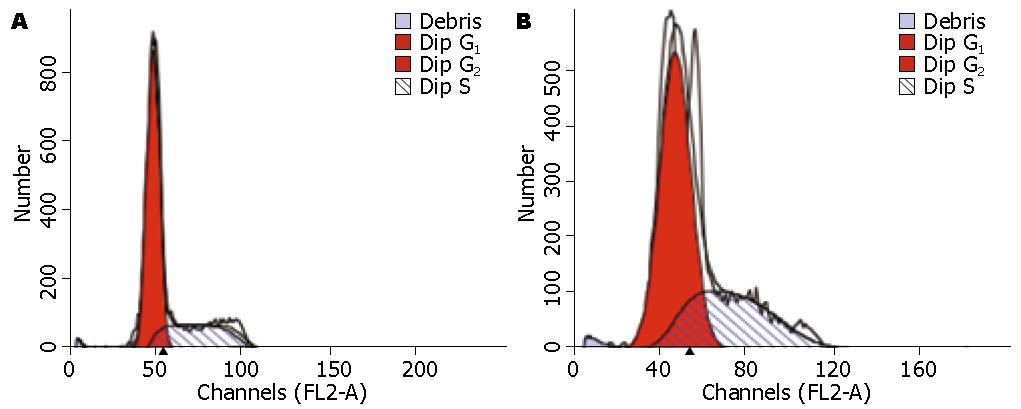
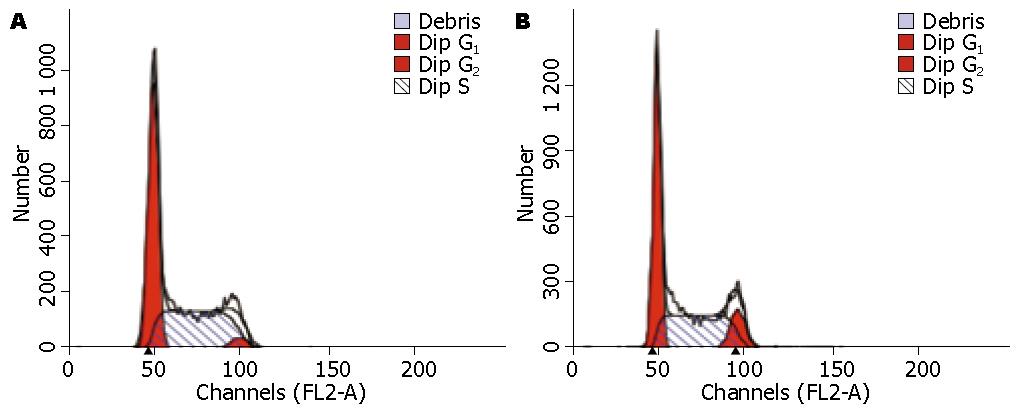
由图2, 图3, 图4和表1可以看到中强磁场对不同肿瘤细胞的细胞周期影响是不同的. SMMC-7721和HepG2细胞的细胞周期在磁场中G2期细胞的比例减少, 这说明磁场促进了细胞由G2期到M期的转化. 与对照组相比SMMC-7721细胞周期的G2/M的百分比降低(12.05%±1.14% vs 3.74%±0.87%, P = 0.018). 而对于MCF-7细胞则正好相反, 在G2期内抑制细胞周期地进行, 其G2/M的百分比降低(4.42%±1.23% vs 12.04%±1.65%, P = 0.004).
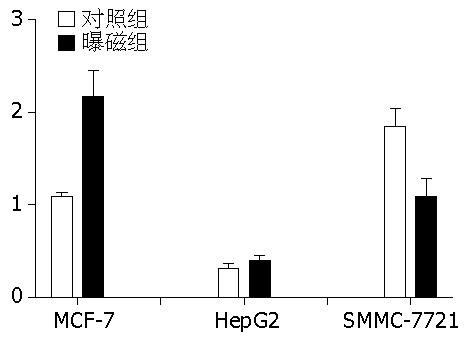
黏附能力是癌细胞侵蚀的始动步骤, 高侵袭的肿瘤细胞与基底膜成分的异质性黏附能力通常增高. 黏附实验表明, 中强磁场对肿瘤细胞对细胞外基质FN的黏附能力的影响随细胞的不同而有差异. 由图5可以看到, 在0.2-0.4 T的磁场中, 与对照组相比MCF-7细胞对FN黏附能力增强(1.094±0.076 vs 2.177±0.474, P = 0.017), 而SMMC-7721细胞对FN黏附能力减弱(1.847±0.342 vs 1.094±0.33, P = 0.012), 但是0.2-0.4 T的磁场对HepG2细胞对FN黏附能力基本上没有影响(0.305±0.076 vs 0.394±0.089, P = 0.467). 因此, 磁场对不同的肿瘤细胞黏附能力有不同的效应.
近几年来对磁场的细胞生物学效应的研究发现, 磁场对细胞的影响表现在多个层次. 在分子水平上, 磁场对蛋白质等生物大分子产生效应. 由于磁场产生的磁力矩的作用, 会是默写蛋白质的结构和功能发生变化. 如在增殖的GH3细胞中电压激活的Na+流在125 mT的磁场中则减少[11]. 这是由于磁场的作用使Na+通道发生改变. 磁场同样也影响基因的表达, 而且这种影响因不同的基因而异. 100 mT的静磁场处理小鼠海马神经元细胞会增加生长相关蛋白-43(AP-1)的表达[12], 0.18-0.2 T的静磁场处理HelaS3细胞也会增加c-fos mRNA在细胞中表达增加[13]. 而0.5 T处理人外周血单核细胞, 虽然细胞中IFN-γ和IL-4的表达增加, 但其CD69的表达却会降低[14]. 磁场对基因及其表达的影响, 主要取决于对磁场的敏感性和表达与磁场的相关性. 在细胞结构层次上, 磁场首先会影响细胞的形态. 在0.2 T磁场中, 人神经细胞(FNC-B4)的形态发生明显地改变, 显示细胞涡流的形成和分枝神经炎特点的突触终扣的出现[15]. 细胞的形态受到影响则细胞的结构和功能势必也会受到影响. 大鼠的肾细胞和皮层星形胶质细胞在0.5 mT的静磁场中, 随处理时间的延伸, 其增殖会逐渐降低[16]. 在静磁场中, 细胞的代谢活动也会受到影响. 在0.2 T的静磁场中人成龈纤维细胞的乳酸盐产生率、葡萄糖消耗均出现明显的改变[17]. 磁场常常能促进由诱导剂引起的细胞凋亡. 6 mT磁场能促进由喜树碱诱导的HL-60细胞的凋亡[18]. 同样7 mT磁场也能促进由FeCl2诱导的淋巴细胞的凋亡[19]. 最有趣的是磁场会影响体外培养细胞的排列. 镰刀型红细胞在0.35 T的磁场中, 其长轴定向地与磁场垂直[20], 而作用于正常的红细胞, 红细胞的盘平面与磁场方向平行[21], 在4.0 T的磁场中, 人的包皮成纤维细胞[22]、成骨细胞[23]也会发生定向排列反应. 这可能是由于细胞中含有某些抗磁性的物质, 使某些细胞及其结构在磁场中沿一定方向排列. 由于这一特征, 也为细胞组织工程提供一很好的方法.
本研究的结果表明, 中强静磁场对肿瘤细胞的影响因不同的细胞有很大差异. 对于SMMC-7721和HepG2细胞, 虽然他们均为肝癌细胞, 但来源不同所受到磁场的作用也不相同. 中强静磁场对SMMC-7721细胞的增殖不产生影响, 但却明显抑制HepG2细胞的增殖. 对于不同组织来源的细胞-乳腺癌细胞, 其增殖在中强静磁场中表现出较为复杂的变化. 在培养52 h以前, 磁场促进了MCF-7细胞的增殖. 但随后细胞的增殖明显的受到抑制. 这可能的原因是在初期细胞的生长受到促进, 培养基的营养消耗快, 对于细胞生长有害的物质积累也比较快的原因造成的. 静磁场对不同的细胞增殖有不同的效应. Tenuzzo等[24]研究了多种细胞包括正常细胞和转化细胞, 发现这些细胞的增殖一样也是各不相同, 其中对HepG2细胞的研究同样表现为抑制作用. 大量的研究报道表明, 一定强度的静磁场可以抑制肿瘤的生长, 这为应用磁场治疗肿瘤提供了实验依据[25-27].
对于黏附能力来说, SMMC-7721细胞的黏附能力明显受到磁场的抑制, 而HepG2细胞的黏附能力在磁场中没有明显的变化. 两种细胞的G2/M细胞的百分比均明显降低, 差异很显著. 然而对于MCF-7细胞来说, 磁场却明显促进了其黏附能力. 这说明磁场对肿瘤细胞的功能产生一定的影响, 但这种影响因细胞的不同而各有差异. 这种现象同样也表现在磁场对细胞周期的影响中. 对于SMMC-7721细胞来说, G0/G1细胞的百分比增加, 其可能的机制是磁场促进了静止态的G1期细胞活跃而向S期转变, 使DNA合成增多. 而HepG2细胞G0/G1细胞的百分比变化不明显, 但细胞的增殖受到抑制, 这说明细胞的在M期的生长过程受到了磁场的影响. MCF-7细胞在中强静磁场中的生长也明显受到影响. 磁场促进了MCF-7细胞的增殖, 但促进了细胞的黏附能力, G2/M细胞的百分比明显增加. 推测肿瘤细胞的DNA合成受到静磁场的影响和调节. 结合磁场对肿瘤细胞增殖的影响结果来看, 磁场对肿瘤细胞的影响在不同方面其结果是不相同的, 这说明在应用磁场治疗肿瘤的应用中还要考虑到肿瘤的种类和特征.
MCF-7细胞在中强静磁场中所受到的影响与SMMC-7721细胞和HepG2细胞所受到磁场的影响结果几乎相反, 这说明不同组织来源的细胞所受到磁场的作用是不同的. 我们知道, 组成机体的物质按期磁性本质特征分为顺磁性物质和抗磁性物质, 并且这两种物质在磁场中表现出的物理本质现象是不同的. 肝脏作为机体代谢的重要器官, 含有大量的顺磁性物质, 如Fe, 那么由此来源的细胞所含顺磁性物质也必定高于其他组织来源的细胞. 骞爱荣等[28]研究发现, 强磁重力环境影响成骨细胞的形态、增殖以及细胞中钙、钠、镁等元素百分含量. 由此可见, 他们势必在磁场中表现出不同的效应.
虽然静磁场的细胞生物学效应复杂, 其生物安全性还需要进一步的研究探索. 在应用磁场对肿瘤的治疗中还应考虑到静磁场对正常细胞的影响. 磁场对正常细胞的影响也表现在多个方面, 对其增殖、细胞的结构和功能也会产生影响[29-31]. 如磁场对MC-3T3细胞的增殖以及结构和功能产生影响. 但这些并未阻碍磁场在临床中的应用. 但近年来强静磁场甚至是超强静磁场在医疗上已经展开了应用. 如现在运用的核磁共振成像检测疾病时, 就运用了很强的静磁场, 且这一强度有的甚至达到10 T[32]. 也有人将磁场与放疗、化疗联合应用于恶性肿瘤的临床治疗. 柳霞等[33]的研究显示, 联合磁场与化疗治疗恶性肿瘤并未发现明显的不良反应, 所有患者均能耐受. Letiagin等[34]应用磁场联合放疗、化疗治疗局部晚期乳腺癌患者, 取得了很好的疗效, 并未增加副反应的发生. 但磁场对肿瘤细胞所产生的影响因细胞的不同而异. 在应用磁场对肿瘤治疗的同时, 还应考虑磁场的特征和肿瘤细胞的特征.
磁场的细胞生物学效应是磁场和细胞共同作用的结果, 是与两者的参数密切相连的. 磁场参数包括磁场类型、场强大小、均匀性、方向性、作用时间等; 细胞因子包括细胞的磁性、种类、敏感性、作用部位等, 这些参数都是影响磁场细胞生物学效应的主要因素. 磁场对肿瘤细胞影响的规律和机制有待进一步深入研究.
陈洪, 副教授, 东南大学附属中大医院消化科; 荚卫东, 副教授, 安徽省立医院肝脏外科.
Tenuzzo等研究了多种细胞包括正常细胞和转化细胞, 发现这些细胞的增殖一样也是各不相同, 其中对HepG2细胞的研究同样表现为抑制作用.
本文报道了由大梯度强磁场产生的中强度静磁场(0.2-0.4 T)对不同肿瘤细胞的增殖、细胞周期和黏附能力所产生的影响特征, 期望能对临床利用磁场治疗肿瘤提供理论依据, 并为磁场环境对生命活动的影响机制作一些初步研究.
大量的研究报道表明, 一定强度的静磁场可以抑制肿瘤的生长, 这为应用磁场治疗肿瘤提供了实验依据.
本研究设计尚合理, 讨论较全面, 文中所列图表及其说明比较清楚可靠, 内容较新颖, 有一定创新性, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Funk RH, Monsees T, Ozkucur N. Electromagnetic effects - From cell biology to medicine. Prog Histochem Cytochem. 2009;43:177-264. [PubMed] [DOI] |
| 2. | Hardell L, Sage C. Biological effects from electromagnetic field exposure and public exposure standards. Biomed Pharmacother. 2008;62:104-109. [PubMed] [DOI] |
| 3. | Miyakoshi J. Biological responses to extremely low-frequency electromagnetic fields. J Dermato Sci. 2006;2:23-30. [DOI] |
| 4. | Haddad JB, Obolensky AG, Shinnick P. The biologic effects and the therapeutic mechanism of action of electric and electromagnetic field stimulation on bone and cartilage: new findings and a review of earlier work. J Altern Complement Med. 2007;13:485-490. [PubMed] [DOI] |
| 5. | Silva AK, Silva EL, Egito ES, Carriço AS. Safety concerns related to magnetic field exposure. Radiat Environ Biophys. 2006;45:245-252. [PubMed] [DOI] |
| 6. | Cameron IL, Short NJ, Markov MS. Safe alternative cancer therapy using electromagnetic fields. Environmentalist. 2007;27:453-456. [DOI] |
| 7. | Hashish AH, El-Missiry MA, Abdelkader HI, Abou-Saleh RH. Assessment of biological changes of continuous whole body exposure to static magnetic field and extremely low frequency electromagnetic fields in mice. Ecotoxicol Environ Saf. 2008;71:895-902. [PubMed] |
| 8. | Yang PF, Hu LF, Wang Z, Ding C, Zhang W, Qian AR, Shang P. Inhibitory effects of moderate static magnetic field on Leukemia. IEEE Trans Magn. 2009;45:2136-2139. [DOI] |
| 9. | Miyakoshi J. Effects of static magnetic fields at the cellular level. Prog Biophys Mol Biol. 2005;87:213-223. [PubMed] [DOI] |
| 10. | Schenck JF. Physical interactions of static magnetic fields with living tissues. Prog Biophys Mol Biol. 2005;87:185-204. [PubMed] [DOI] |
| 11. | Rosen AD. Effect of a 125 mT static magnetic field on the kinetics of voltage activated Na+ channels in GH3 cells. Bioelectromagnetics. 2003;24:517-523. [PubMed] [DOI] |
| 12. | Hirai T, Nakamichi N, Yoneda Y. Activator protein-1 complex expressed by magnetism in cultured rat hippocampal neurons. Biochem Biophys Res Commun. 2002;292:200-207. [PubMed] [DOI] |
| 13. | Hiraoka M, Miyakoshi J, Li YP, Shung B, Takebe H, Abe M. Induction of c-fos gene expression by exposure to a static magnetic field in HeLaS3 cells. Cancer Res. 1992;52:6522-6524. [PubMed] |
| 14. | Salerno S, Lo Casto A, Caccamo N, d'Anna C, de Maria M, Lagalla R, Scola L, Cardinale AE. Static magnetic fields generated by a 0.5 T MRI unit affects in vitro expression of activation markers and interleukin release in human peripheral blood mononuclear cells (PBMC). Int J Radiat Biol. 1999;75:457-463. [PubMed] [DOI] |
| 15. | Pacini S, Vannelli GB, Barni T, Ruggiero M, Sardi I, Pacini P, Gulisano M. Effect of 0.2 T static magnetic field on human neurons: remodeling and inhibition of signal transduction without genome instability. Neurosci Lett. 1999;267:185-188. [PubMed] [DOI] |
| 16. | Buemi M, Marino D, Di Pasquale G, Floccari F, Senatore M, Aloisi C, Grasso F, Mondio G, Perillo P, Frisina N. Cell proliferation/cell death balance in renal cell cultures after exposure to a static magnetic field. Nephron. 2001;87:269-273. [PubMed] [DOI] |
| 17. | Yamaguchi H, Hosokawa K, Soda A, Miyamoto H, Kinouchi Y. Effects of seven months' exposure to a static 0.2 T magnetic field on growth and glycolytic activity of human gingival fibroblasts. Biochim Biophys Acta. 1993;1156:302-306. [PubMed] [DOI] |
| 18. | Teodori L, Grabarek J, Smolewski P, Ghibelli L, Bergamaschi A, De Nicola M, Darzynkiewicz Z. Exposure of cells to static magnetic field accelerates loss of integrity of plasma membrane during apoptosis. Cytometry. 2002;49:113-118. [PubMed] [DOI] |
| 19. | Jajte J, Grzegorczyk J, Zmyślony M, Rajkowska E. Effect of 7 mT static magnetic field and iron ions on rat lymphocytes: apoptosis, necrosis and free radical processes. Bioelectrochemistry. 2002;57:107-111. [PubMed] [DOI] |
| 20. | Murayama M. Orientation of sickled erythrocytes in a magnetic field. Nature. 1965;206:420-422. [PubMed] [DOI] |
| 21. | Higashi T, Yamagishi A, Takeuchi T, Kawaguchi N, Sagawa S, Onishi S, Date M. Orientation of erythrocytes in a strong static magnetic field. Blood. 1993;82:1328-1334. [PubMed] |
| 22. | Guido S, Tranquillo RT. A methodology for the systematic and quantitative study of cell contact guidance in oriented collagen gels. Correlation of fibroblast orientation and gel birefringence. J Cell Sci. 1993;105:317-331. [PubMed] |
| 23. | Kotani K. Iwasaka M, Ueno S. Magnetic orientation of collagen and bone mixture. J Appl Phys. 2000;87:6191-6193. [DOI] |
| 24. | Tenuzzo B, Chionna A, Panzarini E, Lanubile R, Tarantino P, Di Jeso B, Dwikat M, Dini L. Biological effects of 6 mT static magnetic fields: a comparative study in different cell types. Bioelectromagnetics. 2006;27:560-577. [PubMed] [DOI] |
| 29. | Qian AR, Zhang W, Tian ZC, Di SM, Yang PF, Yin DC, Hu LF, Wang Z, Xu HY, Shang P. Gravitational environment produced by a superconducting magnet affects osteoblast morphology and functions. Acta Astronautica. 2008;63:929-946. [DOI] |
| 30. | Qian AR, Hu LF, Gao X, Zhang W, Di SM, Tian ZC, Yang PF, Yin DC, Weng YY, Shang P. Large gradient high magnetic field affects the association of MACF1 with actin and microtubule cytoskeleton. Bioelectromagnetics. 2009;30:545-555. [PubMed] [DOI] |
| 31. | Qian A, Di S, Gao X, Zhang W, Tian Z, Li J, Hu L, Yang P, Yin D, Shang P. cDNA microarray reveals the alterations of cytoskeleton-related genes in osteoblast under high magneto-gravitational environment. Acta Biochim Biophys Sin (Shanghai). 2009;41:561-577. [PubMed] [DOI] |
| 32. | Schenck JF. Safety of strong, static magnetic fields. J Magn Reson Imaging. 2000;12:2-19. [PubMed] [DOI] |
| 34. | Letiagin VP, Protchenko NV, Rybakov IuL, Dobrynin IaV. [Experience with turbulent magnetic field as a component of breast cancer therapy]. Vopr Onkol. 2003;49:748-751. [PubMed] |