修回日期: 2010-04-07
接受日期: 2010-04-13
在线出版日期: 2010-05-08
目的: 制备抗肝癌单链抗体二聚体高分子免疫纳米颗粒, 观察其对肝癌细胞增殖的影响.
方法: 采用离子交联的方法, 以壳聚糖水溶性衍生物多糖为基材, 将已获得的抗肝癌单链抗体二聚体BDM制备成免疫纳米颗粒, 检测纳米颗粒的表征、包封率及载药量, 并通过MTT法观察免疫纳米颗粒对肝癌细胞株增殖的影响.
结果: 制备粒径为100-200 nm的抗肝癌单链抗体二聚体高分子纳米颗粒, 最佳包封率为53%, 载药量为75 μg/mg抗体二聚体, 抗肝癌单链抗体二聚体高分子纳米颗粒显示较好的抗肿瘤作用, 其对肝癌细胞的抑制率为34%左右, 且有浓度依赖性.
结论: 成功制备了抗肝癌单链抗体二聚体高分子纳米颗粒, 初步应用具有抑瘤性, 为下一步开展体内肝癌的放射免疫诊断和靶向治疗奠定了基础.
引文著录: 别彩群, 韩利民, 王启章, 范红梅, 朱浩峰, 梁旭竞, 杨冬华. 抗肝癌免疫纳米颗粒的制备及其对肝癌细胞增殖的影响. 世界华人消化杂志 2010; 18(13): 1326-1330
Revised: April 7, 2010
Accepted: April 13, 2010
Published online: May 8, 2010
AIM: To prepare polyelectrolyte nanoparticles loaded with humanized single-chain Fv dimers for hepatocellular carcinoma (BDM diabody), and to investigate their effects on the proliferation of hepatocellular carcinoma (HCC) cells.
METHODS: By means of infrared spectroscopy and transmission electron microscopy, the physicochemical characteristics of polyelectrolyte nanoparticles were characterized, including particle size and morphology, the concentration of protein loaded, and the protein entrapment efficiency of the nanoparticles. The effects of BDM-loading nanoparticles on the proliferation of HCC cells were determined by methyl thiazol tetrazolium (MTT) assay.
RESULTS: The particle size ranged from 100 to 200 nm. The concentration of protein loaded was 75 μg/mg. The protein entrapment efficiency was 53%. BDM-loading nanoparticles could significantly inhibit the proliferation of HCC cells.
CONCLUSION: HCC-targeted nanopaticles are successfully prepared, which provides a basis for future targeted diagnosis and therapy of HCC.
- Citation: Bie CQ, Han LM, Wang QZ, Fan HM, Zhu HF, Liang XJ, Yang DH. Preparation of hepatocellular carcinoma-targeted immunonanoparticles and investigation of their effects on the proliferation of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1326-1330
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1326.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1326
近年来, 纳米载药体系作为一种新的药物控释体系已经成为新药研究开发中一个非常闪光的亮点. 纳米颗粒体积超微, 比表面大, 能顺利穿过人体毛细血管, 有利于透皮吸收和细胞内药效发挥; 被单核吞噬细胞系统吞噬后, 能够通过网状内皮系统迅速分布于靶部位; 由于载体材料的保护作用, 可防止药物被胃酸降解, 提高药物口服吸收的生物利用度; 作用于靶器官的纳米粒子, 由于载体的不同特性, 可达到控释、缓释的效果, 高效低毒[1,2]. 目前, 纳米颗粒已被作为药物、蛋白质、疫苗、核酸片段等理想载体, 在生物医药研究和临床诊治, 尤其是对肿瘤的治疗显现出极大的应用前景[3-6]. 多糖是单糖的聚合物, 作为天然的生物材料, 多糖不仅具有高度的稳定性、亲水性、安全无毒性, 体内降解也容易, 自然界来源广泛, 成本低廉, 是纳米载药体系的基质载体的最理想材料[7-10]. 多糖纳米粒子的制备方法有多种, 其中离子交联法因具有制备条件温和, 操作步骤简单等优点在生物医学领域广泛应用. 在前面的研究中我们研究组已构建及在毕赤酵母中表达大量具有良好生物学活性的抗肝癌单链抗体二聚体[11,12], 本研究将采用离子交联法制备壳聚糖/抗肝癌单链抗体二聚体免疫纳米颗粒, 并观察其对肝癌细胞增殖的影响.
抗肝癌单链抗体二聚体BDM为本实验室制备, 等电点为5.9; 壳聚糖(脱已酰度>85%, 黏度 = 2500 cps)为济南海得贝生物技术有限公司产品; 壳聚糖使用前用Co60 γ-辐射(25 kGy剂量)灭菌; 人肝癌细胞株(Bel-7402、HepG2、SMMC-7721)为本室保存, DMEM(Dulbecco's modified Eagle medium)细胞培养基干粉为美国Gibco公司产品; 小牛血清、胰蛋白酶, Invitrogen 公司产品. 其他试剂均为国产分析纯. FT-IR红外光谱仪, Bruker(德国); JSM-T300型扫描电子显微镜, JEOL公司(德国); Biofuge28RS超速离心机, Heraeu(德国).
1.2.1 离子交联法制备壳聚糖/抗体二聚体BDM3纳米粒子: 按文献方法[13,14], 称取壳聚糖6 mg, 搅拌溶解于1%冰醋酸溶液6 mL中, 配制得到壳聚糖溶液, 将抗肝癌单链抗体二聚体BDM分别配制成浓度为0.1、 0.5、1 g/L的水溶液; 分别取去离子水和不同浓度抗体二聚体溶液1 mL加入壳聚糖溶液, 调节溶液的pH, 用电磁搅拌器中速搅拌5 min; 磁力搅拌下缓慢滴加1 mL TPP(0.1%)水溶液, 继续搅拌30 min, 得到乳光液; 4 ℃条件下, 20 000 r/min的转速高速离心30 min; 沉淀物用蒸馏水反复洗涤, 冷冻干燥得到的白色粉末即为壳聚糖纳米粒子和壳聚糖/抗体二聚体BDM纳米粒子.
1.2.2 纳米粒子的表征: 将壳聚糖/抗体二聚体BDM纳米粒子悬浮液超速离心, 去掉上清液, 将底部沉淀冷冻干燥, 采用KBr压片法, 测定纳米粒子的红外光谱. 取所制备的壳聚糖/抗体二聚体BDM纳米粒子悬浮液1滴滴加到镀有碳膜的铜网上, 室温干燥后, 直接用扫描电镜观察纳米粒子的形貌.
1.2.3 纳米粒子的包封率和载药量检测: 将负载了不同浓度的抗肝癌单链抗体二聚体BDM的纳米粒子悬浮液用20 000 r/min超速离心30 min, 上清液中游离的抗肝癌单链抗体二聚体BDM的量用BCA试剂盒测定. 纳米粒子对抗肝癌单链抗体二聚体BDM的包封率和载药量用以下公式计算: BDM的包封率 = (投入BDM总量-游离BDM量)/投入BDM总量×100%; BDM的载药量 = 已包裹BDM总量/微球总量×100%.
1.2.4 壳聚糖/抗体纳米粒体外释放试验: 将载药量最高的壳聚糖/抗体二聚体BDM纳米粒混悬液2 mL置于摇床上震荡120 r/min, 温度保持37 ℃. 在预定不同时间点, 纳米粒悬浊液被取出, 20 000 r/min离心, 上清保存, BCA法检测其中蛋白含量. 沉淀重悬于2 mL新鲜磷酸盐缓冲液继续震荡. 计算累计释放率.
1.2.5 壳聚糖/抗体纳米粒子对肝癌细胞系增殖的影响: 将肝癌细胞株(Bel-7402、HepG2、SMMC-7721)消化之后按1:1:1混匀, 用DMEM细胞培养液稀释成2×104个/mL, 接种于96孔培养板上, 每孔200 μL. 培养24 h, 待细胞贴壁后, 向96孔细胞培养板中加入100 μL不同浓度的BDM和负载了BDM的壳聚糖纳米粒子(10、20、30、50、80、100 mg/L)悬浮液, 每个实验组设四个平行, PBS作为空白对照. 置37 ℃继续培养; 用于制备纳米粒子的壳聚糖的浓度为1 g/L. 培养72 h后, 每孔加MTT溶液(5 g/L)20 μL, 继续孵育4 h, 终止培养, 小心吸弃孔内培养上清液, 每孔加150 μL DMSO, 振荡10 min, 使结晶物充分融解. 选择490 nm波长, 在酶联免疫监测仪上测定各孔光吸收值. 抑制率 = (对照组A值-加药组A值)/对照组A值.
统计学处理 所有数据用SPSS12.0 for Windows软件包进行处理, 计量资料t检验, 计数资料均采用χ2检验, 检验水准α = 0.05.
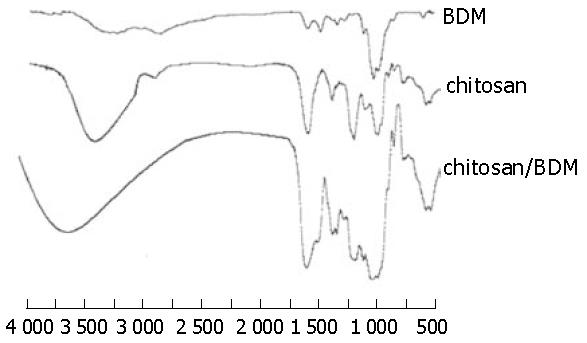
分别对抗体二聚体BDM、壳聚糖和壳聚糖/抗体二聚体BDM纳米粒子进行了红外光谱测定, 测定的红外光谱图分别如图1所示. 在抗体二聚体BDM的红外谱图中, 1 324/cm处伸缩振动吸收谱带明显增强. 壳聚糖的特征吸收谱带为1 524.32/cm(-NH3+), 1 047.63/cm(C-O伸缩), 壳聚糖/抗体二聚体BDM纳米粒子的红外谱图中, 在1 552/cm处出现了新的吸收谱带, 该吸收谱带表明在壳聚糖的氨基和抗体的羧基之间形成了离子键.
制备的壳聚糖/抗体二聚体BDM纳米粒子进行了扫描电镜观察, 所得的电镜照片如图2. 可看出, 纳米粒子的粒径为100-200 nm, 表面光滑, 大小比较均一, 形态呈球形, 而且分散性较好, 较少有粘连团聚的现象.
经测量, 壳聚糖纳米粒子对不同浓度(0.1、 0.5、1 g/L)BDM3的包封率为21%、33%、53%, 每毫克壳聚糖纳米粒子含BDM为4、28、75 μg, 包封率和载药量随着抗体浓度的增加而增加.
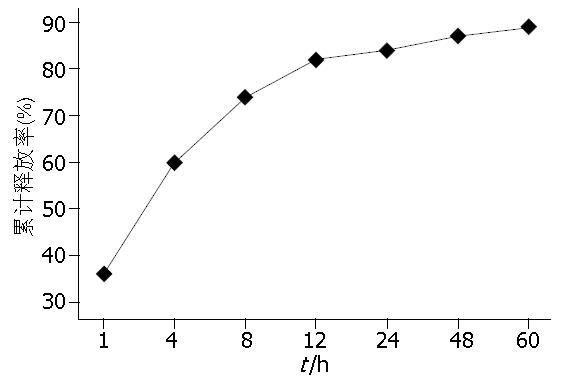
将载药量最高的纳米粒子进行体外释放实验, 于1、4、8、12、24、48、60 h各时间点取震荡中的纳米粒离心, 取上清进行蛋白浓度测定, 计算累计释放药物量, 释放曲线见图3, 体外释药曲线呈双相, 即在爆发释放之后为缓慢释放, 抗体的释放在最初1 h内有爆发释放现象, 释放率达36%, 这是由于纳米粒子具有很大的比表面积, 其表面可吸附较多抗体分子, 可能是由于这些吸附于粒子表面的抗体解吸, 而造成壳聚糖纳米粒子的爆发释放. 4 h其累积释放率达到60%, 4-12 h内抗体接近匀速释放, 12 h后抗体的释放变得非常缓慢, 其最大累积释放率为82%.
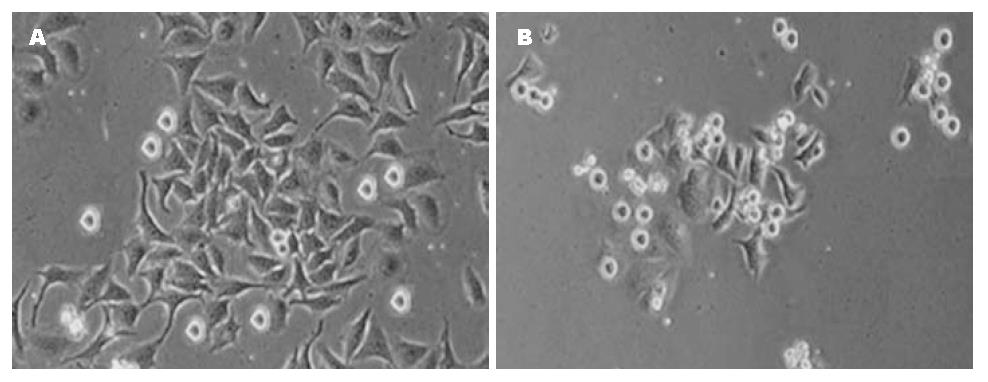
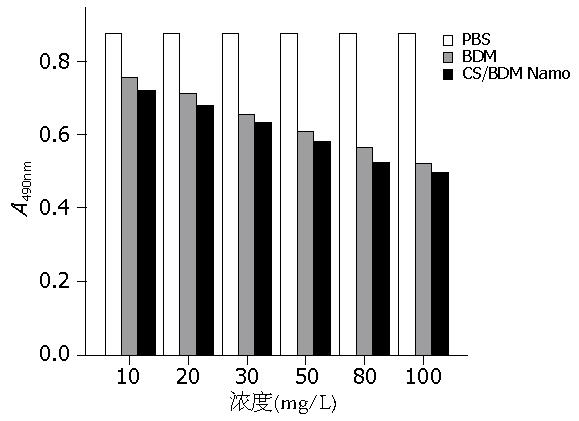
测定抗肝癌单链抗体二聚体水溶液、负载抗肝癌单链抗体二聚体的壳聚糖纳米粒子悬浮液对肝癌细胞的抑制作用. 不同浓度的抗肝癌单链抗体二聚体溶液、壳聚糖/BDM纳米粒子悬浮液对肝癌细胞的抑制作用. 壳聚糖纳米粒与负载抗体的壳聚糖纳米粒与肝癌细胞共培养见图4. MTT结果显示, 抗肝癌单链抗体二聚体对肝癌细胞的抑制作用随浓度的增加而增加, 相比游离的抗肝癌单链抗体二聚体, 被纳米粒子负载的抗肝癌单链抗体二聚体对肝癌细胞的显示出更好的抑制作用, 浓度为100 mg/L壳聚糖/BDM纳米粒子对肝癌细胞的抑制率为34%, 而浓度为10 mg/L壳聚糖/BDM纳米粒子对肝癌细胞的抑制率为15%, 其抑瘤作用与浓度成正比(图5).
20世纪80年代肝癌的靶向治疗开始兴起, 现在已经发展到从器官(组织)、细胞到分子三个水平实施肝癌靶向治疗[15]. 靶向治疗是指将配体或抗体等特异性的靶向分子偶联至纳米粒子表面而使药物定向分布到靶组织[16,17]. 纳米粒对肝癌的靶向途径有: 受体介导的靶向途径, 如去唾液酸糖蛋白受体介导系统和甘露糖受体介导系统; 免疫分子介导的靶向途径, 即通过抗原抗体结合的特异性相互作用, 实现药物的靶向传递, 如抗体介导的靶向药物、免疫微球靶向给药系统、基因介导靶向途径等. 目前这方面的研究很多. 米托恩醌牛血清白蛋白纳米粒(DHAQBSA-NP)接上抗人肝癌单克隆抗体Hab18构建人肝癌特异性的免疫纳米粒(Hab18- DHAQBSA-NP), 体外作用于人肝癌株SMMC-7221细胞, 显示出明显的细胞毒性作用, 又能特异性地结合人肝癌细胞[18]. 2002年, 美国FeRx公司磁导向载体-阿霉素(MTC-DOX)技术已通过美国FDA认证, 主要用于肝细胞癌的治疗, 并在随后临床治疗中取得显著的疗效[19].
纳米粒作为载药系统使用, 最终目的是实现药物的长效缓释与定向释放, 载药纳米粒的体外药物释放性能是反映载药纳米粒缓释效果的一个重要指标, 对评价载药纳米粒的有效性有极为重要的参考价值. 本研究中载药纳米粒的体外释药曲线呈双相行, 在长达60 h的释药实验中观察到壳聚糖纳米粒释药包括较快释放及平缓释放两个过程. 前12 h内累积释药率达到60%, 为较快释放, 使所递呈的抗体在短期内达到有效的治疗浓度, 而12-60 h内最大累积释药率为82%, 为平缓释放过程, 保证了治疗的时效性. 该实验说明药物的释放是可控的, 这对于设计可提供临床相关药物浓度的纳米粒传输系统是非常重要的.
本研究将抗肝癌单链抗体二聚体通过共价交联在高分子壳聚糖纳米粒子的表面形成具有免疫活性的纳米粒子, 他具有双重靶向性, 即一方面他属于纳米粒子体系, 可通过控制粒子大小使其选择性地被动滞留在特定的器官; 另一方面, 可通过改变粒子表面修饰的抗体在体内免疫应答而特异性作用于其相关抗原的细胞, 使其易达到靶细胞区. 抗肝癌单链抗体二聚体纳米粒对肝癌细胞的具有明显的抑制作用, 相比游离的抗肝癌单链抗体二聚体, 被纳米粒子负载的抗肝癌单链抗体二聚体对肝癌细胞的显示出更好的抑制作用, 且抑制作用随浓度的增高而增加. 这可能是由于被纳米粒子包裹的抗肝癌单链抗体二聚体被缓慢释放出来, 能够在较长时间范围内有效抑制肿瘤细胞.
本文所研究抗肝癌抗体是从噬菌体抗体库中筛选出来的具有与肝癌细胞系结合的单链抗体, 原考虑将其作为"弹头"用于肝癌的靶向诊断, 但本实验表明该抗体还有"弹药"的作用, 可直接抑制肿瘤细胞的增殖, 为后续研究和临床诊治提供了新思路, 为下一步开展体内肝癌的放射免疫诊断和靶向治疗奠定了基础, 其抑制肿瘤细胞增殖机制尚待进一步探讨.
近年来, 纳米载药体系作为一种新的药物控释体系已经成为新药研究开发研中一个非常闪光的亮点. 目前, 纳米颗粒已被作为药物、蛋白质、疫苗、核酸片段等理想载体, 在生物医药研究和临床诊治中显现出极大的应用前景.
庄林, 主任医师, 昆明市第三人民医院肝病科.
米托恩醌牛血清白蛋白纳米粒接上抗人肝癌单克隆抗体Hab18构建人肝癌特异性的免疫纳米粒, 体外作用于人肝癌株SMMC-7221细胞, 显示出明显的细胞毒性作用, 又能特异性地结合人肝癌细胞. 多柔比星-聚氰基丙稀酸正丁酯纳米粒, 与高特异性的抗人肝癌酸性同功铁蛋白单克隆抗体结合, 得到肝癌特异性免疫纳米粒, 体外细胞毒试验及裸鼠体内抑瘤试验均表现出极强的肝肿瘤靶向性.
本研究将抗肝癌单链抗体二聚体通过共价交联在高分子壳聚糖纳米粒子的表面形成具有免疫活性的纳米粒子, 他具有双重靶向性, 即一方面他属于纳米粒子体系, 可通过控制粒子大小使其选择性地被动滞留在特定的器官; 另一方面, 可通过改变粒子表面修饰的抗体在体内免疫应答而特异性作用于其相关抗原的细胞, 使其易达到靶细胞区.
本文所研究抗肝癌抗体是从噬菌体抗体库中筛选出来的具有与肝癌细胞系结合的单链抗体, 原考虑将其作为"弹头"用于肝癌的靶向诊断, 但本实验表明该抗体还有"弹药"的作用, 可直接抑制肿瘤细胞的增殖, 为后续研究和临床诊治提供了新思路, 为下一步开展体内肝癌的放射免疫诊断和靶向治疗奠定了基础.
本研究选题很好, 符合当前的研究热点, 目的明确, 方法正确, 结果可信.
编辑: 李军亮 电编: 吴鹏朕
| 3. | Debotton N, Parnes M, Kadouche J, Benita S. Overcoming the formulation obstacles towards targeted chemotherapy: in vitro and in vivo evaluation of cytotoxic drug loaded immunonanoparticles. J Control Release. 2008;127:219-230. [PubMed] [DOI] |
| 4. | Chen H, Gao J, Lu Y, Kou G, Zhang H, Fan L, Sun Z, Guo Y, Zhong Y. Preparation and characterization of PE38KDEL-loaded anti-HER2 nanoparticles for targeted cancer therapy. J Control Release. 2008;128:209-216. [PubMed] [DOI] |
| 5. | Gao J, Kou G, Wang H, Chen H, Li B, Lu Y, Zhang D, Wang S, Hou S, Qian W. PE38KDEL-loaded anti-HER2 nanoparticles inhibit breast tumor progression with reduced toxicity and immunogenicity. Breast Cancer Res Treat. 2009;115:29-41. [PubMed] [DOI] |
| 6. | Olivier JC. Drug transport to brain with targeted nanoparticles. NeuroRx. 2005;2:108-119. [PubMed] [DOI] |
| 8. | 陈 钟, 戴 新征. 壳聚糖及其纳米粒子在组织工程中的应用. 国际生物医学工程杂志. 2006;29:48-52. |
| 13. | Calvo P, Remuñán-López C, Vila-Jato JL, Alonso MJ. Novel hydrophilic chitosan-polyethylene oxide nanoparticles as protein carriers. J Appl Polym Sci. 1997;63:125-132. [DOI] |
| 14. | Calvo P, Remuñan-López C, Vila-Jato JL, Alonso MJ. Chitosan and chitosan/ethylene oxide-propylene oxide block copolymer nanoparticles as novel carriers for proteins and vaccines. Pharm Res. 1997;14:1431-1436. [PubMed] [DOI] |
| 15. | Ye SL. [Non-surgical therapy for hepatocellular carcinoma]. Zhonghua Ganzangbing Zazhi. 2006;14:558-560. [PubMed] |
| 16. | Moghimi SM, Hunter AC, Murray JC. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacol Rev. 2001;53:283-318. [PubMed] |
| 17. | Gao J, Kou G, Chen H, Wang H, Li B, Lu Y, Zhang D, Wang S, Hou S, Qian W. Treatment of hepatocellular carcinoma in mice with PE38KDEL type I mutant-loaded poly(lactic-co-glycolic acid) nanoparticles conjugated with humanized SM5-1 F(ab') fragments. Mol Cancer Ther. 2008;7:3399-3407. [PubMed] [DOI] |
| 19. | Wilson MW, Kerlan RK, Fidelman NA, Venook AP, LaBerge JM, Koda J, Gordon RL. Hepatocellular carcinoma: regional therapy with a magnetic targeted carrier bound to doxorubicin in a dual MR imaging/ conventional angiography suite--initial experience with four patients. Radiology. 2004;230:287-293. [PubMed] [DOI] |