修回日期: 2010-04-16
接受日期: 2010-04-20
在线出版日期: 2010-05-08
目的: 观察重型肝炎患者及肝衰竭大鼠中TLR2、TLR4和TLR9的表达, 为重型肝炎肝衰竭发病机制的研究提供思路.
方法: 免疫组织化学法检测慢性重型肝炎患者肝组织及外周血单个核细胞(PBMC)中TLR2、TLR4和TLR9表达, 同时平行设立慢性乙型肝炎、肝硬化患者和正常人作为对照. 免疫组织化学法检测急性肝衰竭、慢加急性肝衰竭及正常大鼠肝组织中TLR2、TLR4和TLR9表达. 阳性对照为大鼠结肠组织.
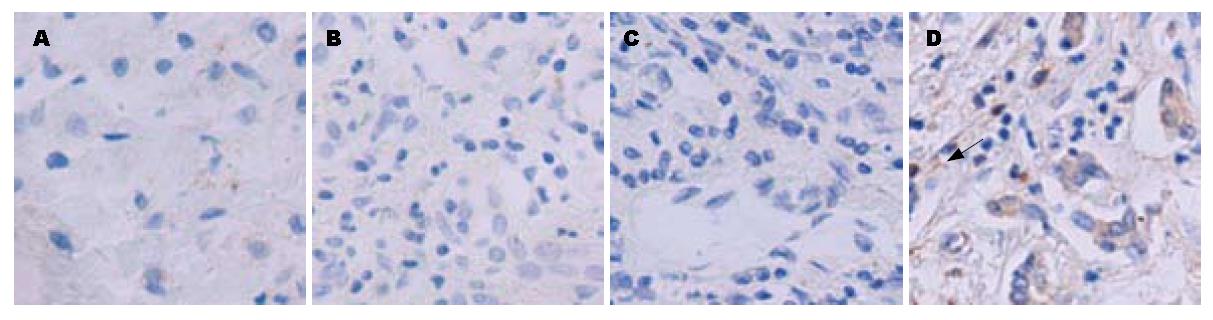
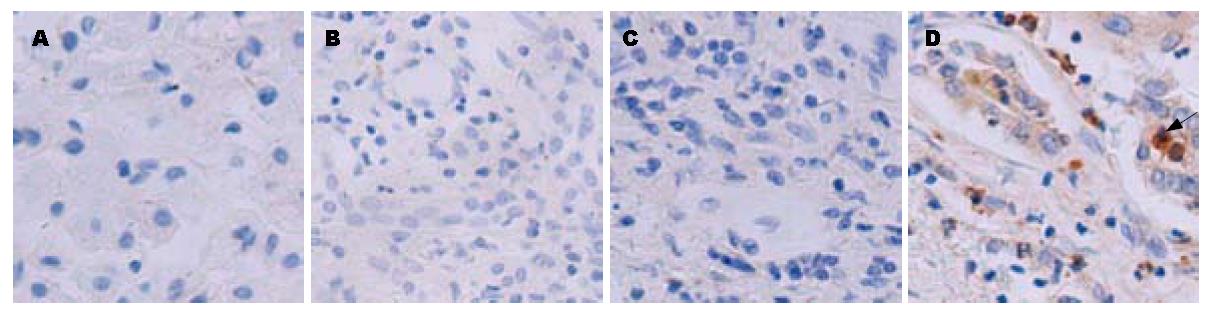
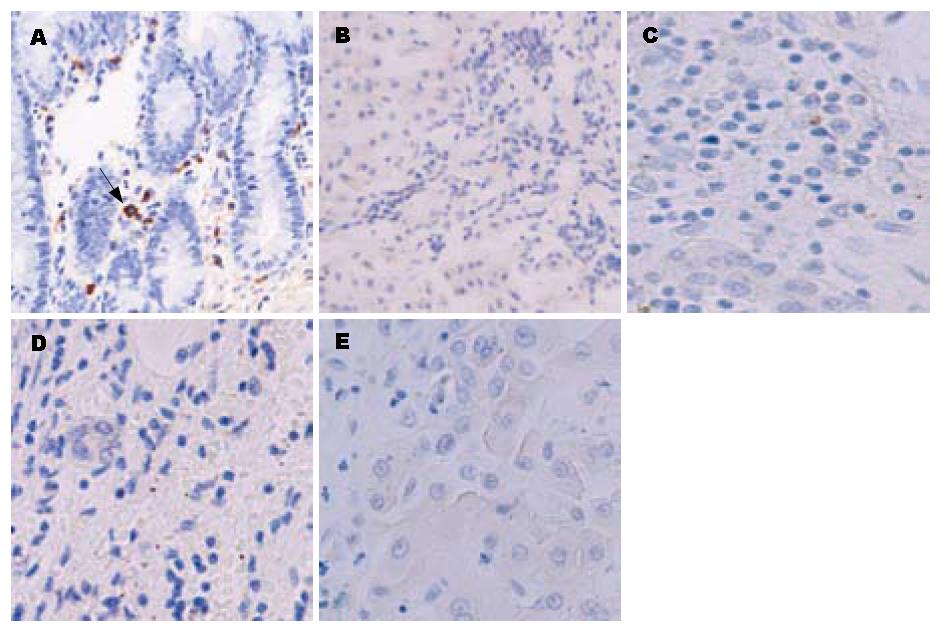
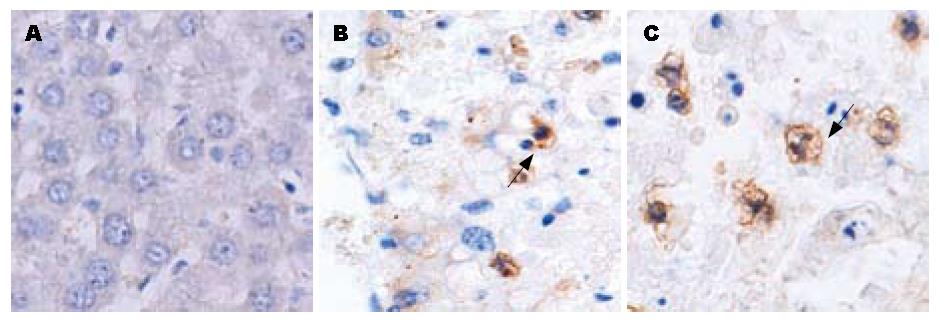
结果: 正常人、慢性乙型肝炎和肝硬化患者肝组织中TLR2和TLR9未见表达; 慢性重型肝炎患者肝组织中TLR2和TLR9有表达; 正常人及慢性乙型肝炎患者PBMC中TLR2、TLR9未见表达, 慢性重型肝炎患者PBMC中TLR2和TLR9有表达; 正常大鼠肝组织TLR2、TLR9未见表达, 急性肝衰竭和慢加急性肝衰竭大鼠肝组织中TLR2、TLR9有表达; TLR4在所有标本中均未见表达, 但在阳性对照中有表达; TLR2、TLR9的表达多见于炎性细胞中, 在肝实质细胞上表达很少.
结论: TLR2、TLR9的高表达与机体的免疫状态密切相关, 可能参与了重型肝炎和肝衰竭的发病过程.
引文著录: 陈煜, 时红波, 张帆, 丁美, 赵军, 刘旭华, 段钟平. TLR2、TLR4和TLR9在慢性重型肝炎患者及肝衰竭大鼠中的表达. 世界华人消化杂志 2010; 18(13): 1320-1325
Revised: April 16, 2010
Accepted: April 20, 2010
Published online: May 8, 2010
AIM: To explore the pathogenesis of severe hepatitis and hepatic failure by investigating the expression of Toll-like receptor 2 (TLR2), TLR4 and TLR9 in patients with chronic severe hepatitis and rats with hepatic failure.
METHODS: The expression of TLR2, TLR4 and TLR9 was detected by immunohistochemistry in liver tissue and peripheral blood mononuclear cells (PBMC) of patients with severe hepatitis, chronic hepatitis B and liver cirrhosis, and normal controls. The expression of TLR2, TLR4 and TLR9 in liver tissue of rats with acute hepatic failure and chronic-on-acute hepatic failure, and normal rats was also detected by immunohistochemistry. Rat colon tissue was used as positive controls.
RESULTS: The hepatic expression of TLR2 and TLR9 was not detected in patients with chronic hepatitis B and liver cirrhosis and normal controls, but in patients with severe hepatitis. The expression of TLR2 and TLR9 was not detected in PBMC of patients with chronic hepatitis B and normal controls, but in patients with severe hepatitis. The hepatic expression of TLR2 and TLR9 was not detected in normal rats, but in rats with acute and chronic-on-acute hepatic failure. TLR4 expression was not detected in all samples except positive controls. TLR2 and TLR9 were mainly distributed in inflammatory cells, but seldom in hepatic parenchymal cells.
CONCLUSION: The high expression of TLR2 and TLR9 is related to the body's immune function and may be associated with the development of severe hepatitis and hepatic failure.
- Citation: Chen Y, Shi HB, Zhang F, Ding M, Zhao J, Liu XH, Duan ZP. Expression of TLR2, TLR4 and TLR9 in patients with chronic severe hepatitis and rats with liver failure. Shijie Huaren Xiaohua Zazhi 2010; 18(13): 1320-1325
- URL: https://www.wjgnet.com/1009-3079/full/v18/i13/1320.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i13.1320
Toll样受体(toll-like receptors, TLRs)是近年来发现的在宿主抗病原微生物的免疫应答中起重要作用的细胞表面受体分子. 他们不仅在天然免疫应答中识别病原微生物的病原相关分子模式(pathogen-associated molecular patterns, PAMPs), 激活先天性免疫应答, 还引起细胞因子的释放, 上调共刺激分子的表达, 为获得性免疫的启动提供必要的活化信号[1-3]. 近年研究显示, TLRs在病毒性肝炎的发病机制中通过诱导TNF、IFN等的生成和调节Th1和Th2反应平衡而产生免疫刺激并发挥抗病毒作用[4-6], TLRs的过激活会导致免疫紊乱, 造成肝细胞损伤的发生[7]. 本研究通过观察慢性重型肝炎患者及肝衰竭大鼠中TLR2、TLR4和TLR9的表达, 初步探讨TLR2、TLR4和TLR9与免疫损伤的关系, 为重型肝炎肝衰竭发病机制的研究提供思路.
慢性乙型肝炎、肝硬化患者及正常人肝组织标本各5例, 慢性重型肝炎患者肝组织标本3例, 慢性乙型肝炎、慢性重型肝炎患者及正常人全血标本各10例, 所有病例均符合2000年西安会议修订的《病毒性肝炎防治方案》中的诊断标准[8], 以上标本来自首都医科大学附属北京佑安医院人工肝中心. 所有标本采取前均与患者签署知情同意书, 并得到医院伦理委员会批准. TLR2多克隆抗体购于Santa Cruz BioTechnology公司, TLR4和TLR9单克隆抗体购于Imgenex公司. 淋巴细胞分离液购于天津灏洋生物制品有限公司. HRP标记的羊抗鼠IgG、生物素标记的兔抗羊IgG和HRP标记的生物素化抗体购于北京中杉金桥生物有限公司. 雌性Wistar大鼠12只, 清洁级, 体质量280-330 g, 购自首都医科大学实验动物中心. 人血白蛋白购自兰州生物制品所, D-氨基半乳糖盐酸盐购自江苏省启东市久丰工贸有限公司, 脂多糖购自美国Sigma公司. 其余为国产试剂分析纯.
1.2.1 大鼠肝衰竭模型的建立: 取♀Wistar大鼠12只, 随机分为3组, 每组4只. (1)大鼠急性肝衰竭模型组: 给予D-氨基半乳糖盐酸盐400 mg/kg和脂多糖100 μg/kg同时腹腔注射, 构建大鼠急性肝衰竭模型; (2)大鼠慢加急性肝衰竭模型组: 给予人血白蛋白每只2.5 mg尾静脉注射, 每周2次, 连续8 wk后给予D-氨基半乳糖400 mg/kg和脂多糖100 μg/kg同时腹腔注射, 构建大鼠慢加急性肝衰竭模型; (3)正常对照组: 常规喂养. 详细建模方法见参考文献[9].
1.2.2 肝组织免疫组织化学: 常规方法烤片40 min, 用二甲苯及乙醇脱蜡处理; 盐酸甲醇处理15 min, PBS洗片3次, 枸橼酸缓冲液微波修复5 min; PBS洗片后, 用羊血清工作液封闭30 min; 分别加入TLR2、TLR4、TLR9抗体37 ℃孵育1 h; PBS洗片后, 加入TLR4、TLR9抗体的组织片中加入HRP标记的羊抗鼠IgG, 加入TLR2抗体的组织片中加入生物素标记的兔抗羊IgG, 37 ℃孵育30 min; PBS洗片后, 加入TLR4、TLR9抗体的组织片加入DAB显色, 加入TLR2抗体的组织片加入HRP标记的生物素化抗体, 37 ℃孵育30 min; PBS洗片后, 加入TLR2抗体的组织片加入DAB显色; 苏木精复染, 组织透明, 树胶封片. 取正常大鼠结肠组织作为阳性对照.
1.2.3 外周血单个核细胞提取及免疫组织化学: 将抗凝血标本2 000 r/min离心, 吸取血浆, 加入等体积生理盐水; 将生理盐水混合液缓慢加入到淋巴细胞分离液的上层; 2 000 r/min离心30 min, 吸取淋巴细胞液层, 加入生理盐水清洗, 1 500 r/min离心10 min; 弃上清, 再加入10 mL生理盐水清洗1次, 细胞计数2×107; 取适量浓度的细胞悬液涂布于多聚赖氨酸处理过的载玻片上, 室温自然干燥, 浓甲醛熏蒸固定2 h; 固定的载玻片用酸甲醛处理10 min, PBS洗片后, 其余步骤与肝组织免疫组织化学相同.
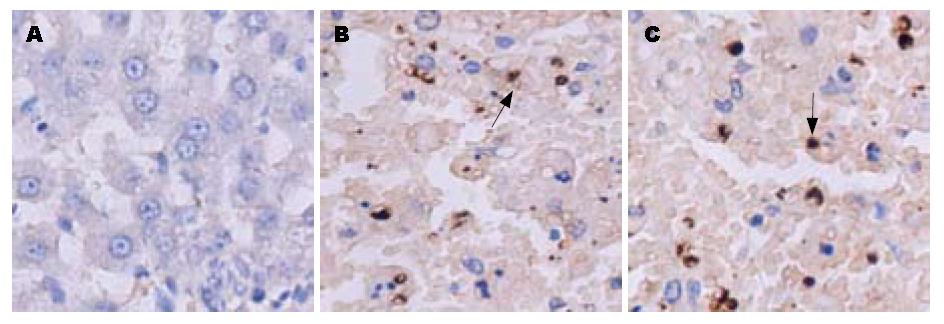
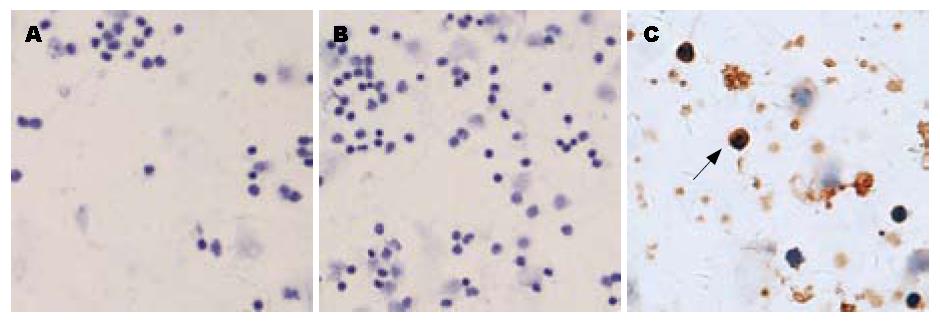
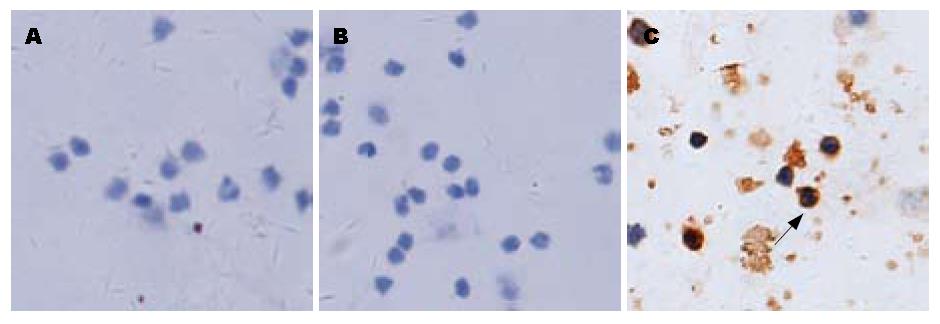
正常人、慢性乙型肝炎和肝硬化患者肝组织中TLR2和TLR9未见表达; 慢性重型肝炎患者肝组织中TLR2和TLR9有表达; TLR4在正常人及患者肝组织中均未见表达, 但在阳性对照中有表达. TLR2、TLR9的表达多见于炎性细胞中, 在肝实质细胞上表达很少(图1, 图2, 图3).
正常大鼠肝组织TLR2、TLR9未见表达, 急性肝衰竭、慢加急性肝衰竭大鼠肝组织中TLR2、TLR9有表达; TLR4在肝衰竭大鼠肝组织未见表达, 但在阳性对照中有表达. TLR2、TLR9的表达多见于炎性细胞中, 在肝实质细胞上表达很少(图4, 图5).
TLRs广泛分布于各种组织中, 其表达与天然配体的刺激有关. TLR1、TLR2及TLR6能识别多种PAMPs, 包括细菌胞壁酸、肽聚糖和LPS[10]; TLR3识别病毒双链RNA[11]; TLR4可识别LPS[12]; TLR5识别细菌鞭毛蛋白[10]; TLR7、TLR8识别病毒的单链RNA[13,14]; TLR9识别细菌胞嘧啶-腺嘌呤(CpG)DNA[15]. 肝脏中的TLRs通过门静脉能够接触到大量病原体成分, 通过信号转导广泛参与肝脏的生理病理过程. 近几年来, TLRs在肝脏疾病, 如病毒性肝炎、肝硬化及酒精性肝病中的作用正被逐步揭示出来[16-23]. Isogawa等[16]研究发现, 活化的TLR3、TLR4、TLR5、TLR7、TLR9能够于24 h内通过IFN-α/β依赖途径抑制HBV的复制. Manigold等[17]发现TLR2在高内毒素血症的肝硬化患者PBMC中表达上调, 而TLR4在Child-Pugh分级为A的肝硬化患者PBMC中表达下调, 提示TLRs可能参与了肝硬化的发展过程.
本研究发现, 慢性乙型肝炎和肝硬化患者TLR2、TLR9未见表达, 慢性重型肝炎患者和肝衰竭大鼠TLR2和TLR9有表达, TLR4在所有标本中均未见表达, 但在阳性对照中有表达. 慢性乙型肝炎和肝硬化患者, 特别是非活动性慢性乙型肝炎和代偿期肝硬化患者, 病情比较稳定, 很少伴有细菌感染, 因此体内TLRs未被激活,免疫损伤相对较轻; 慢性重型肝炎患者多由慢性肝炎进展而来, 病情反复发作, 常伴有细菌感染, 在激活TLRs的同时也造成一定程度的免疫损伤. 由于肝衰竭患者的肝组织不易获得, 因此构建了大鼠肝衰竭模型. 肝衰竭大鼠与重型肝炎患者肝组织中TLR2和TLR9的表达趋势是一致的, 提示可以用大鼠肝衰竭模型模拟重型肝炎患者体内TLRs的表达情况. 有报道TLR4在慢性乙型肝炎和慢性重型肝炎患者中表达增加[24], 在急性肝衰竭大鼠中表达增加[25], 而本研究中TLR4在慢性乙型肝炎和慢性重型肝炎患者及肝衰竭大鼠中均未见表达, 分析可能与所选病例的病程不同有关. 也有可能与TLR4的天然配体LPS有关, Nomura等认为存在LPS耐受机制, 即暴露于LPS的单核巨噬细胞表面表达的TLR4下调[26-28], 有关重型肝炎患者体内TLR4的表达还需要进一步研究.
本研究发现, 在慢性乙型肝炎、肝硬化、重型肝炎肝组织中, TLR2、TLR9的表达多见于炎性细胞中, 在肝实质细胞上表达很少, 这与其他学者报道基本一致[29,30]. TLRs在各类免疫细胞中广泛表达, 如单核/巨噬细胞、B细胞、T细胞及树突状细胞都表达TLRs, 在肠道及呼吸道等经常与细菌接触的上皮细胞上, 往往也有TLRs的表达, 而在肝实质细胞中表达很少. 据此推测, TLRs的表达在肝脏疾病的发生及其所致的肝细胞损伤中所起的作用, 可能主要是通过识别受体而激活免疫应答损伤肝细胞, 由于受体识别而直接产生肝细胞损伤相对较少. 因此, 深入研究TLRs与免疫损伤的关系, 将对重型肝炎肝衰竭发病机制的研究具有非常重要的意义.
Toll样受体(TLRs)是近年来发现的在宿主抗病原微生物的免疫应答中起重要作用的细胞表面受体分子. 他们不仅在天然免疫应答中识别病原微生物的病原相关分子模式(PAMPs), 激活先天性免疫应答, 还引起细胞因子的释放, 上调共刺激分子的表达, 为获得性免疫的启动提供必要的活化信号. 肝脏中的TLRs通过门静脉能够接触到大量病原体成分, 通过信号转导广泛参与肝脏的生理病理过程.
孙殿兴, 主任医师, 白求恩国际和平医院肝病科.
近几年来, TLRs在肝脏疾病, 如肝移植、病毒性肝炎和肝硬化中的作用正被逐步揭示出来, 有关TLRs在重型肝炎肝衰竭方面的研究还不多.
Manigold等发现TLR2在高内毒素血症的肝硬化患者PBMC中表达上调, 而TLR4在Child-Pugh分级为A的肝硬化患者PBMC中表达下调, 提示TLRs可能参与了肝硬化的发展过程.
重症肝炎是肝病领域研究的热点, 本研究应用免疫组织化学法观察了慢性重型肝炎患者及肝衰竭大鼠肝组织及外周血单个核细胞中TLR2、TLR4和TLR9的表达, 分析探讨了TLR2、TLR4和TLR9与免疫损伤的关系, 为重型肝炎肝衰竭发病机制的研究提供了一些新思路.
TLR2、TLR9的高表达与机体的免疫状态密切相关, 可能参与了重型肝炎和肝衰竭的发病过程.
本研究内容重要, 提供了一些有用的新信息, 创新性强.
编辑: 李军亮 电编: 吴鹏朕
| 3. | Janeway CA, Medzhitov R. Innate immune recognition. Annu Rev Immunol. 2002;20:197-216. [PubMed] [DOI] |
| 6. | Dabbagh K, Lewis DB. Toll-like receptors and T-helper-1/T-helper-2 responses. Curr Opin Infect Dis. 2003;16:199-204. [PubMed] [DOI] |
| 7. | Zhai Y, Shen XD, O'Connell R, Gao F, Lassman C, Busuttil RW, Cheng G, Kupiec-Weglinski JW. Cutting edge: TLR4 activation mediates liver ischemia/reperfusion inflammatory response via IFN regulatory factor 3-dependent MyD88-independent pathway. J Immunol. 2004;173:7115-7119. [PubMed] [DOI] |
| 9. | 刘 旭华, 陈 煜, 王 泰龄, 闾 军, 张 立洁, 宋 晨朝, 张 晶, 段 钟平. 人血白蛋白及D-氨基半乳糖、脂多糖联合诱导建立大鼠慢加急性肝衰竭模型. 中华肝脏病杂志. 2007;15:771-775. |
| 10. | Werts C, Tapping RI, Mathison JC, Chuang TH, Kravchenko V, Saint Girons I, Haake DA, Godowski PJ, Hayashi F, Ozinsky A. Leptospiral lipopolysaccharide activates cells through a TLR2-dependent mechanism. Nat Immunol. 2001;2:346-352. [PubMed] [DOI] |
| 11. | Matsumoto M, Funami K, Oshiumi H, Seya T. Toll-like receptor 3: a link between toll-like receptor, interferon and viruses. Microbiol Immunol. 2004;48:147-154. [PubMed] [DOI] |
| 12. | Finberg RW, Kurt-Jones EA. Viruses and Toll-like receptors. Microbes Infect. 2004;6:1356-1360. [PubMed] [DOI] |
| 13. | 王 景锋, 邵 军军, 常 惠芸, 高 闪电, 李 菁. 病毒固有免疫识别受体研究进展. 细胞与分子免疫学杂志. 2009;25:1217-1220. |
| 14. | Lund JM, Alexopoulou L, Sato A, Karow M, Adams NC, Gale NW, Iwasaki A, Flavell RA. Recognition of single-stranded RNA viruses by Toll-like receptor 7. Proc Natl Acad Sci U S A. 2004;101:5598-5603. [PubMed] [DOI] |
| 15. | Kanzler H, Barrat FJ, Hessel EM, Coffman RL. Therapeutic targeting of innate immunity with Toll-like receptor agonists and antagonists. Nat Med. 2007;13:552-559. [PubMed] [DOI] |
| 16. | Isogawa M, Robek MD, Furuichi Y, Chisari FV. Toll-like receptor signaling inhibits hepatitis B virus replication in vivo. J Virol. 2005;79:7269-7272. [PubMed] [DOI] |
| 17. | Manigold T, Böcker U, Hanck C, Gundt J, Traber P, Antoni C, Rossol S. Differential expression of toll-like receptors 2 and 4 in patients with liver cirrhosis. Eur J Gastroenterol Hepatol. 2003;15:275-282. [PubMed] [DOI] |
| 18. | Chen Z, Cheng Y, Xu Y, Liao J, Zhang X, Hu Y, Zhang Q, Wang J, Zhang Z, Shen F. Expression profiles and function of Toll-like receptors 2 and 4 in peripheral blood mononuclear cells of chronic hepatitis B patients. Clin Immunol. 2008;128:400-408. [PubMed] [DOI] |
| 19. | 苟 艳子, 连 建奇, 聂 青和, 庄 严, 刘 清泉, 邵 彬. 肝硬化患者外周血单核细胞表面TLR2和TLR4表达的临床意义. 世界华人消化杂志. 2006;14:3278-3283. [DOI] |
| 21. | Uesugi T, Froh M, Arteel GE, Bradford BU, Thurman RG. Toll-like receptor 4 is involved in the mechanism of early alcohol-induced liver injury in mice. Hepatology. 2001;34:101-108. [PubMed] [DOI] |
| 23. | 晏 春根, 谢 青. Toll样受体与炎症应答. 国外医学·流行病学与传染病学分册. 2003;30:159-162. |
| 24. | Wei XQ, Wen ZF, Zheng FP, Yao JL. [Changes of Toll-like receptor (TLR) 2 and TLR4 on the peripheral blood mononuclear cells in patients with chronic hepatitis B and chronic severe hepatitis B]. Zhonghua Ganzangbing Zazhi. 2007;15:354-357. [PubMed] |
| 25. | 姚 景宏, 贺 永文. TLR4在急性肝衰竭模型大鼠中的动态变化及意义. 中国组织化学与细胞化学杂志. 2007;16:164-167. |
| 26. | Nomura F, Akashi S, Sakao Y, Sato S, Kawai T, Matsumoto M, Nakanishi K, Kimoto M, Miyake K, Takeda K. Cutting edge: endotoxin tolerance in mouse peritoneal macrophages correlates with down-regulation of surface toll-like receptor 4 expression. J Immunol. 2000;164:3476-3479. [PubMed] [DOI] |
| 27. | Jiang W, Sun R, Wei H, Tian Z. Toll-like receptor 3 ligand attenuates LPS-induced liver injury by down-regulation of toll-like receptor 4 expression on macrophages. Proc Natl Acad Sci U S A. 2005;102:17077-17082. [PubMed] [DOI] |
| 29. | Wang AP, Migita K, Ito M, Takii Y, Daikoku M, Yokoyama T, Komori A, Nakamura M, Yatsuhashi H, Ishibashi H. Hepatic expression of toll-like receptor 4 in primary biliary cirrhosis. J Autoimmun. 2005;25:85-91. [PubMed] [DOI] |
| 30. | Asahina Y, Yoshioka N, Kano R, Moritomo T, Hasegawa A. Full-length cDNA cloning of Toll-like receptor 4 in dogs and cats. Vet Immunol Immunopathol. 2003;96:159-167. [PubMed] [DOI] |