修回日期: 2010-03-19
接受日期: 2010-03-23
在线出版日期: 2010-04-28
目的: 研究p53正向细胞凋亡调控因子(PUMA)基因的四种剪接体(PUMA-α, -β, -γ及-δ)在胃癌组织及细胞中的表达特点.
方法: 应用生物信息学分析PUMA基因四种剪接体的结构特点; 同时利用半定量逆转录聚合酶链反应(RT-PCR)检测胃癌组织、癌旁组织及不同胃癌细胞系BGC-823和SGC-7901细胞中四种剪接体的mRNA表达水平.
结果: PUMA-α和-β在癌旁组织中表达阳性, 但在癌组织中表达难以检测, 差异显著(t = 9.492, 15.875, 均P<0.05); PUMA-γ和-δ在癌旁及癌组织中均可见表达, 且在癌旁组织中的表达量显著高于癌组织(t = 4.823, 4.056, P<0.05). PUMA-α, -γ及-δ在胃癌不同分化程度的细胞系BGC-823(低分化)及SGC-7901(中分化)中均有表达, 但两细胞系间无统计学差异. 而PUMA-β在BGC-823中的表达明显高于SGC-7901细胞(t = 8.710, P<0.05).
结论: PUMA四种剪接体在胃癌组织中的表达下调, 与癌的发生呈负相关; PUMA-β的表达还可能与细胞的分化程度有关.
引文著录: 陈鑫, 张尤历, 乌慧玲, 孔梅, 邵长江, 宋永站. PUMA基因在胃癌组织及细胞中的表达. 世界华人消化杂志 2010; 18(12): 1227-1231
Revised: March 19, 2010
Accepted: March 23, 2010
Published online: April 28, 2010
AIM: To investigate the expression of four mRNA isoforms of the p53 up-regulated modulator of apoptosis (PUMA) gene in gastric cancer tissue and cell lines.
METHODS: The open reading frames of four mRNA isoforms of the PUMA gene were analyzed by bioinformatics method. The expression of these four mRNA isoforms in gastric cancer tissue, normal tissue and two gastric cancer cell lines were detected by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: PUMA-α and -β were positively expressed in normal tissue, but hardly detected in cancer tissue (t = 9.492 and 15.875, respectively; both P < 0.05). PUMA-γ and -δ were expressed both in cancer tissue and normal tissue, and their expression levels were significantly higher in tumor-adjacent tissue than in cancer tissue (t = 4.823 and 4.056, respectively; both P < 0.05). The expression of the four PUMA isoforms was detected in the two gastric cancer cell lines. The expression level of PUMA-β was significantly higher in low-differentiated BGC-823 cells than in moderately differentiated SGC-7901 cells (t = 8.710, P < 0.05).
CONCLUSION: The expression of PUMA isoforms is down-regulated in gastric cancer tissue and may be negatively correlated with the pathogenesis of gastric cancer. The expression of PUMA-β may be involved in gastric cancer cell differentiation.
- Citation: Chen X, Zhang YL, Wu HL, Kong M, Shao CJ, Song YZ. Expression of the PUMA gene in gastric cancer tissue and cell lines. Shijie Huaren Xiaohua Zazhi 2010; 18(12): 1227-1231
- URL: https://www.wjgnet.com/1009-3079/full/v18/i12/1227.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i12.1227
p53正向细胞凋亡调控因子(p53 up-regulated modulator of apoptosis, PUMA)基因[1,2]是首先在结肠癌细胞中发现的具有强大促凋亡作用的Bcl-2家族BH3-only亚家族中的一员. 该基因具有4个外显子(1a或1b, 2, 3, 4)和三个内含子, 转录后形成四种不同的剪接体(PUMA-α, -β, -γ及-δ). 研究发现PUMA-α和-β编码的蛋白中含有PUMA促凋亡活性所必需的BH3功能结构域, 而PUMA-γ和-δ编码的蛋白中缺乏该结构域[1-3]. PUMA的促凋亡活性不仅取决于BH3结构域, 也取决于C末端的线粒体定位序列[4]. PUMA各剪接体之间的表达关系目前尚不清楚. 胃癌是一种常见的恶性肿瘤, 据全球肿瘤发病和癌症死亡率的第2位[5]. 在我国, 其发病率高据各类肿瘤之首. 胃癌的发生是一个多基因多步骤渐进的过程. 胃癌细胞的某些基因表达与细胞凋亡状况有关. 目前国内外对于PUMA基因剪接体对胃癌的形成作用研究相对较少. 本实验主要研究PUMA基因的四种剪接体在胃癌组织及细胞中的表达特点, 为进一步研究其作用机制打下实验基础.
PUMA四种剪接体核酸序列来源于NCBI已注册的基因序列(登录号: NM_001127240). 试验所需要的胃癌及相对应的癌旁组织均来自于江苏大学附属医院, 病理诊断均为腺癌. 试验样本是在肿瘤组织脱离患者后立即取材, 置于液氮中冷藏. 胃癌细胞系BGC-823和SGC-7901细胞由本实验室保存. DMEM培养液为Gibco公司产品, 小牛血清为兰州民海生物工程有限公司产品, 逆转录试剂盒购自Fermantance公司.
1.2.1 PUMA四种剪接体生物信息学分析: 采用http://www.ncbi.nlm.nih.gov/及DNAstar软件对PUMA四种剪接体进行生物信息学分析.
1.2.2 细胞培养: 人胃癌细胞系BGC-823及SGC-7901细胞采用DMEM培养液(含10%的小牛血清), 在CO2培养箱中进行常规培养, 隔天换液, 细胞传代时用0.25%胰蛋白酶消化细胞.
1.2.3 胃癌组织总RNA的提取: 在用液氮预冷的研钵中加入适量的样品, 加液氮研磨, 磨成均匀的粉末, 加入1 mL的TRIzol混匀, 转移至灭菌的Eppendorf管中; 加入0.2 mL氯仿, 剧烈摇匀, 静置2-3 min; 12 000 r/min, 15 min, 4 ℃离心; 吸取上层无色水至另一Eppendorf管; 加入等量异丙酚, 颠倒混匀, 静置10 min; 12 000 r/min, 15 min, 4 ℃离心, 弃上清. 加入750 mL/L乙醇洗涤, 12 000 r/min, 5 min, 4 ℃离心; 弃上清, 加入无水乙醇, 颠倒混匀, 12 000 r/min, 5 min, 4 ℃离心; 弃上清, 沉淀5-10 min. 加入DEPC处理水, 混匀, 测吸光度(A)值待用.
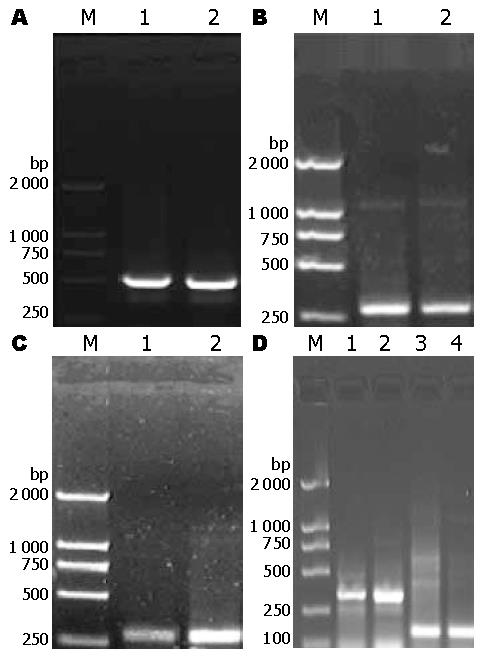
1.2.4 RT-PCR检测相关基因: 按照逆转录试剂盒说明书将组织及细胞的总RNA逆转录成cDNA, 以β-actin为内参照行PCR反应. PUMA基因4种不同剪接体的引物序列见表1. 反应条件为: 95 ℃ 5 min, 95 ℃ 40 s, 61 ℃-71 ℃ 40 s, 72 ℃ 45 s, 40个循环, 72 ℃ 10 min. 产物于2%琼脂凝胶电泳, 以凝胶成像系统分析结果, 计算各目的条带与内参条带吸光度比值, 以其表示各组mRNA含量的相对强度.
| 剪接体 | 全长(bp) | 引物序列 | 片段大小(bp) |
| PUMA-α | 582 | 上游 5' CGGACGGTCCTCAGCCCTCGCTCT 3' | 268 |
| 下游 5'AGGAGTCCCATGATGAGATTGTACA 3' | |||
| PUMA-β | 396 | 上游 5' TGCCAGATTTGTGGTCCTCAGCCCT 3' | 275 |
| 下游 5'AGGAGTCCCATGATGAGATTGTACA 3' | |||
| PUMA-γ | 786 | 上游 5' CGGACGGTCCTCAGCCCTCGCTCT 3' | 335 |
| 下游 5' CCACCGGGCGGGTGCAGGCACCTAAT 3' | |||
| PUMA-δ | 306 | 上游 5' GCCAGATTTGTGAGACAAGAGGAGC 3' | 150 |
| 下游 5' CCACCGGGCGGGTGCAGGCACCTAAT 3' |
统计学处理 应用SPSS13.0统计软件, 采用成组资料t检验, 以P<0.05为差异有显著性.
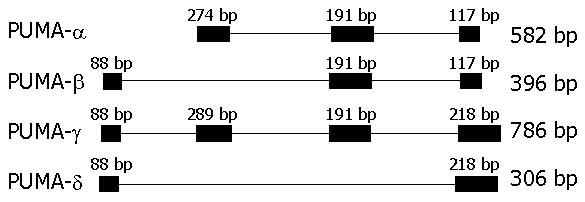
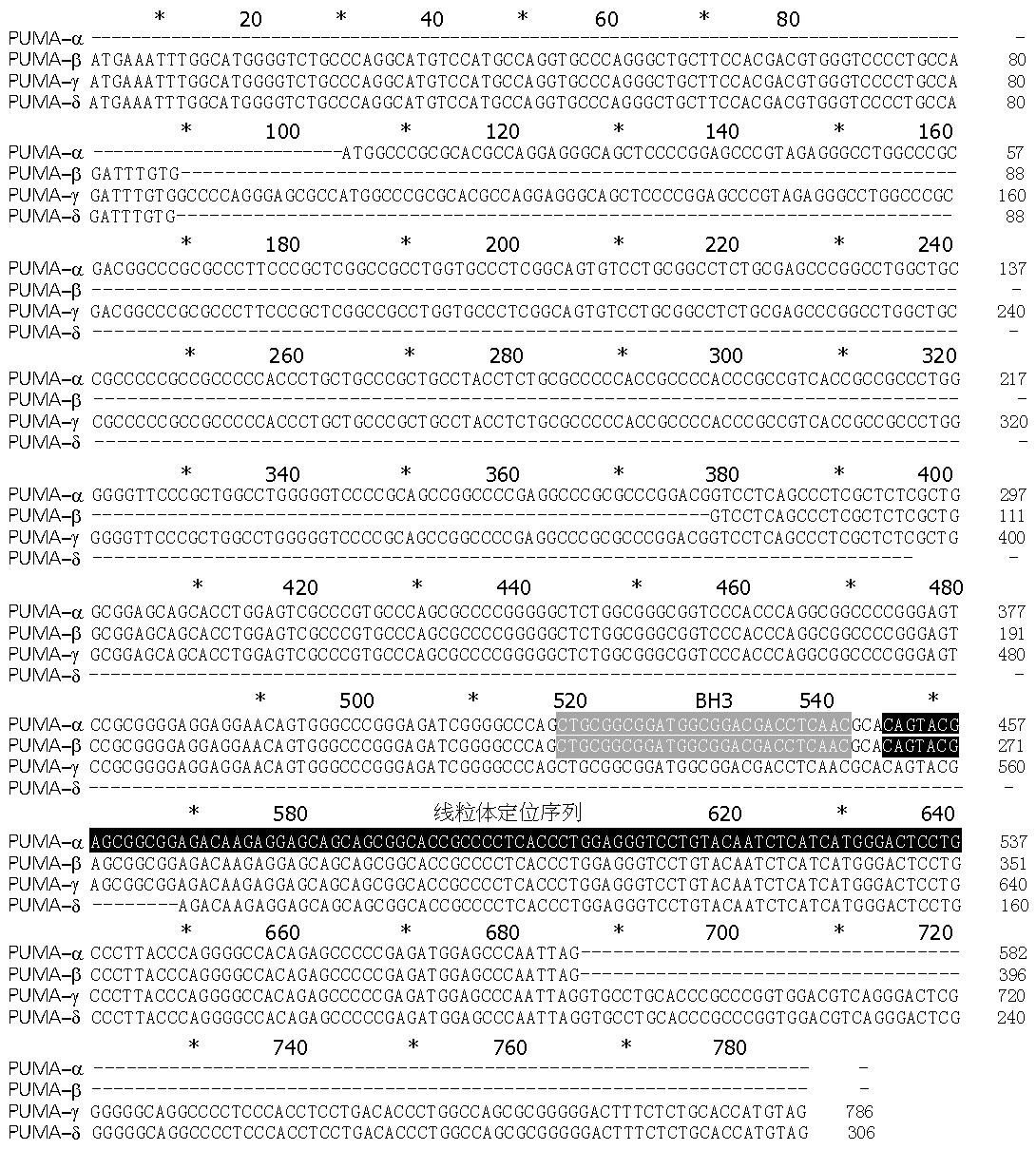
PUMA-α ORF(open reading frame)为582 bp, 含外显子2, 3和4; -β的ORF为396 bp, 含外显子1, 3和4; -γ的ORF为786 bp, 含外显子1, 2, 3和4; -δ的ORF为306 bp, 只含有外显子1和4. 且PUMA-γ比-α的2号外显子多15 bp; -γ, -δ含有的外显子4比-α和-β长101 bp(图1, 图2).
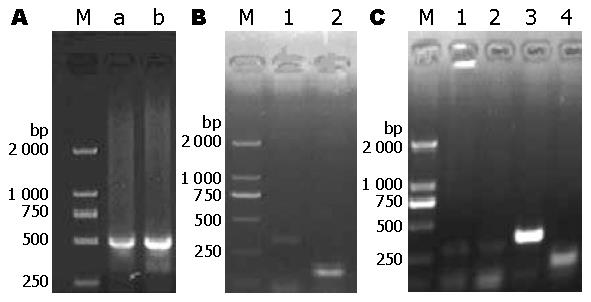
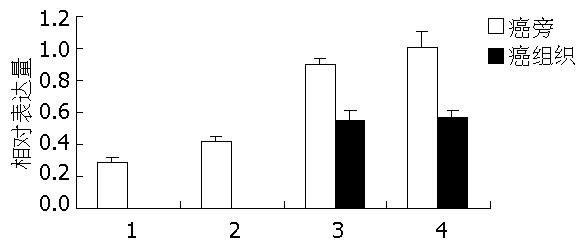
PUMA-α, -β在癌旁组织中表达阳性, 但在胃癌组织中表达难以检测到(t = 9.492, 15.875, P<0.05); -γ, -δ在癌旁及癌组织中均有表达, 并且在癌旁组织中表达量显著高于胃癌组织(t = 4.823, 4.056, P<0.05, 图3, 图4).
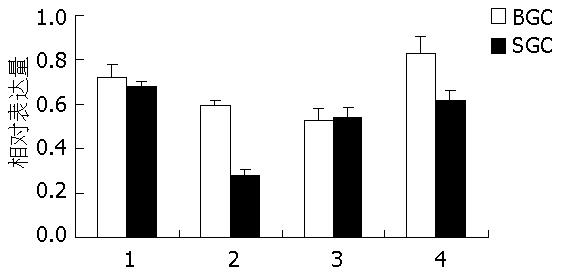
PUMA四种剪接体在胃癌不同分化程度的细胞系BGC-823和SGC-7901细胞中均有表达, 且PUMA-β在低分化的BGC-823细胞中表达量明显高于中分化的SGC-7901细胞(t = 8.710, P<0.05, 图5, 图6).
p53作为转录调控子, 在与特异的DNA序列(p53结合位点)结合后, 促使其转录. 很多重要的与细胞周期以及细胞凋亡相关的基因都能被p53调控. PUMA基因作为p53下游靶基因, 是p53诱导凋亡途径中的关键介导者. PUMA[3]上游启动子序列中含有p53结合位点, 受到凋亡信号刺激后, p53可以直接与其靶位点结合, 从而促进PUMA基因的转录及其蛋白的表达. 多个试验证实转染外源性的p53基因或由γ射线照射、DNA损伤药物、缺氧和NO等引起内源性p53表达上调引发的促细胞凋亡作用是通过上调PUMA介导的[2-4,6-8]. p53突变型和p53缺失的细胞在受到损伤后没有发现PUMA的上调, 也不发生细胞凋亡; 而在突变或缺失p53的细胞中转入野生型p53会恢复对PUMA的上调作用并促进细胞凋亡[7,9]. 但PUMA又有别于其他p53靶基因, 他也可以由非p53依赖途径诱导细胞凋亡, 例如糖皮质激素[10], E2F1转录因子[11], JUN氨基端激酶[12]等都可以激活PUMA的表达.
本研究发现PUMA四种剪接体在胃癌癌旁组织中均有表达, 而在胃癌组织中PUMA-α, -β表达却难以检测到, -γ, -δ与癌旁组织相比表达下调, 差异有统计学意义. 张克君等[13]发现PUMA在胰腺癌组织中阳性率低于正常胰腺组织, 我们的结论与此观点相似. 分析PUMA-α, -β, -γ及-δ在胃癌组织中表达下调可能是由于一方面p53在肿瘤组织中发生了突变, 从而导致其下游的靶基因(如PUMA)表达缺失或活性减弱; Tannapfel等[14]及Sud等[15]研究发现胃癌组织中存在p53基因突变. 这也就证实了试验中发现胃癌组织中PUMA四种剪接体表达下调, 与肿瘤的发生呈负相关. 另一方面PUMA具有促凋亡作用, PUMA表达高则加快细胞凋亡, 表达低则减缓细胞凋亡[16,17]. PUMA-α, -β具有明确的促凋亡作用, 其在胃癌组织中的表达难以检测到可能与肿瘤的生成有一定关系. 有研究报道[1,2]-γ, -δ编码的蛋白缺乏BH3结构域, 因此其可能不具有强大的促凋亡作用. 但PUMA的促凋亡作用不仅与BH3结构域有关, 还取决于C末端的线粒体定位序列. 并且在实验中发现-γ, -δ在癌旁及癌组织中mRNA的表达水平有统计学差异, 所以-γ, -δ可能也具有一定的促凋亡作用, 或者-γ, -δ对-α和-β有调节作用. 但其具体的作用机制还有待进一步研究.
PUMA-β在胃癌不同分化程度细胞系BGC-823(低分化)和SGC-7901(中分化)细胞中表达存在统计学差异, 而其他剪接体在这两种细胞系中表达无统计学意义.王培新等[18]以p53 cDNA为探针, 用Southern印迹法对人胃癌细胞系BGC-823进行了检测, 发现该细胞系中p53存在突变. 张青云等[19]发现SGC-7901细胞属于p53突变型. 由此可见在这两种胃癌细胞系均存在p53突变. PUMA-α, -γ及-δ在这两种细胞系间表达无统计学差异可能与此相关. 而-β在两种细胞系间表达存在差异, 提示PUMA-β的表达可能与细胞的分化程度有关, 其进一步关系还有待深入研究.
PUMA基因是首先在结肠癌细胞中发现的具有强大的促凋亡作用的Bcl-2家族BH3-only亚家族中的一员. 该基因转录后形成四种不同的剪接体(PUMA-α, -β, -γ及-δ).目前国内外对于PUMA基因剪接体对胃癌的形成作用研究相对较少.
汪思应, 教授, 安徽医科大学实验动物中心
近年PUMA基因的诱导凋亡作用与肿瘤的相关性研究成为热点.
张克君等发现PUMA在胰腺癌组织中阳性率低于正常胰腺组织.
本研究首次研究了PUMA基因四种剪接体在胃癌组织及细胞中的表达特点,发现PUMA剪接体与癌的发生可能成负相关,同时PUMA-β还可能与细胞分化程度有关.
本研究为PUMA成为肿瘤基因治疗打下了理论基础.
本文研究目的明确, 设计合理, 结果处理可信, 有待进一步研究.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Yu J, Zhang L, Hwang PM, Kinzler KW, Vogelstein B. PUMA induces the rapid apoptosis of colorectal cancer cells. Mol Cell. 2001;7:673-682. [PubMed] [DOI] |
| 2. | Nakano K, Vousden KH. PUMA, a novel proapoptotic gene, is induced by p53. Mol Cell. 2001;7:683-694. [PubMed] [DOI] |
| 3. | Han J, Flemington C, Houghton AB, Gu Z, Zambetti GP, Lutz RJ, Zhu L, Chittenden T. Expression of bbc3, a pro-apoptotic BH3-only gene, is regulated by diverse cell death and survival signals. Proc Natl Acad Sci U S A. 2001;98:11318-11323. [PubMed] [DOI] |
| 4. | Yu J, Zhang L. No PUMA, no death: implications for p53-dependent apoptosis. Cancer Cell. 2003;4:248-249. [PubMed] [DOI] |
| 5. | Shah MA, Schwartz GK. Treatment of metastatic esophagus and gastric cancer. Semin Oncol. 2004;31:574-587. [PubMed] [DOI] |
| 6. | Yu J, Wang Z, Kinzler KW, Vogelstein B, Zhang L. PUMA mediates the apoptotic response to p53 in colorectal cancer cells. Proc Natl Acad Sci U S A. 2003;100:1931-1936. [PubMed] [DOI] |
| 7. | Jeffers JR, Parganas E, Lee Y, Yang C, Wang J, Brennan J, MacLean KH, Han J, Chittenden T, Ihle JN. Puma is an essential mediator of p53-dependent and -independent apoptotic pathways. Cancer Cell. 2003;4:321-328. [PubMed] [DOI] |
| 8. | Li CQ, Robles AI, Hanigan CL, Hofseth LJ, Trudel LJ, Harris CC, Wogan GN. Apoptotic signaling pathways induced by nitric oxide in human lymphoblastoid cells expressing wild-type or mutant p53. Cancer Res. 2004;64:3022-3029. [PubMed] [DOI] |
| 9. | Shinagawa Y, Kawamata H, Omotehara F, Nakashiro K, Hoque MO, Furihata T, Horiuchi H, Imai Y, Fujimori T, Fujibayashi T. Evaluation of the chemosensitivity of head and neck cancer cells based on the diverse function of mutated-p53. Int J Oncol. 2003;22:383-389. [PubMed] [DOI] |
| 10. | Villunger A, Michalak EM, Coultas L, Müllauer F, Böck G, Ausserlechner MJ, Adams JM, Strasser A. p53- and drug-induced apoptotic responses mediated by BH3-only proteins puma and noxa. Science. 2003;302:1036-1038. [PubMed] [DOI] |
| 11. | Hershko T, Ginsberg D. Up-regulation of Bcl-2 homology 3 (BH3)-only proteins by E2F1 mediates apoptosis. J Biol Chem. 2004;279:8627-8634. [PubMed] [DOI] |
| 12. | Wong HK, Fricker M, Wyttenbach A, Villunger A, Michalak EM, Strasser A, Tolkovsky AM. Mutually exclusive subsets of BH3-only proteins are activated by the p53 and c-Jun N-terminal kinase/c-Jun signaling pathways during cortical neuron apoptosis induced by arsenite. Mol Cell Biol. 2005;25:8732-8747. [PubMed] [DOI] |
| 14. | Tannapfel A, Schmelzer S, Benicke M, Klimpfinger M, Kohlhaw K, Mössner J, Engeland K, Wittekind C. Expression of the p53 homologues p63 and p73 in multiple simultaneous gastric cancer. J Pathol. 2001;195:163-170. [PubMed] [DOI] |
| 15. | Sud R, Wells D, Talbot IC, Delhanty JD. Genetic alterations in gastric cancers from British patients. Cancer Genet Cytogenet. 2001;126:111-119. [PubMed] [DOI] |
| 16. | Hemann MT, Zilfou JT, Zhao Z, Burgess DJ, Hannon GJ, Lowe SW. Suppression of tumorigenesis by the p53 target PUMA. Proc Natl Acad Sci U S A. 2004;101:9333-9338. [PubMed] [DOI] |