修回日期: 2010-03-12
接受日期: 2010-03-23
在线出版日期: 2010-04-28
目的: 研究机体内部选择性环氧合酶-2(COX-2)抑制剂对肝细胞癌的抑制作用.
方法: 将三种肝癌细胞株HepG2、BEL-7402和SMMC-7721分别接种于6周龄裸鼠肝脏被膜下; 将接种了不同肝癌细胞株的裸鼠分别分为3组, 阴性对照组给予生理盐水灌胃, 实验组给予塞来昔布灌胃, 阳性对照组进行生理盐水灌胃的同时使用阿霉素腹腔注射; 3 wk后对裸鼠肝脏肿瘤取材、免疫组织化学法观察肿瘤组织中基质金属蛋白酶-2(MMP-2)及其抑制剂(TIMP-2)以及细胞间黏附因子-1(ICAM-1)的表达.
结果: 在肝脏被膜下接种了HepG2、BEL- 7402和SMMC-7721肝癌细胞株的裸鼠中, 应用塞来昔布的裸鼠肿瘤组织中MMP-2的表达下降(P<0.05), MMP-2的表达增加(P<0.05), TIMP-2/MMP-2比值增加. 在肝脏被膜下接种了BEL-7402和SMMC-7721肝癌细胞株的裸鼠中, 应用塞来昔布的裸鼠肿瘤组织中ICAM-1表达下降.
结论: 塞来昔布在机体内部可能具有抑制肝癌细胞转移和改善预后的作用.
引文著录: 殷积彬, 李宝馨, 谢新玉, 刘冰熔, 吕志武, 关景明, 高善玲. MMP-2和ICAM-1在裸鼠体内塞来昔布抑制肝癌组织中的表达. 世界华人消化杂志 2010; 18(12): 1206-1210
Revised: March 12, 2010
Accepted: March 23, 2010
Published online: April 28, 2010
AIM: To investigate the antitumor effects of celecoxib (a selective cyclooxygenase-2 inhibitor) against hepatocellular carcinoma in vivo.
METHODS: Human hepatoma cells (HepG2, BEL-7402 and SMMC-7721) were injected beneath the hepatic capsule of six-week-old nude mice. The mice were then randomly divided into three groups: negative control group (intragastrically given normal saline), experimental group (intragastrically given celecoxib), and positive control group (intragastrically given normal saline and intraperitoneally injected with adriamycin). Three weeks later, tumor tissue samples were taken for immunohistochemical analysis to examine the expression of matrix metalloproteinase-2 (MMP-2), tissue inhibitor of metalloproteinases-2 (TIMP-2) and intercellular adhesion molecule-1 (ICAM-1).
RESULTS: Compared to the negative control group, the expression of MMP-2 was down-regulated (P < 0.05) and that of TIMP-2 was up-regulated (P < 0.05) in hepatocellular carcinoma xenografts derived from HepG2, BEL-7402 and SMMC-7721 cells in the experimental group. The expression of ICAM-1 was also down-regulated in hepatocellular carcinoma xenografts derived from BEL-7402 and SMMC-7721 cells in the experimental group when compared with the negative control group (P < 0.05).
CONCLUSION: Celecoxib may be able to inhibit the metastasis and improve the prognosis of hepatocellular carcinoma.
- Citation: Yin JB, Li BX, Xie XY, Liu BR, Lv ZW, Guan JM, Gao SL. Celecoxib inhibits the expression of MMP-2 and ICAM-1 in hepatocellular carcinoma xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2010; 18(12): 1206-1210
- URL: https://www.wjgnet.com/1009-3079/full/v18/i12/1206.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i12.1206
选择性环氧合酶-2(selective cyclooxygenase-2 inhibitor, COX-2)抑制剂能够抑制恶性肿瘤细胞的增殖和侵袭, 促进肿瘤细胞的凋亡. 然而, 这些研究资料大多来自细胞培养[1-6], 机体内部的药物抗肿瘤效果仍不十分清楚, 尤其是口服COX-2抑制剂塞来昔布对肝脏原发肿瘤的疗效仍未见报道. 我们将肝癌细胞株接种于裸鼠肝脏组织中, 以塞来昔布灌胃法观察裸鼠体内选择性COX-2抑制剂的抗肿瘤效果, 现报道如下.
HepG2、BEL-7402、SMMC-7721购于中国科学院上海生命研究所. 清洁级BALB/c裸鼠购于中国北京维通利华试验动物技术有限公司, 周龄6 wk, ♂, 体质量17-20 g, 共45只. 1640培养基购自Gibco公司, 多克隆基质金属蛋白酶-2(MMP-2)及其抑制剂(TIMP-2)抗体购自英国Abcam公司, 细胞间黏附因子-1(intercellular adhesion molecule-1, ICAM-1)抗体购于北京中杉生物技术有限公司, 阿霉素(Adriamycin)为意大利Pharmacia生产, 塞来昔布由PPLLC公司生产.
1.2.1 肿瘤细胞培养和接种: 0.5×106个细胞接种培养瓶中, 48 h换培养液1次, 当培养瓶中细胞增殖到90%面积时, 台盼蓝法测定细胞活力, >95%后制备成5×107个/L的肝癌细胞悬液. 沿裸鼠左肋弓下缘切一长约1 cm的斜行无菌切口, 剥开腹肌, 暴露小鼠肝脏; 用BD针抽取细胞悬液0.1 mL, 使BD针尖与小鼠肝脏呈30度进针, 刺入肝脏约0.3 cm, 缓慢注入细胞悬液, 注射完毕后, 有酒精棉签压迫注射部位30 s, 确定无渗液和出血后, 逐层缝合腹肌和皮肤. 21 d后, 处死裸鼠, 留取肝脏的肿瘤组织用100 g/L甲醛固定.
1.2.2 分组: 将裸鼠随机分为3组, 阴性对照组、实验组和阳性对照组, 各15只. 每组裸鼠的肝脏被摸下分别接种HepG2肝癌细胞株、BEL-7402肝癌细胞株、SMMC-7721肝癌细胞株, 各5只.
1.2.3 药物处理: 于术后24 h, 实验组给予塞来昔布混悬液(300 mg/kg)灌胃; 阴性对照组给予等量的生理盐水灌胃; 阳性对照组灌胃同时, 前3 d给予浓度为1 g/L的阿霉素按6 mg/kg腹腔注射, 共3次.
1.2.4 免疫组织化学: 标本按常规分别固定、脱水、透明、浸蜡. 石蜡切片、脱蜡、抗原修复后, 依次加入一抗, 二抗, 常规HE染色, 然后中性树胶封片. MMP-2、TIMP-2和ICAM-1结果的判定: 显微镜下每张切片中计记录视野中的阳性细胞的平均百分比, 阳性细胞数占视野中全部细胞的比例<5%为(-), 阳性细胞数的比例占5%-25%为(+), 阳性细胞数的比例占25%-50%为(++), 阳性细胞数的比例占50%-75%为(+++), 阳性细胞数的比例>75%为(++++).
统计学处理 等级资料的统计学比较用秩和检验. P<0.05为统计学差异存在显著性.
100 mL/L胎牛血清常规培养HepG2、BEL-7402、SMMC-7721三种肝癌细胞系. HepG2细胞呈梭形, 体积较小, 折光性好, 核仁2-3个, 细胞生长旺盛, 接种后4-5 d长满培养瓶. BEL-7402细胞呈三角形, 体积较大, 伪足短, 折光性差, 核仁2-3个, 细胞生长较慢, 接种后7-8 d长满培养瓶. SMMC-7721细胞形态舒展, 伪足数量差异较大, 1-4个, 细胞折光性好, 核仁4-5个, 细胞生长旺盛, 接种后4-5 d长满培养瓶.
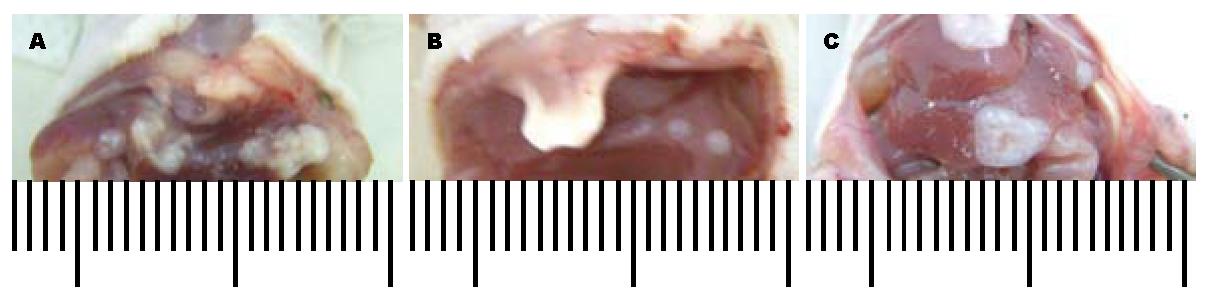
在裸鼠肝脏接种肿瘤细胞后3 wk, 肉眼观察, 可见肿瘤位于肝脏被膜下, 肿瘤组织呈灰白色, 质韧, 呈块状不规则形分布(图1).
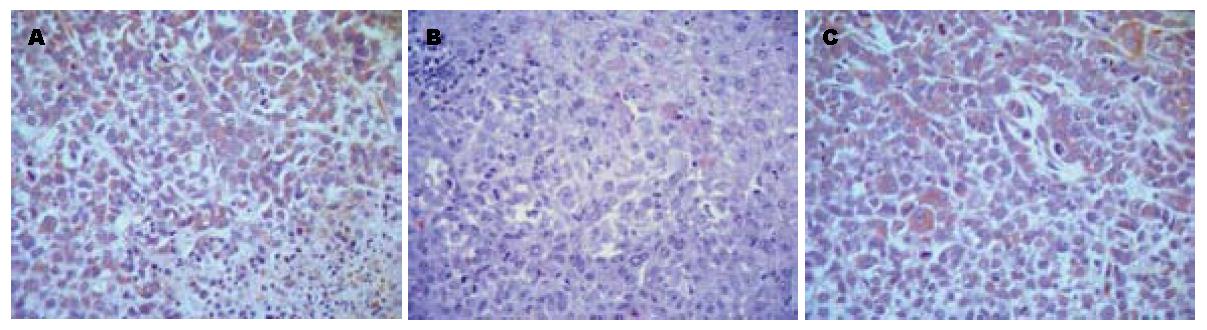
HepG2、BEL-7402和SMMC-7721三种细胞系表达MMP-2较高, 应用塞来昔布或阿霉素后, MMP-2的表达均受到抑制, 统计学比较显示实验组与阴性对照组之间有统计学差异(P<0.05). 提示塞来昔布具有抑制MMP-2在肝癌细胞中表达的作用. 进一步比较实验组与阳性对照组发现, 在HepG2肝癌细胞组织中两组中MMP-2的含量差别不大, 经统计学检验无统计学差异(P>0.05). 在BEL-7402和SMMC-7221肝癌细胞中实验组的MMP-2的含量低于阳性对照组, 且均有统计学差异(P<0.05), 提示在BEL-7402和SMMC-7221肝癌中塞来昔布的疗效要好于阿霉素的疗效(表1).
HepG2和SMMC-7721两种细胞系低度表达TIMP-2, BEL-7402细胞系高表达TIMP-2, 应用塞来昔布后, 三种不同的肿瘤细胞中TIMP-2表达增加, 统计学分析显示实验组与阴性对照组间有统计学差异(P<0.05), 实验组与阳性对照组间有统计学差异(P<0.05, 表1).
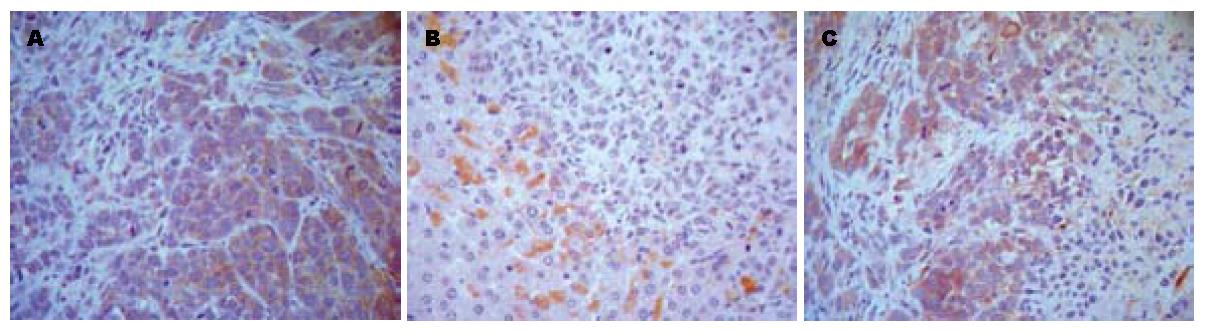
ICAM-1在HepG2细胞中未见表达, 在BEL-7402和SMMC-7721两种肝癌细胞中高表达, 免疫组织化学染色结果分别为(+)-(+++)和(+)-(+++); 使用塞来昔布后ICAM-1表达显著受到抑制, 免疫组织化学染色结果分别为(-)-(+)和(-)-(+), 裸鼠使用阿霉素后肝癌组织ICAM-1表达分别为(++)-(+++)和(++)-(+++). 以上两种不同的肝癌组织分别进行统计学比较显示, 塞来昔布组与阴性对照组的差异均有统计学意义(P<0.05), 因此, 裸鼠体内塞来昔布对肝癌细胞的ICAM-1表达具有抑制作用(图2, 图3).
选择性COX-2抑制剂是一种非甾体抗炎药, 较多用于治疗骨与关节的疼痛性疾病[7]. 近年的研究认为, 选择性COX-2抑制剂可以通过非前列腺素E2(prostaglandin E2, PGE2)依赖性途径抑制肿瘤的发生和发展[8], 其抗肿瘤作用机制比较复杂, 涉及诸多方面, 如阻滞细胞周期, 抑制细胞增殖, 诱导凋亡, 抑制增殖细胞信号的传导等[3,9-13], 选择性COX-2抑制剂在机体内部的抗肿瘤疗效报道较少. 我们在成功建立了原位肝癌动物模型后, 经口给予裸鼠塞来昔布治疗, 旨在观察选择性COX-2抑制剂在机体内部的抗肿瘤效果.
MMPs是一组锌离子依赖性内肽酶, 与细胞外基质成分的降解有关[14-17]. MMP-2及其抑制剂(TIMP-2)是评价肝癌细胞转移能力的良好指标之一, MMP-2通过水解细胞外基质促进肿瘤细胞的侵袭和转移, 而TIMP-2能特异地抑制MMP-2的酶原激活和酶活性, 阻止肿瘤细胞的侵袭. 实验研究显示, 三种肝癌细胞都表达MMP-2和TIMP-2, 但不同的细胞系表达MMP/TIMP的能力有所不同. 机体内选择性COX-2抑制剂塞来昔布能够抑制肝癌细胞内MMP-2表达, 又增加TIMP-2的表达, 从而使TIMP-2/MMP-2比例增加, 导致肿瘤细胞降解细胞外基质的作用下降, 达到抑制肿瘤细胞的转移的作用. 这个结果与我们以往的研究结果是一致的[18,19]. 还有研究显示, 在肿瘤细胞内, MMPs表达的调节要受到细胞增殖信号途径的影响[20,21], 选择性COX-2抑制剂能够抑制细胞增殖信号途径中一些蛋白酶的激活, 导致下游多种与细胞增殖相关的蛋白酶的基因转录受到抑制, 因此, 选择性COX-2抑制剂对MMP-2的抑制作用还可能与抑制细胞增殖信号途径有关.
ICAM-1有广泛的组织分布, 生理条件下低量表达, 却可以受到多种因素的诱导. ICAM-1参与肿瘤的发展过程, ICAM-1与肿瘤的发生、转移以及预后关系十分密切[22,23]. ICAM-1不仅促进血管生成, 还可以结合在血液中的淋巴细胞及自然杀伤细胞表面, 起到封闭作用, 使这些细胞识别癌细胞的能力下降. 肝细胞中的ICAM-1主要表达在胞膜, 肝癌细胞中更多出现于胞质, 并分泌进入血液. 有研究显示, 可以通过血中ICAM-1的浓度变化, 预测病毒性肝炎患者的癌变倾向, 以及评估恶性肿瘤的治疗效果[24,25], 所以ICAM-1可以作为一项判断肿瘤疗效和预后的观察指标. 实验中发现, 塞来昔布使BEL-7402和SMMC-7721肝癌细胞中的ICAM-1表达明显下降, 说明选择性COX-2抑制剂有一定的辅助机体清除肿瘤细胞的作用, 即可能促进机体免疫系统对肿瘤细胞的识别, 改善肿瘤的预后. ICAM-1基因接受多种转录因子的调节, 如核转录因子-κB(nuclear factor-kappaB, NF-κB)、活化剂蛋白-1(activator protein-1, AP-1)、信号转导活化转录因子(signal transducer and activator of transcription, STAT)等, NF-κB进入细胞核后, 与ICAM-1启动子的κB位点结合, 引发ICAM-1基因转录. 选择性COX-2抑制剂能够抑制NF-κB的活化, 从而抑制其向细胞核内迁移, 因此, 选择性COX-2抑制剂抑制ICAM-1的表达, 还可能与肿瘤细胞内转录因子的激活受到抑制有关[26].
由于实验观察时间较短, 裸鼠肺部解剖和HE染色未见到转移灶, 因此, 选择性COX-2抑制剂体内的长期抗肿瘤效果, 还需要延长裸鼠的饲养时间、观察时间和增加实验例数. 选择性COX-2抑制剂的临床安全性目前仍存在争议, 主要是增加心血管意外的发生[27], 也有出现重要脏器功能衰竭的报道[28]. 另有一些研究认为, 选择性COX-2抑制剂的使用是安全的, 尤其是在癌症镇痛方面, 并仍在继续[29]. 总之, 选择性COX-2抑制剂与肿瘤转移及预后之间的关系还有待进一步研究[30].
肝癌是我国常见的恶性肿瘤之一, 手术切除病灶是最佳选择. 目前肝癌的治疗还缺少有效的药物, 因此, 研究新型抗肿瘤药物的抗癌效果十分必要. 选择性COX-2抑制剂具有一定的抗肿瘤作用, 其作用机制的研究尚不够深入和全面.
丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科; 郑鹏远, 教授, 郑州大学第二附属医院消化科
选择性COX-2抑制剂的抗肿瘤作用的研究多侧重于细胞培养, 机体内部的抗肿瘤效果仍不完全清楚.
Xie等研究发现, 在较高表达乙型肝炎病毒X蛋白的肝癌细胞株中, 塞来昔布抑制癌细胞增殖和促进其凋亡的效果更佳, 其中的作用机制虽然不十分清楚, 却提供了一个新的探索思路, 即选择性COX-2抑制剂的抗肿瘤作用可能受到肿瘤细胞自身特点的影响.
本研究首先建立肝脏原位移植瘤裸鼠模型, 然后经口给予塞来昔布, 观察药物在机体内部的是否存在抗肿瘤的效果, 为选择性COX-2抑制剂的临床抗肿瘤治疗提供动物实验参考.
虽然塞来昔布在裸鼠体内表现出了一定的抗肝癌疗效, 但药物对机体的安全性尚不肯定, 因此还需要深入研究选择性COX-2抑制剂的药理作用. 临床应用选择性COX-2抑制剂治疗肿瘤应当有选择性.
本文选题新颖, 设计合理, 具有一定的理论意义.
编辑: 李军亮 电编: 何基才
| 1. | Xie H, Gao L, Chai N, Song J, Wang J, Song Z, Chen C, Pan Y, Zhao L, Sun S. Potent cell growth inhibitory effects in hepatitis B virus X protein positive hepatocellular carcinoma cells by the selective cyclooxygenase-2 inhibitor celecoxib. Mol Carcinog. 2009;48:56-65. [PubMed] [DOI] |
| 2. | Tuynman JB, Vermeulen L, Boon EM, Kemper K, Zwinderman AH, Peppelenbosch MP, Richel DJ. Cyclooxygenase-2 inhibition inhibits c-Met kinase activity and Wnt activity in colon cancer. Cancer Res. 2008;68:1213-1220. [PubMed] [DOI] |
| 3. | Baek JY, Hur W, Wang JS, Bae SH, Yoon SK. Selective COX-2 inhibitor, NS-398, suppresses cellular proliferation in human hepatocellular carcinoma cell lines via cell cycle arrest. World J Gastroenterol. 2007;13:1175-1181. [PubMed] [DOI] |
| 4. | Li S, Tong Q, Zhang W, Wang Q, Chen Z, Wu Q. Mechanism of growth inhibitory effects of cyclooxygenase-2 inhibitor-NS398 on cancer cells. Cancer Invest. 2008;26:333-337. [PubMed] [DOI] |
| 5. | Cusimano A, Foderà D, D'Alessandro N, Lampiasi N, Azzolina A, Montalto G, Cervello M. Potentiation of the antitumor effects of both selective cyclooxygenase-1 and cyclooxygenase-2 inhibitors in human hepatic cancer cells by inhibition of the MEK/ERK pathway. Cancer Biol Ther. 2007;6:1461-1468. [PubMed] [DOI] |
| 6. | Breinig M, Schirmacher P, Kern MA. Cyclooxygenase-2 (COX-2)--a therapeutic target in liver cancer? Curr Pharm Des. 2007;13:3305-3315. [PubMed] [DOI] |
| 7. | de Boer TN, Huisman AM, Polak AA, Niehoff AG, van Rinsum AC, Saris D, Bijlsma JW, Lafeber FJ, Mastbergen SC. The chondroprotective effect of selective COX-2 inhibition in osteoarthritis: ex vivo evaluation of human cartilage tissue after in vivo treatment. Osteoarthritis Cartilage. 2009;17:482-488. [PubMed] [DOI] |
| 8. | Steinbach G, Lynch PM, Phillips RK, Wallace MH, Hawk E, Gordon GB, Wakabayashi N, Saunders B, Shen Y, Fujimura T. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med. 2000;342:1946-1952. [PubMed] [DOI] |
| 9. | Nagahara T, Okano J, Murawaki Y. Mechanisms of anti-proliferative effect of JTE-522, a selective cyclooxygenase-2 inhibitor, on human liver cancer cells. Oncol Rep. 2007;18:1281-1290. [PubMed] [DOI] |
| 10. | Li J, Chen X, Dong X, Xu Z, Jiang H, Sun X. Specific COX-2 inhibitor, meloxicam, suppresses proliferation and induces apoptosis in human HepG2 hepatocellular carcinoma cells. J Gastroenterol Hepatol. 2006;21:1814-1820. [PubMed] [DOI] |
| 11. | Yamanaka Y, Shiraki K, Inoue T, Miyashita K, Fuke H, Yamaguchi Y, Yamamoto N, Ito K, Sugimoto K, Nakano T. COX-2 inhibitors sensitize human hepatocellular carcinoma cells to TRAIL-induced apoptosis. Int J Mol Med. 2006;18:41-47. [PubMed] [DOI] |
| 12. | Liu NB, Peng T, Pan C, Yao YY, Shen B, Leng J. Overexpression of cyclooxygenase-2 in human HepG2, Bel-7402 and SMMC-7721 hepatoma cell lines and mechanism of cyclooxygenase-2 selective inhibitor celecoxib-induced cell growth inhibition and apoptosis. World J Gastroenterol. 2005;11:6281-6287. [PubMed] [DOI] |
| 13. | Park JW, Park JE, Lee JA, Lee CW, Kim CM. Cyclooxygenase-2 (COX-2) is directly involved but not decisive in proliferation of human hepatocellular carcinoma cells. J Cancer Res Clin Oncol. 2006;132:184-192. [PubMed] [DOI] |
| 14. | Leung E, McArthur D, Morris A, Williams N. Cyclooxygenase-2 inhibition prevents migration of colorectal cancer cells to extracellular matrix by down-regulation of matrix metalloproteinase-2 expression. Dis Colon Rectum. 2008;51:342-347. [PubMed] [DOI] |
| 15. | Ishizaki T, Katsumata K, Tsuchida A, Wada T, Mori Y, Hisada M, Kawakita H, Aoki T. Etodolac, a selective cyclooxygenase-2 inhibitor, inhibits liver metastasis of colorectal cancer cells via the suppression of MMP-9 activity. Int J Mol Med. 2006;17:357-362. [PubMed] [DOI] |
| 16. | Kurihara Y, Hatori M, Ando Y, Ito D, Toyoshima T, Tanaka M, Shintani S. Inhibition of cyclooxygenase-2 suppresses the invasiveness of oral squamous cell carcinoma cell lines via down-regulation of matrix metalloproteinase-2 production and activation. Clin Exp Metastasis. 2009;26:425-432. [PubMed] [DOI] |
| 17. | Suh Y, Afaq F, Johnson JJ, Mukhtar H. A plant flavonoid fisetin induces apoptosis in colon cancer cells by inhibition of COX2 and Wnt/EGFR/NF-kappaB-signaling pathways. Carcinogenesis. 2009;30:300-307. [PubMed] [DOI] |
| 19. | 殷 积彬, 刘 铁夫, 孟 祥宁, 赵 丽莉, 刘 晓川. NS-398对HGF诱导的肝癌细胞株MMP-7, MMP-9, TIMP-1表达的影响. 世界华人消化杂志. 2006;14:2301-2305. [DOI] |
| 20. | Lee KW, Kim MS, Kang NJ, Kim DH, Surh YJ, Lee HJ, Moon A. H-Ras selectively up-regulates MMP-9 and COX-2 through activation of ERK1/2 and NF-kappaB: an implication for invasive phenotype in rat liver epithelial cells. Int J Cancer. 2006;119:1767-1775. [PubMed] [DOI] |
| 21. | Abiru S, Nakao K, Ichikawa T, Migita K, Shigeno M, Sakamoto M, Ishikawa H, Hamasaki K, Nakata K, Eguchi K. Aspirin and NS-398 inhibit hepatocyte growth factor-induced invasiveness of human hepatoma cells. Hepatology. 2002;35:1117-1124. [PubMed] [DOI] |
| 22. | Gallicchio M, Rosa AC, Dianzani C, Brucato L, Benetti E, Collino M, Fantozzi R. Celecoxib decreases expression of the adhesion molecules ICAM-1 and VCAM-1 in a colon cancer cell line (HT29). Br J Pharmacol. 2008;153:870-878. [PubMed] [DOI] |
| 23. | Dianzani C, Brucato L, Gallicchio M, Rosa AC, Collino M, Fantozzi R. Celecoxib modulates adhesion of HT29 colon cancer cells to vascular endothelial cells by inhibiting ICAM-1 and VCAM-1 expression. Br J Pharmacol. 2008;153:1153-1161. [PubMed] [DOI] |
| 24. | Hayes SH, Seigel GM. Immunoreactivity of ICAM-1 in human tumors, metastases and normal tissues. Int J Clin Exp Pathol. 2009;2:553-560. [PubMed] |
| 25. | Helaly GF, Abou Shamaa LA. Influence of hepatitis C virus infection on circulating levels of sICAM-1 and VEGF in patients with hepatitis C and hepatocellular carcinoma (HCC) and their role in enhancing detection of HCC. Egypt J Immunol. 2006;13:27-38. [PubMed] [DOI] |
| 26. | Yasuda T. Hyaluronan inhibits cytokine production by lipopolysaccharide-stimulated U937 macrophages through down-regulation of NF-kappaB via ICAM-1. Inflamm Res. 2007;56:246-253. [PubMed] [DOI] |
| 27. | Rao PN, Grover RK. Apricoxib, a COX-2 inhibitor for the potential treatment of pain and cancer. IDrugs. 2009;12:711-722. [PubMed] |
| 28. | El Hajj II, Malik SM, Alwakeel HR, Shaikh OS, Sasatomi E, Kandil HM. Celecoxib-induced cholestatic liver failure requiring orthotopic liver transplantation. World J Gastroenterol. 2009;15:3937-3939. [PubMed] [DOI] |
| 29. | Mantovani G, Macciò A, Madeddu C, Serpe R, Antoni G, Massa E, Dessì M, Panzone F. Phase II nonrandomized study of the efficacy and safety of COX-2 inhibitor celecoxib on patients with cancer cachexia. J Mol Med (Berl). 2010;88:85-92. [PubMed] [DOI] |
| 30. | Cui W, Hu SX, Tang ZY, Hu KQ. In-vivo effects and mechanisms of celecoxib-reduced growth of cyclooxygenase-2 (COX-2)-expressing versus COX-2-deleted human HCC xenografts in nude mice. Anticancer Drugs. 2008;19:891-897. [PubMed] [DOI] |