修回日期: 2010-03-29
接受日期: 2010-04-07
在线出版日期: 2010-04-28
目的: 研究刺参糖胺聚糖在动物活体内的抗HBV作用.
方法: 开放性动物实验. HBV转基因小鼠30只, 按性别随机分为生理盐水对照组(每天给予等容积的生理盐水)、刺参糖胺聚糖低(30 mg/kg)、中(40 mg/kg)、高(50 mg/kg)三个剂量组及干扰素(45 U/kg)对照组, 每组雌雄各半, 分笼饲养. 给药方式为腹腔注射, 每日1次, 连续用药30 d. 给药结束后处死小鼠, 剥离其肝脏组织. 免疫组织化学染色法及综合评分法观察并半定量分析小鼠肝脏组织HBsAg, HBcAg的表达.
结果: 与生理盐水对照组比较, 刺参糖胺聚糖低、中、高剂量对小鼠肝脏HBsAg, HBcAg的表达均有抑制作用(4.93±1.43, 3.57±1.02, 3.27±0.64 vs 6.97±0.75; 5.73±1.62, 4.27±1.03, 4.27±1.03 vs 7.23±0.53, P<0.01或0.05), 但其抑制作用低于干扰素对照组(P<0.01或0.05), 并呈现一定的量效反应关系.
结论: 刺参糖胺聚糖具有一定的体内抗HBV作用.
引文著录: 周丽, 辛永宁, 罗兵, 宣世英. 刺参糖胺聚糖对HBV转基因小鼠肝组织HBV相关抗原表达的影响. 世界华人消化杂志 2010; 18(12): 1201-1205
Revised: March 29, 2010
Accepted: April 7, 2010
Published online: April 28, 2010
AIM: To study the potential anti-hepatitis B virus (HBV) effects of glycosaminoglycan extracted from Stichopus japonicus Selenka (SJ-GAG) in vivo.
METHODS: Thirty HBV transgenic mice were divided into five groups: saline group, interferon (IFN) group, and low-, medium- and high-dose SJ-GAG group, which were intraperitoneally injected with normal saline, IFN-α2b (45 U/kg), and SJ-GAG (30, 40 and 50 mg/kg, respectively) once daily for 30 d, respectively. After treatment, all mice were killed to take liver samples for analysis of the expression of HBsAg and HBcAg by immunohistochemistry.
RESULTS: Compared to the saline group, the expression of HBsAg and HBcAg in the liver of HBV transgenic mice was dose-dependently inhibited in all the SJ-GAG groups (4.93 ± 1.43, 3.57 ± 1.02, 3.27 ± 0.64 vs 6.97 ± 0.75; 5.73 ± 1.62, 4.27 ± 1.03, 4.27 ± 1.03 vs 7.23 ± 0.53; P < 0.01 or 0.05). However, SJ-GAG has lower inhibitory effects on the expression of HBsAg and HbcAg than IFN (P < 0.01 or 0.05).
CONCLUSION: SJ-GAG has anti-HBV activity in vivo.
- Citation: Zhou L, Xin YN, Luo B, Xuan SY. Effects of glycosaminoglycan extracted from Stichopus japonicus Selenka on the expression of HBV-associated antigens in the liver of HBV transgenic mice. Shijie Huaren Xiaohua Zazhi 2010; 18(12): 1201-1205
- URL: https://www.wjgnet.com/1009-3079/full/v18/i12/1201.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i12.1201
乙型病毒性肝炎是威胁人类健康的重大问题之一. 据统计, 全球约有20亿人感染乙型肝炎病毒(hepatitis B virus, HBV), 约3.5亿人为HBV携带者, 每年约有100万人死于乙型肝炎相关疾病(肝硬化、肝衰竭、原发性肝细胞癌等)[1,2]. 我国是HBV感染的高发区, 约有1.3亿人感染HBV[3], 占我国总人口的9.09%, 所以乙型病毒性肝炎的防治是目前亟待解决的问题, 其中抗病毒药物的研发是工作的重点. 刺参糖胺聚糖是从刺参体壁提取的一种硫酸多糖, 具有抗凝血、抗肿瘤、抗病毒、提高免疫力等多种功能. 目前对于刺参糖胺聚糖抗HBV的研究并不多, 我们采用乙型肝炎转基因小鼠作为动物模型, 研究了刺参糖胺聚糖的活体内抗HBV活性.
SPF级Balb/c-HBV转基因小鼠, 周龄10 wk, 体质量18-22 g, 购自中国人民解放军第四五八医院全军肝病中心. 刺参糖胺聚糖由中国海洋大学海洋药物与食品研究所提供. 注射用重组人干扰素α-2b(利分能), 由哈药集团生物工程有限公司生产, 产品批号为200803032. 主要试剂及仪器: 鼠抗人-HBs, 兔抗人-HBc及SABC免疫组织化学试剂盒, 购自福州迈新生物技术有限公司.
1.2.1 药物的配制: 刺参糖胺聚糖为白色干燥粉末, 实验时用生理盐水配制成所需浓度的溶液, 再经0.22 μm微孔滤膜过滤除菌, 4 ℃保存备用.
1.2.2 分组与给药: 30只乙型肝炎转基因小鼠, 雌雄各半, 随机分为5组, 每组雌雄各半, 分笼饲养, 分别为生理盐水对照组(每天给予等容积的生理盐水), 刺参糖胺聚糖低剂量组(30 mg/kg), 刺参糖胺聚糖中剂量组(40 mg/kg)[4,5], 刺参糖胺聚糖高剂量组(50 mg/kg), 干扰素对照组(45 U/kg). 给药方式为腹腔注射[6,7], 1次/日, 连续给药30 d.
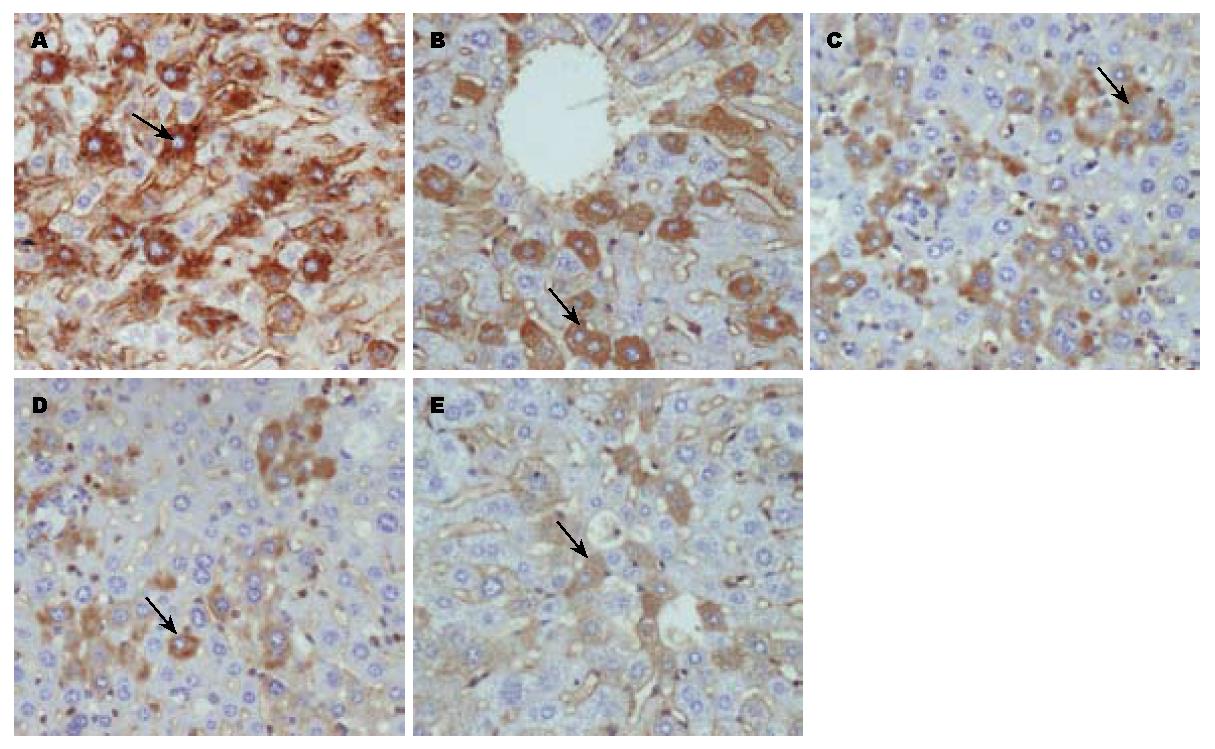
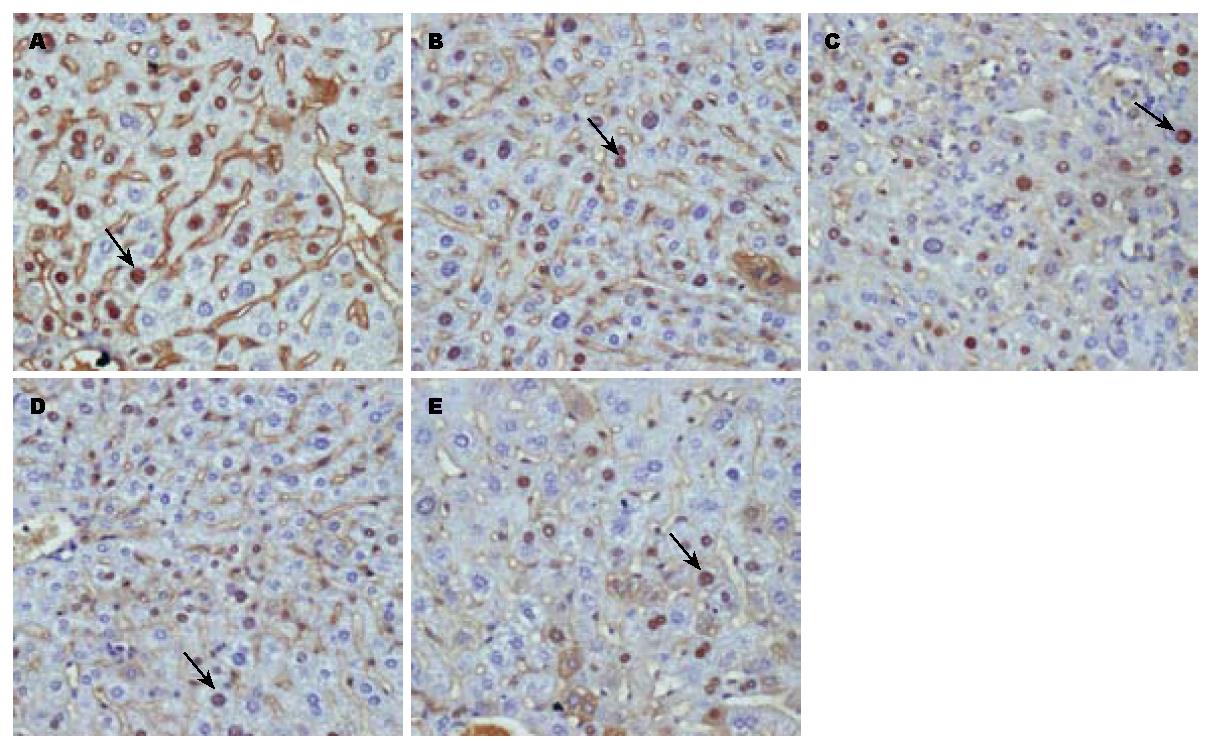
1.2.3 检测项目及方法: 给药结束后脱颈处死小鼠, 剥离肝脏组织, 以100 g/L的中性甲醛液固定, 石蜡包埋, 切片, 采用SABC免疫组织化学染色法进行常规脱蜡、水化, 3% H2O2灭活内源性过氧化物酶10 min, 依次滴加一抗、增强剂、生物素化山羊抗兔、DAB显色剂、苏木素复染、梯度酒精脱水、二甲苯透明、封片. 显微镜下观察小鼠肝脏组织HBsAg, HBcAg的表达情况, 采用综合评分法进行免疫组织化学半定量分析: (1)每只小鼠肝组织高倍镜下随机计数5个视野, 计算阳性细胞百分比: ≤10%为0分, 11%-25%为1分, 26%-50%为2分, 51%-75%为3分, ≥76%为4分. (2)阳性为棕色: 浅棕色为1分, 棕色为2分, 深棕色为3分, 不着色为0分. (3)上述两项指标的两积分相乘得到综合评分.
统计学处理 所有数据采用SPSS16.0统计学软件进行单因素方差分析(LSD法), 进行组间两两比较.
与生理盐水组相比, 刺参糖胺聚糖低、中、高剂量组对小鼠肝脏组织HBsAg的表达具有显著的抑制作用, 但是其抑制作用弱于干扰素对照组, 差异具有显著性. 而且刺参糖胺聚糖低、中、高剂量组随着药物浓度的增加对小鼠肝脏组织HBsAg表达的抑制作用也增强, 呈现一定的量效反应关系(表1). 免疫组织化学染色如图1中箭头所示, 阳性细胞的胞质被染为棕褐色, 生理盐水对照组阳性细胞的染色数量及染色强度均高于其他组, 而且随着刺参糖胺聚糖药物浓度的增高, 刺参糖胺聚糖低、中、高剂量组小鼠肝脏组织HBsAg的表达量依次相对减弱, 但与干扰素对照组比较仍然较强.
刺参糖胺聚糖低、中、高剂量组与生理盐水组相比, 其对乙型肝炎转基因小鼠肝脏组织HBcAg的表达均具有显著的抑制作用, 但这种抑制作用与干扰素组相比较弱, 差异具有显著性. 刺参糖胺聚糖低、中、高剂量组之间相比, 其对小鼠肝脏组织HBcAg表达的抑制作用也具有差异性, 并且随着浓度的增加其抑制作用明显增强, 呈现一定的量效反应关系(表1). 免疫组织化学染色结果如图2所示, 阳性细胞的胞核被染为棕褐色. 与生理盐水对照组比较, 刺参糖胺聚糖低、中、高剂量组小鼠肝脏组织阳性细胞数量及染色强度均呈现一定程度的减弱, 但与干扰素对照组比较仍然较强.
乙型肝炎的治疗关键在于抗病毒治疗, 目前的抗HBV药物主要分为干扰素和核苷类药物[8-11]. 干扰素兼有抗病毒和免疫调节的功能, 但具有价格较贵, 不良反应大, 而且需皮下注射, 使用不便等缺点[8,12]. 核苷类药物如拉米夫定、阿德福韦酯、恩替卡韦等, 其抗病毒机制主要是在人体内磷酸化成为三磷酸核苷类似物后, 抑制病毒DNA聚合酶和逆转录酶的活性, 并与核苷竞争性深入病毒DNA链, 终止DNA链的延长和合成[6,9]. 但这类药物疗程长, 长期用药易发生病毒变异, 产生耐药性, 而且存在交叉耐药[11-13]. 另外亦有非核苷类药物, 例如1, 3, 4-噁二唑类化合物, 以及二氢嘧啶类化合物等[14,15], 可能也具有抗HBV的作用, 目前临床尚处于起步研究阶段.
刺参糖胺聚糖是一种硫酸化多糖, 旧称刺参酸性黏多糖或刺参粘多糖, 是从刺参体壁中提取的一种硫酸多糖, 系由D-N-乙酰氨基半乳糖、D-葡萄糖醛酸、L-岩藻糖和硫酸基组成, 是多糖大分子链中单糖分子上的某羟基被硫酸根所取代而形成的一类多功能生理活性物质[12,16]. 刺参糖胺聚糖在溶液中以离子形式存在, 具有与带正电的离子或成分(包括生物大分子成分)相互作用的能力, 所以这种带有较多负离子的糖胺聚糖称为聚阴离子. 糖胺聚糖类共有的聚阴离子性质以及他们在溶液中的不同构象形成了他们多种生物学作用基础[17-20], 其抗凝血、抗肿瘤、免疫调节等功能目前研究较多[21-25], 而抗HBV的研究尚未见报道. 本研究采用目前研究已经相当成熟而且应用广泛的HBV转基因小鼠作为实验动物模型, 进行体内实验研究[26-30]. HBV转基因小鼠饲养容易、成本低、繁殖周期短、遗传背景清楚, 其能在个体水平, 从时间和空间角度同时观察HBV单个核多个基因区的整合与表达功能及致病作用. 而且高水平复制型HBV转基因小鼠与人HBV慢性感染相似, 从而为抗HBV药物的研究提供了广阔空间[31-33].
本研究采用不同浓度的刺参糖胺聚糖作用于HBV转基因小鼠, 研究表明: 免疫组织化学结果显示刺参糖胺聚糖从低剂量(30 mg/kg)开始对小鼠肝脏组织HBsAg, HBcAg的表达均具有抑制作用, 而且随着药物剂量的增加其抑制作用增强. 综合上述结果, 说明刺参糖胺聚糖在HBV转基因小鼠体内具有一定的抗HBV作用, 而且其抗病毒作用呈现一定的量效反应关系.
多糖抗HBV作用的机制目前尚不明确, 其途径可能主要为抑制HBsAg, HBeAg的分泌, 以及抑制病毒DNA的复制. 另有研究报道其机制可能为直接抑制病毒进入细胞后某一复制环节; 非特异性免疫增强作用、提高树突状细胞的抗原递呈能力; 防止和推迟耐药株的出现; 提高其他药物的抗病毒活性; 抗氧化作用, 减轻肝损伤等[8,19,34,35]. 本研究表明刺参糖胺聚糖活体内具有抗HBV的作用, 并呈现一定的量效反应关系. 但小鼠感染HBV的体内病理生理改变与人感染HBV并不完全一样, 存在种属差异, 而且目前对于刺参糖胺聚糖的提取、分离、纯化、鉴定等技术尚需改进, 这在一定程度上亦影响了其抗病毒作用的效果. 基于上述因素的影响, 刺参糖胺聚糖的抗HBV作用仍需进一步深入研究和完善.
乙型肝炎至今仍然是全世界所面临的一大公共卫生难题, 其具有难以治愈、易复发、传染性等特征. 目前乙型肝炎的治疗关键是抗病毒治疗, 目前的抗病毒药物主要是干扰素和核苷类抗病毒药物, 但无论哪一种药物都不能彻底清除患者体内的病毒. 所以抗HBV新药的研发仍然是目前研究的重点.
高润平, 教授, 吉林大学第一医院肝病科; 高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科
刺参糖胺聚糖具有多种生物学活性, 目前对其在抗凝血、抗肿瘤、抗病毒、免疫调节等方面的研究均较多.
刺参糖胺聚糖具有多种生物学活性, 但是其抗HBV的研究目前并不多见, 本研究首次从抗HBV方面研究了其抗病毒的活性, 从而为海洋抗病毒药物的研发提供了新思路.
本研究为慢性乙型肝炎抗病毒药物的研发以及海洋抗病毒药物的研究开创了新的领域.
本研究设计比较合理, 实验图片比较清楚地说明刺参糖胺聚糖具有抑制HBV复制的作用, 具有进一步深入研究的必要性和参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect Dis. 2002;2:395-403. [PubMed] [DOI] |
| 3. | Vildózola Gonzales H, Salinas JL. [Natural history of chronic hepatitis B virus infection]. Rev Gastroenterol Peru. 2009;29:147-157. [PubMed] |
| 9. | De Clercq E. Antiviral drugs in current clinical use. J Clin Virol. 2004;30:115-133. [PubMed] [DOI] |
| 10. | Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] [DOI] |
| 11. | Humphries JC, Dixon JS. Antivirals for the treatment of chronic hepatitis B: current and future options. Intervirology. 2003;46:413-420. [PubMed] [DOI] |
| 13. | Liaw YF. Natural history of chronic hepatitis B virus infection and long-term outcome under treatment. Liver Int. 2009;29 Suppl 1:100-107. [PubMed] [DOI] |
| 14. | Tseng YP, Kuo YH, Hu CP, Jeng KS, Janmanchi D, Lin CH, Chou CK, Yeh SF. The role of helioxanthin in inhibiting human hepatitis B viral replication and gene expression by interfering with the host transcriptional machinery of viral promoters. Antiviral Res. 2008;77:206-214. [PubMed] [DOI] |
| 16. | Kariya Y, Mulloy B, Imai K, Tominaga A, Kaneko T, Asari A, Suzuki K, Masuda H, Kyogashima M, Ishii T. Isolation and partial characterization of fucan sulfates from the body wall of sea cucumber Stichopus japonicus and their ability to inhibit osteoclastogenesis. Carbohydr Res. 2004;339:1339-1346. [PubMed] [DOI] |
| 20. | Lu Y, Wang BL. The research progress of antitumorous effectiveness of Stichopus japonicus acid mucopolysaccharide in north of China. Am J Med Sci. 2009;337:195-198. [PubMed] [DOI] |
| 21. | Lu Y, Zhang BY, Dong Q, Wang BL, Sun XB. The effects of Stichopus japonicus acid mucopolysaccharide on the apoptosis of the human hepatocellular carcinoma cell line HepG2. Am J Med Sci. 2010;339:141-144. [PubMed] [DOI] |
| 22. | 王 静凤, 王 奕, 赵 林, 逄 龙, 薛 长湖. 日本刺参的抗肿瘤及免疫调节作用研究. 中国海洋大学学报(自然科学版). 2007;37:93-96. |
| 23. | Shen WZ, Zhou RF, Wang XF, Ding QL, Wang HL. [Antithrombotic mechanisms of holothurian glycosaminoglycan extracted from sea cucumber]. Zhonghua Xueyexue Zazhi. 2006;27:579-583. [PubMed] |
| 24. | Kelly MS. Echinoderms: their culture and bioactive compounds. Prog Mol Subcell Biol. 2005;39:139-165. [PubMed] [DOI] |
| 26. | 刘 光泽, 孔 祥平, 任 向荣, 李 秀梅, 胡 莲美, 黄 黎珍, 顾 为望. 高复制HBV转基因小鼠模型对抗乙型肝炎病毒药物的效应研究. 中国病理生理杂志. 2007;23:99-102. |
| 27. | Yang XG. [Preliminary observations on the effect of sjamp on the fibrinolytic system]. Zhongguo Yixue Kexueyuan Xuebao. 1990;12:187-192. [PubMed] |
| 29. | 邱 英锋, 缪 晓辉. 乙型肝炎动物模型及其建立方法. 西北民族大学学报(自然科学版). 2003;24:73-76. |
| 30. | Fan Y, Jiang WZ, Wen JJ, Hao WL, Du JN, Liu X, Qian M. B7-DC-silenced dendritic cells induce stronger anti-HBV immunity in transgenic mice. Arch Virol. 2009;154:1813-1821. [PubMed] [DOI] |
| 32. | 党 双锁, 宋 平. HBV转基因小鼠在乙型肝炎防治方面的研究. 中华实验和临床感染病杂志(电子版). 2008;2:99-104. |