修回日期: 2010-03-28
接受日期: 2010-03-29
在线出版日期: 2010-04-18
目的: 探讨双侧肝叶巨大血管瘤的外科手术方式并总结治疗经验.
方法: 对1例罕见的特大双侧肝叶血管瘤患者的临床资料进行完整详细的回顾性分析及术后随访.
结果: 1例罕见的特大双侧肝叶血管瘤患者因正常肝组织较少无法同时施行左、右侧肝叶血管瘤切除术. 该患者接受了二期血管瘤切除术治疗: 一期手术切除左侧肝叶巨大血管瘤, 术后恢复顺利, 残余正常肝组织向左侧增生, 但同时右侧肝血管瘤也继续增大; 术后3.5年时接受了二期手术切除了右侧肝叶巨大血管瘤, 该患者术后逐渐康复. 至今已经健康存活4年余.
结论: 双侧肝叶巨大血管瘤可先切除左侧肝叶巨大血管瘤, 使正常肝组织解除压迫, 获得生长空间, 从而逐渐增生, 随后择期二期切除右侧肝叶巨大血管瘤.
引文著录: 徐新保, 冯志强, 张洪义, 张宏义, 张国荣, 张晋东, 刘承利, 肖梅, 张辉. 双侧肝叶巨大海绵状血管瘤分期切除1例. 世界华人消化杂志 2010; 18(11): 1163-1168
Revised: March 28, 2010
Accepted: March 29, 2010
Published online: April 18, 2010
AIM: To explore the surgical procedure for giant cavernous hemangioma involving the bilateral lobes of the liver and to summarize therapeutic experience.
METHODS: The clinical data for a female patient with giant cavernous hemangioma involving the bilateral lobes of the liver were retrospectively analyzed. Postoperative follow-up was carried out.
RESULTS: The patient could not bear one-stage resection of bilateral hemangiomas because small amount of liver parenchyma left would fail to support her life. A two-stage surgical procedure was then designed for her. In the first stage, the left hemangioma was excised smoothly to eliminate compression of normal liver parenchyma. The rest normal liver tissue was then allowed to grow. Three and a half years later, the volume of the left liver lobe was enlarged markedly, and the hemangioma in the right liver lobe also grew larger. The second-stage excision of the right hemangioma was then performed. The surgery was successful. Postoperatively, the patient recovered gradually. Up to now, she is surviving healthily more than 4 years.
CONCLUSION: Excision of the left hemangioma in advance can eliminate compression of normal liver tissue and thus permit the left normal liver tissue to gain growth space. The enlarged normal liver tissue increases liver function reserve and obviously facilitates subsequent second-stage resection of the right hemangioma.
- Citation: Xu XB, Feng ZQ, Zhang HY, Zhang HY, Zhang GR, Zhang JD, Liu CL, Xiao M, Zhang H. Two-stage excision of giant cavernous hemangioma involving the bilateral lobes of the liver: a report of one case. Shijie Huaren Xiaohua Zazhi 2010; 18(11): 1163-1168
- URL: https://www.wjgnet.com/1009-3079/full/v18/i11/1163.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i11.1163
肝血管瘤是最常见的肝脏良性肿瘤. 巨大的肝血管瘤较为少见, 尤其是双侧肝叶同时发生特大血管瘤非常罕见, 其手术治疗非常困难, 往往需要分期切除, 目前, 国内外仅有1例公开报道[1]. 本院于2002-06-04接诊1例双侧肝叶特大海绵状血管瘤患者. 该患者由于压迫症状明显, 有贫血表现, 血管瘤生长较快, 有破裂可能, 正常肝组织继续受损可能会失去手术切除机会, 因此须尽快切除肝血管瘤. 但患者肿瘤巨大, 切除过程中难免会累及邻近正常肝组织, 有可能损伤肝脏血管而影响正常肝组织血液供应, 如同时切除双侧巨大血管瘤, 不但手术切除难度极大, 风险很高, 并且术后患者可能会出现小肝综合征, 导致肝功能衰竭[1]. 故我们拟分两期手术: 先切除左叶病灶减轻压迫症状, 释放正常肝组织再生空间, 等到正常肝组织增生变大后再切除右肝巨大血管瘤. 现将该患者手术过程、围术期处理及术后恢复, 报道如下.
女, 48岁, 曾就诊于当地医院, 腹部超声检查示: 肝内多发巨大实性占位性, 恶性肿瘤可能性大. 当地医生认为恶性肿瘤晚期, 无法治疗. 2002-06-04就诊于中国人民解放军空军总医院肝胆外科. 患者主诉"腹部胀满不适1 mo余".
患者既往史无异常. 入院查体: 皮肤、巩膜无黄染, 腹部膨隆, 腹软, 肝于右肋下6 cm、剑突下8 cm可触及, 质中, 缘钝, 无触痛, 其余无异常. 入院后化验: WBC 2.7×109/L, 血色素84 g/L, 红细胞比容0.264 L/L, 电解质、肝、肾功能正常, 乙型肝炎五项阴性, AFP阴性, 凝血酶原时间正常. 胸片提示膈下占位性病变. 心电图正常. 入院后核磁共振检查提示: 肝右叶可见一巨大团状肿块, 大小约17 cm×16 cm, 肝左叶内侧段也见一直径约2 cm异常信号区, 左腹部另见一巨大肿块, 其上缘与肝左叶持平, 两者分界不清, 向下延伸至左肾上极, 大小约22 cm×20 cm, 考虑为肝脏多发巨大血管瘤可能性大. 经股动脉穿刺肝动脉造影显示: 肝门部下移, 肝动脉受肿瘤挤压移位, 肝左、右叶血管瘤巨大.
2002-06-27在全麻下行"左肝巨大血管瘤切除术". 经上腹部"人"形切口进腹后探查: 肝脏弥漫性肿大膨出, 占据中上腹部; 左肝可见25.0 cm×25.5 cm大小肿物, 压迫脾脏、胃、肠等周围脏器, 与肝脏第4段有一定界限; 右肝可触及20.0 cm×20.0 cm大小肿物, 上端隆起顶起膈肌, 向后压迫下腔静脉, 向左侧侵及左内叶, 胆囊附着其上; 腹腔内少量腹水. 探查后决定行左肝巨大血管瘤切除术. 切断并结扎肝圆韧带, 分离肝脏与膈肌的粘连, 切开肝镰状韧带及肝左三角韧带. 解剖第一肝门, 并置肝门阻断带. 沿左侧肿瘤与正常肝组织交界处, 完整切除肿瘤. 仔细寻找断面血管、胆管并结扎. 缝合肝创面止血. 温盐水冲洗创面, 检查无活动性出血, 于左膈下及肝脏断面处分别放置乳胶管1根并引出腹腔用缝线固定.
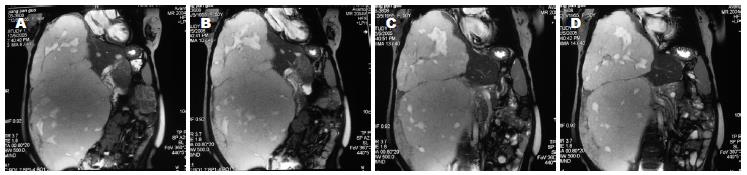
患者第1次住院出院后1年内一般情况良好, 无不适感觉, 能正常生活、工作. 患者拒绝按计划(第1次出院时曾嘱患者休养半年后返院复查)返院复查以决定是否行第二期手术. 2003年下半年开始经常感觉轻度乏力、腹胀. 2004-06开始自觉右上腹包块逐渐增大, 感觉右上腹胀满不适, 并且症状逐渐加重. 2005-11-30再次入住我院. 入院查体: 腹部极度膨隆, 可见上腹"人"型切口疤痕, 可触及巨大包块, 包块向右下可达到盆腔, 接近右腹股沟, 向左侧越过中线10 cm, 肝肺浊音界位于右锁骨中线第3肋间. 化验显示白细胞稍低, 3.2×109/L, 红细胞、血色素正常, 肝、肾功能基本正常, 活化部分凝血活酶时间36.2 s, 凝血酶原时间14.8 s, 凝血酶原活动度65.756%, 纤维蛋白原0.924 g/L. 乙型肝炎五项、丙型肝炎抗体、人类免疫缺陷病毒抗体、梅毒抗体全部为阴性. 心电图: TV1、V2、V3倒置、TV4低平, 提示窦性心律, 大致正常心电图, T波改变. 腹部超声: 膈肌上移, 肝右叶巨大血肝瘤(病变血流丰富), 大小约40 cm×20 cm×20 cm, 下至盆腔, 门静脉内径1.2 cm, 血流通畅. 腹部核磁共振(MRI)及核磁共振血管成像(MRA): 肝右叶见大小约40 cm×20 cm×20 cm血管瘤, 肝左叶见直径约2 cm的小血管瘤, 肝固有动脉显影清晰, 肝左右动脉显影欠佳, 病变似为肝右动脉供血, 门静脉受压移位, 门脉主干、左支、肠系膜上静脉显影良好, 门静脉右支明显变细, 中远段显影欠佳, 下腔静脉受压变细, 肾静脉平面以下下腔静脉右壁与病变关系密切, 管壁毛糙, 第二肝门处下腔静脉较细, 肝中、右静脉显影良好.
2005-12-05全院术前讨论认为: 患者第1次术后左侧肝组织明显增生, 目前肝功能正常, 凝血功能接近正常, 心肺肾功能良好, 手术适应证存在, 无手术禁忌证. 2005-12-07在全麻下行肝右叶巨大血管瘤切除术. 手术经过: 先行上腹部正中切口, 长约25.0 cm, 逐层切开进腹探查: 见右肝叶巨大肿瘤占据腹腔及盆腔, 并越过中线占据左侧腹腔, 肿瘤与腹壁粘连. 分离粘连, 游离左侧肝脏, 可见左侧为代偿增大的肝脏左内叶, 大小约20 cm×15 cm, 质地及色泽类似于充血的脂肪肝. 右侧可触及巨大肿物, 因此向右侧延长切口到腋后线, 探查见血管瘤巨大, 上界突出到胸腔, 下达盆腔, 左侧越过中线约10 cm, 肿瘤表面充满迂曲血管. 游离肿瘤下端, 见其与其他组织压迫为主, 粘连不重. 显露解剖第一肝门, 胆囊附着在肿瘤之上, 分离胆囊三角, 切断胆囊管. 切断右肝动脉、右肝管、右肝门静脉. 解剖肝周粘连带(第1次手术时已切断的镰状韧带和左侧冠状韧带、三角韧带在肝脏周围形成粘连), 暴露第二肝门, 从右侧逐渐压迫推移血管瘤, 解剖、显露出肝右静脉. 离断来自膈肌和肾上腺的血管. 这样已经完全阻断进入肿瘤的血液供应. 分别阻断肝门15、16 min 2次, 完整切除肿瘤, 4-0血管线缝合右肝静脉残端. 肝断面彻底止血. 生理盐水冲洗腹腔. 摆正残肝位置, 可见其充血红润. 缝合后腹膜创面. 于膈肌下方放置腹腔引流2根. 逐层关腹.
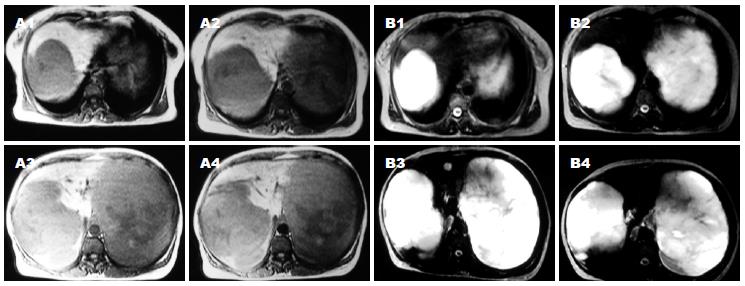
手术时间4.5 h. 手术顺利, 术后安全返回肝胆外科普通病房. 术中出血约800 mL, 回输自体血1 500 mL(均为术中回吸收血液, 包括所切除的血管瘤内积存的部分血液). 术后患者恢复较顺利, 切口甲级愈合, 术后9 d拔除腹腔引流管, 术后18 d出院. 术后病理诊断: 肝脏海绵状血管瘤. 出院时嘱患者6 mo后返院复查并决定是否行二期手术(图1-2).
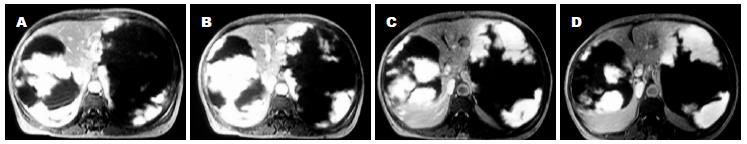
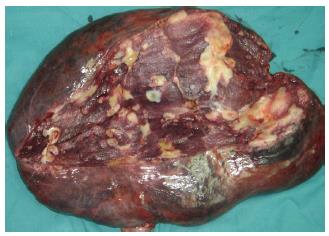
手术时间7.5 h, 基本顺利, 出血约1 200 mL, 输血浆600 mL, 悬浮红细胞600 mL. 切除的右侧肝脏巨大血管瘤组织大小约45 cm×25 cm×25 cm(图3-6), 胆囊附着其上. 术后病理: 肝脏海绵状血管瘤.
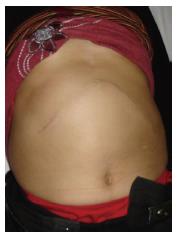
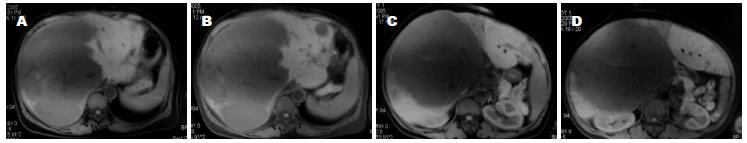
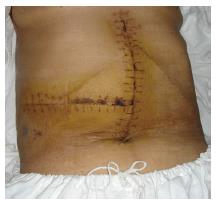
术后送入ICU加强监护1 d, 次日转回肝胆外科普通病房. 术后曾出现肝功能不全、凝血机制差、右侧胸腔积液、腹腔大量渗液(最多时每日1 500 mL血性腹水)等, 经积极保肝、补充血浆和白蛋白、补充凝血酶原复合物和纤维蛋白原、营养支持、抗感染等治疗, 病情逐渐稳定、好转. 1 wk后能进食少量流质饮食. 10 d后食欲逐渐好转, 纳食逐渐增多. 术后10 d拆线, 切口甲级愈合(图7). 术后16 d肝功能明显好转. 术后19 d拔除腹腔引流管. 术后20 d痊愈出院. 出院前化验电解质、血糖正常, 白蛋白34 g/L, 总蛋白60 g/L, 谷丙转氨酶71 U/L, 谷草转氨酶59 U/L, 胆红素正常, WBC 5.5×109/L, RBC 3.7×1012/L, PLT 363×109/L. 在家休养3 mo后即可正常工作, 无任何不适. 至今健康. 最近复查超声显示: 肝脏实质内小血管瘤大小约2.6 cm×2.9 cm. 化验血常规、肝功能及肾功能均正常.
巨大肝血管瘤可广泛破坏肝组织, 导致肝功能进行性减退, 有些还会引起消耗性凝血障碍[2], 所以对已确诊的巨大肝血管瘤应主张尽早积极手术治疗[3-11]. 但也有报道认为大部分肝脏大血管瘤趋于稳定, 对于无症状者可定期复查, 不予手术切除[12,13].
综合文献报道, 总结肝血管瘤的手术指征有以下几点[3-11]: (1)肿瘤直径≥10 cm; (2)肿瘤直径5-10 cm, 位于肝脏边缘, 有自发破裂的可能; (3)肿瘤生长较快, 腹痛、腹胀等症状明显, 或者腹部明显膨隆; (4)瘤体内出血、坏死、感染; (5)合并明显的贫血及血小板减少; (6)与肝癌不易鉴别; (7)多发性血管瘤, 其中一处与以上符合. 双侧肝叶血管瘤的外科治疗也同样遵循以上原则. 由于双侧巨大肝血管瘤同时挤压破坏正常肝组织, 后果非常严重, 因此, 应尽早切除. 但是, 一次完全切除双侧巨大肝血管瘤难度很高、风险很大.
双侧肝叶巨大海绵状血管瘤的治疗理论上可采用: (1)切除左侧巨大血管瘤, 同时结扎右侧血管瘤的门静脉分支以缩小右侧病灶并增加健侧门静脉血供, 从而促进剩余健康肝组织增生, 3-6 mo后再切除右肝巨大血管瘤; (2)切除左侧巨大血管瘤, 同时结扎肝右动脉(或通向右肝血管瘤的动脉)以减慢肿瘤生长速度, 二期手术时再切除右肝巨大血管瘤; (3)切除左侧巨大血管瘤, 待患者康复后视具体情况可采用介入方法堵塞患侧病灶的门静脉或/和肝动脉分支, 从而增加健侧门静脉血流, 再择期行右侧巨大肝血管瘤切除术; (4)切除左肝巨大血管瘤, 再视残余正常肝组织的增生体积和患者肝功能状况择期行二期右肝巨大血管瘤切除术, 该方法避免了手术结扎或者介入封堵患侧肝动脉或门静脉分支而造成的肝功能损害或其他不良并发症(比如误栓胆道血管而造成胆道坏死等), 这是较为稳妥可靠的治疗方法, 本例患者即采用此种分期手术方法, 获得了良好的效果; (5)原位肝移植, 这是在患者因肝脏多发巨大血管瘤致肝功能严重失代偿并且无法手术切除的情况下才予以考虑的最后治疗方案.
本例患者仅剩余左内叶为主的少量正常肝组织, 如果同时切除左、右肝巨大血管瘤, 不但术中会大量失血, 而且术后残余肝组织太少, 患者肯定会因为术后肝功能衰竭而危及生命. 因此, 我们采取分期手术, 首先切除左肝巨大血管瘤, 右肝巨大血管瘤留待以后二期切除.
制定此手术方案的原因主要有以下几点: (1)遵循安全原则, 先易后难, 因为左侧血管瘤切除相对于右侧难度较小; (2)也考虑到右侧肝脏巨大血管瘤紧紧靠近胸壁和腹壁, 生长空间相对左肝血管瘤较狭小, 可能生长速度较左肝血管瘤较缓慢; (3)首先切除左肝巨大血管瘤后残余正常肝组织向左侧及下方再生空间相对较大; (4)等到左侧肝组织明显增生、体积变大、肝功能正常后, 再择期切除右肝巨大血管瘤; (5)由于介入封堵或者结扎右侧肝动脉或者门静脉分支可导致肝功能进一步受损, 并有可能导致异位栓塞等不良并发症, 本例没有在首次手术同时结扎右侧肝动脉或门静脉分支, 也没有在首次术后介入封堵右侧肝动脉或门静脉分支. 本例患者由于术中失血较多, 两次手术中均收集自体血回输[14]. 一般认为两次手术间隔3-6 mo为宜[1]. 由于患者首次手术后残余健康肝组织体积很小, 术后再生缓慢, 为求得二期手术安全, 第二次手术距离第一次手术时间长达42 mo, 在此期间, 尽管肝左内叶明显增生变大, 但右肝巨大血管瘤也增大了1倍以上, 大大增加了二期手术难度. 在施行手术时, 有两种方法[4,15-17]: 血管瘤剥除术(摘除术)和连带附近肝叶切除术. 一般采用沿血管瘤包膜进行血管瘤摘除术, 这样出血较少, 能够保存较多正常肝组织[4,15-17]. 本例主要采用血管瘤摘除术, 同时也切除了部分相邻肝组织, 手术治疗效果非常满意. 通过本例患者, 我们认为对于双侧肝叶巨大血管瘤患者, 如果一次同时切除难度较大, 可以分期切除, 仍可获得良好疗效.
肝血管瘤是最常见的肝脏良性肿瘤. 巨大的肝血管瘤较为少见, 尤其是双侧肝叶同时发生特大血管瘤非常罕见, 其手术治疗非常困难, 往往需要分期切除.
彭吉润, 主任医师, 北京大学人民医院肝胆外科中心; 刘超, 副教授, 中山大学孙逸仙纪念医院肝胆胰外科; 陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科.
首先切除左肝巨大血管瘤, 再视残余正常肝组织的增生体积和患者肝功能状况择期行二期右肝巨大血管瘤切除术, 该方法避免了手术结扎或者介入封堵患侧肝动脉或门静脉分支而造成的肝功能损害或其他不良并发症(比如误栓胆道血管而造成胆道坏死等), 这是较为稳妥可靠的治疗方法, 本例患者即采用此种分期手术方法, 获得了良好的效果.
双侧肝叶巨大血管瘤可先切除左侧肝叶巨大血管瘤, 使正常肝组织解除压迫, 获得生长空间, 从而逐渐增生, 随后择期二期切除右侧肝叶巨大血管瘤.
本文作者报道1例双侧肝脏巨大血管瘤, 临床上罕见, 作者采取先左后右的分期切除手术, 避免了同时切除双侧巨大血管瘤可能出现的余肝体积太小所导致的肝功能衰竭; 尽管本例患者手术风险很大, 但通过此种稳妥的分期切除的方式, 取得了令人满意的疗效. 检索国内外文献, 类似报道较少, 对肝脏外科医生有较好的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Moldovan B, Copotoiu C, Bud V, Toma L, Ghiţescu I, Grigorescu B, Serac G, Munteanu M. [Two steps liver resection with right portal vein ligation for two giant hemangiomas of the left and right lobes]. Chirurgia (Bucur). 2006;101:529-532. [PubMed] |
| 2. | Concejero AM, Chen CL, Chen TY, Eng HL, Kuo FY. Giant cavernous hemangioma of the liver with coagulopathy: adult Kasabach-Merritt syndrome. Surgery. 2009;145:245-247. [PubMed] |
| 3. | Seo HI, Jo HJ, Sim MS, Kim S. Right trisegmentectomy with thoracoabdominal approach after transarterial embolization for giant hepatic hemangioma. World J Gastroenterol. 2009;15:3437-3439. [PubMed] |
| 4. | Belli G, D'Agostino A, Fantini C, Cioffi L, Belli A, Limongelli P, Russo G. Surgical treatment of giant liver hemangiomas by enucleation using an ultrasonically activated device (USAD). Hepatogastroenterology. 2009;56:236-239. [PubMed] |
| 5. | Ikegami T, Soejima Y, Taketomi A, Kayashima H, Sanefuji K, Yoshizumi T, Harada N, Yamashita Y, Maehara Y. Extracorporeal hepatic resection for unresectable giant hepatic hemangiomas. Liver Transpl. 2008;14:115-117. [PubMed] |
| 6. | Erdogan D, Busch OR, van Delden OM, Bennink RJ, ten Kate FJ, Gouma DJ, van Gulik TM. Management of liver hemangiomas according to size and symptoms. J Gastroenterol Hepatol. 2007;22:1953-1958. [PubMed] |
| 12. | Ng WW, Cheung YS, Lee KF, Wong J, Yu SC, Lee PS, Lai PB. Is regular follow-up scan for giant liver haemangioma necessary? Hong Kong Med J. 2007;13:353-358. [PubMed] |
| 13. | Herman P, Costa ML, Machado MA, Pugliese V, D'Albuquerque LA, Machado MC, Gama-Rodrigues JJ, Saad WA. Management of hepatic hemangiomas: a 14-year experience. J Gastrointest Surg. 2005;9:853-859. [PubMed] |
| 14. | Li MH, Yan LN, Wang SR. Autologous transfusion with modified total hepatic vascular exclusion for extracapsular resection of giant hepatic cavernous hemangioma. Hepatobiliary Pancreat Dis Int. 2007;6:43-48. [PubMed] |
| 15. | Singh RK, Kapoor S, Sahni P, Chattopadhyay TK. Giant haemangioma of the liver: is enucleation better than resection? Ann R Coll Surg Engl. 2007;89:490-493. [PubMed] |
| 16. | Hamaloglu E, Altun H, Ozdemir A, Ozenc A. Giant liver hemangioma: therapy by enucleation or liver resection. World J Surg. 2005;29:890-893. [PubMed] |
| 17. | Hazinedaroglu SM, Kayaoglu HA, Ali Yerdel M. Enucleation of centrally located giant hepatic hemangioma: report of two cases. Dig Dis Sci. 2006;51:1213-1217. [PubMed] |