修回日期: 2010-03-19
接受日期: 2010-03-23
在线出版日期: 2010-04-18
目的: 测定活化肝星状细胞(hepatic stellate cells, HSC)H2S的生成率及对细胞增殖的影响.
方法: 采用活化大鼠HSC-T6, 分4组: 对照组、炔丙基甘氨酸(D-Propargylglycine, DL-PPG)组、N-硝基-L-精氨酸甲酯(Nitro-L-arginine methyl ester, L-NAME)组、氯化高铁血红素(hemin)组, 每组重复6个皿. RT-PCR检测HSC-T6胱硫醚-γ-裂解酶(cystathionine-γ-lyase, CSE) mRNA水平, 亚甲基蓝分光光度法测定H2S生成率, MTT法观察不同浓度外源性H2S供体-NaSH(0, 50, 100, 500, 1000 μmol/L)对HSC-T6增殖的影响.
结果: HSC-T6能自分泌H2S, DL-PPG可明显减少HSC-T6 H2S生成率(4.55 nmol/min±1.06 nmol/min vs 6.79 nmol/min±1.27 nmol/min, P<0.05). RT-PCR显示: HSC-T6 CSE mRNA阳性, DL-PPG、hemin均降低HSC-T6 CSEmRNA水平(P<0.05); L-NAME对HSC-T6 CSE mRNA无明显影响. 50 μmol/L NaSH可明显促进HSC-T6增殖(细胞存活率为116%), 500-1000 μmol/L NaSH对细胞增殖无明显影响.
结论: 活化HSC自分泌H2S, 并且影响其增殖. H2S在肝纤维化及肝硬化门脉高压症的发生机制可能有重要作用.
引文著录: 武彦宁, 王利军, 翟云, 尚宏伟, 张立新, 丁惠国. 肝星状细胞合成气体信号分子H2S的测定及其意义. 世界华人消化杂志 2010; 18(11): 1152-1156
Revised: March 19, 2010
Accepted: March 23, 2010
Published online: April 18, 2010
AIM: To assess whether hydrogen sulphide (H2S) is produced by activated hepatic stellate cells (HSC) and to investigate the effects of exogenous H2S on HSC proliferation.
METHODS: HSC-T6, an activated rat HSC line, was used in the study. HSC-T6 cells were divided into four groups: control group, DL-PPG [D-propargylglycine, an inhibitor of cystathionine γ-lyase (CSE)] group, L-NAME (nitro-L-arginine methyl ester) group, and hemin [a stimulator of heme oxygenase-1 (HO-1)] group. HSC-T6 cell suspension (1×105 cells) was prepared with DMEM containing 10% fetal calf serum. The production of H2S was detected by methylene blue spectrophotometry. The expression of CSE mRNA was tested by reverse transcription-polymerase chain reaction (RT-PCR). Subsequently, the effects of different concentrations of sodium hydrosulfide (NaSH; 0, 50, 100, 500 and 1000 μmol/L), an exogenous H2S "donor", on HSC-T6 cell proliferation were observed by MTT assay.
RESULTS: The rate of production of endogenous H2S by HSC-T6 cells was 6.79 nmol/min ± 1.27 nmol/min. DL-PPG significantly inhibited H2S production (4.55 nmol/min ± 1.06 nmol/min, P < 0.05). CSE mRNA was positively expressed in HSC-T6 cells as revealed by RT-PCR. CSE mRNA expression was down-regulated in HSC-T6 cells treated with DL-PPG or hemin (both P < 0.05). NaSH at a concentration of 50 μmol/L significantly promoted cell proliferation. In contrast, NaSH at concentrations of 500-1000 μmol/L had no significant impact on cell proliferation.
CONCLUSION: Activated HSC can produce H2S. CSE may play an important role in the synthesis of H2S by HSC. Endogenous H2S produced by HSC may be related to the pathogenesis of cirrhotic portal hypertension.
- Citation: Wu YN, Wang LJ, Zhai Y, Shang HW, Zhang LX, Ding HG. Endogenous production of gaseous signal molecule hydrogen sulphide by activated hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2010; 18(11): 1152-1156
- URL: https://www.wjgnet.com/1009-3079/full/v18/i11/1152.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i11.1152
活化的肝星状细胞(hepatic stellate cell, HSC)在肝纤维化发生发展及调节肝内阻力、门静脉压力中具有重要作用[1]. 已经确定与HSC收缩、舒张密切相关的血管活性物质有血管紧张素、内皮素(endothelin-1, ET-1)和一氧化氮(nitric oxide, NO)、一氧化碳(carbon monoxide, CO)等[2,3], 硫化氢(hydrogen sulfide, H2S)是继NO和CO后新发现的气体信号分子, 内源性H2S是体内含硫氨基酸在胱硫醚-γ-裂解酶(cystathionine-γ-lyase, CSE)作用下产生的代谢产物, 具有多种生物学功能[4,5]. 最近研究发现[6], H2S气体信号分子可能通过影响肝内微血管收缩与舒张, 调节肝内阻力及门脉压力, 在门脉高压的发生机制中也有重要的作用. 但是, 活化的HSC是否能合成H2S及对HSC功能的影响仍不清楚.
HSC-T6为大鼠活化HSC系, 为SV40转染SD大鼠HSC, 由首都医科大学附属北京友谊医院肝病研究中心贾继东教授惠赠. 分光光度计(Tecan Systems, California, 美国), T28酶标仪(ASYS Hitech GmbH, 奥地利). DMEM(Dulbecco's Modified Eagle Medium)细胞培养液(Gibco BRC公司,美国). TE-HER Water-Jacket CO2孵育箱(Hirasawa公司, 日本). 胱硫醚-γ-裂解酶(cystathionine-γ-lyase, CSE)抑制剂-炔丙基甘氨酸组(D-Propargylglycine, DL-PPG、一氧化氮合酶抑制剂-N'-硝基-L-精氨酸甲酯组(nitro-L-arginine methyl ester, L-NAME)、血红素氧合酶(heme oxygenase-1, HO-1)刺激剂-氯化高铁血红素(hemin)及硫氢化钠(NaSH)购自美国Sigma公司.
1.2.1 细胞复苏与分组: 细胞于37℃快速复苏, 用含5%小牛血清的DMEM细胞培养液制备为1×105个HSC悬液, 接种于75 mm细胞培养瓶中, 培养液总体积为4 mL. 在950 mL/L O2+50 mL/L CO2, 37 ℃条件下, CO2培养箱内培养24 h, 细胞完全贴壁后分4组: 对照组; DL-PPG组(终浓度为2 mmol/L); L-NAME组(终浓度为300 μmol/L); hemin组(终浓度为10 μmol/L), 每组重复6个培养皿, 常规方法培养.
1.2.2 H2S生成率测定: 参考石玲等报道的亚甲基蓝分光光度法测定H2S生成率[7]. 收集并计数上述培养细胞, 加入到1.5 mL EP管中, 50 μmol/L的磷酸钾溶液至400 μL, 以超声波打碎细胞. 置入37 ℃温箱15 min. 在细胞匀浆内加入如下反应液: 400 μL的细胞裂解液, 5 mmol的左旋半胱氨酸, 2 mmol/L的5'-磷酸吡多醛3.6 mL. 将反应液移至反应瓶, 吸取0.5 mL的1%醋酸锌加入中央室另裁剪2 cm×2.5 cm滤纸以增加反应面积. 氮气吹20 s, 石蜡膜双层封口转移到37 ℃水浴锅中震荡反应90 min, 再加入50%的三氯醋酸0.5 mL中止反应, 石蜡膜封闭. 37 ℃水浴60 min使H2S完全吸收, 将中央室中内容物转移到含有3.5 mL水的试管中, 另设一只含3.5 mL水的试管作为空白管, 立即加入20 mmol/L的对苯二胺盐酸盐0.5 mL和30 mmol/L的FeCl3 50 μL, 室温静置20 min, 使之充分显色. 以空白管调零, 670 nm波长, 分光光度计测各测试管A值. 根据制备的NaHS标准曲线, 计算出每106个细胞中H2S的生成率, 以nmol/min为单位.
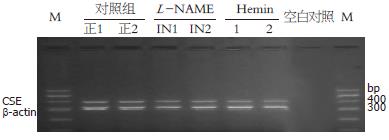
1.2.3 RT-PCR测定CSE mRNA: 应用TRIzol试剂, 按说明书提取细胞总RNA, 紫外分光光度计定量. 取2 μg总RNA, 用M-MLV逆转录酶(Moloney Murine Leukemia Virus Reverse Transcriptase)和Oligo d(T)15引物逆转录成cDNA. 以β-actin为内参, PCR反应体系25 μL, 包括: cDNA 1 μL, 含20 mmol/L氯化镁的10×PCR缓冲液2.5 μL, 10 mmol/L dNTP 0.5 μL, 5 pmol/L CSE引物(S+A)1 μL, 25 pmol/L β-actin(S+A)1 μL, Taq DNA聚合酶0.5 μL. 引物序列为: CSE(S): 5'- TCC GGA TGG AGA AAC ACT TC-3', CSE(A): 5'-GCT GCC TTT AAA GCT TGA CC-3'. β-actin(S): 5'-ATC ATG TTT G AG ACC TTC AAC A-3', β-actin(A): 5'-CAT CTC TTG CTC GAA GTC CA-3'. 常规PCR扩增, PCR产物以2%琼脂糖凝胶电泳分离和溴化乙锭染色, 凝胶成像分析系统(AlphaImager AphaInnotechca, 美国)测定400 bp和318 bp两条带的吸光度.
1.2.4 MTT测定细胞增殖: 复苏后处于对数生长期的HSC-T6, 细胞密度为2×104/孔接种于96孔培养板中, 培养基为含5%小牛血清的DMEM 200 μL, 常规培养24 h; 加入不同浓度NaSH(0, 50, 100, 500, 1 000 μmol/L) , 每个浓度重复6孔. 培养24 h后吸出培养液, 加入0.5 g/L的MTT 100 μL作用4 h. 在570 nm波长T28酶标仪测定各孔A值, 计算细胞生存率.
统计学处理 数据用mean±SD表示. 采用SPSS11.5统计软件进行ANOVA方差分析及t检验, P<0.05为差异有统计学意义.
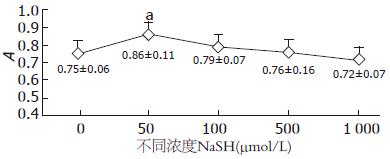
常规培养下细胞活性良好. 50 μmol/L NaSH可明显促进 HSC-T6增殖(细胞存活率116%), 与对照组比较有明显统计学差异(P<0.05). 100 μmol/L NaSH HSC-T6细胞存活率为105%, 与对照组比较无明显统计学差异(P>0.05). 随着NaSH浓度的增加, HSC的存活率有降低趋势, 500-1 000 μmol/L NaSH对细胞增殖无明显统计学差异(图1).
活化HSC H2S生成率为6.79 nmol/min±1.27 nmol/min, 加入CSE抑制剂-DL-PPG后, H2S生成率明显降低(4.55 nmol/min±1.06 nmol/min, P<0.05). 提示CSE是HSC-T6合成H2S的关键酶. 同时初步发现, L-NAME、Hemin对活化HSC H2S生成率无明显影响(表1).
迄今, 肝硬化门脉高压症的发生机制及病理生理尚未完全阐明. 在肝硬化门脉高压的形成机制中, 肝内阻力增加是门脉高压的始动因素, 全身高动力循环和内脏充血则是门脉高压持续进展的重要因素[2]. 近20年研究证明[3]: 活化HSC在调节肝内阻力及肝窦血流量中具有重要作用. 正常情况下, HSC位于Disse间隙, 是VitA在肝脏的贮存场所, 因此, 也称之为贮脂细胞(storing-fat cell). 当肝脏受到损伤时, HSC活化转化为成纤维母细胞, 合成与分泌大量胶原蛋白, 与肝脏纤维化有密切关系[1,3]. 近年来研究发现, 活化的HSC还表达平滑肌细胞特有的Desmin蛋白及具有细胞收缩装置的微丝、微管系统, 决定了HSC具有平滑肌细胞相似的舒张与收缩功能[8]. HSC收缩的结果是使肝窦阻力增加, 这种病理生理改变是肝硬化门脉高压症发生、发展的基础. 因此, 设计以HSC为靶点的药物, 是临床防治门脉高压症的新策略[3].
H2S是继NO和CO后新发现的第三个内源性气体信号分子. H2S在体内有两种形式存在: 1/3的H2S在体内以气体分子存在, 2/3以NaSH形式存在, 这样, 既保证了H2S在体内的稳定, 又不改变内环境pH值. 内源性H2S是由体内含硫氨基酸在胱硫醚-β-合酶(cystathionine-β-synthetase, CBS)、CSE作用下的代谢终末产物[9], 具有重要、广泛的生物学功能[4]. CBS主要存在于神经系统内, 也存在于肝脏、肾脏; CSE主要存在于主动脉、肺动脉、肠系膜动脉和肝脏[9,10]. H2S、NO、CO三种气体信号分子均具有明显的舒张血管作用, 三者之间相互作用, 在高血压及肺动脉高压的病理生理机制中具有重要作用[5,11]. 其中, NO在调节血管局部张力中具有主要作用[4]. 肝内阻力增加主要归因于肝内血管活性物质的生成及代谢失衡, 即肝窦NO缺乏和收缩血管活性的物质增加[3]. 在肝硬化模型中也发现, 肝内NO含量减少主要归因于血管内皮一氧化氮合酶(eNOS)活性的减弱[12]. 同时, 也发现肝脏HSC对血管舒张因子的反应性受损、敏感性减弱, 在门脉血流阻力增加中也起很重要的作用[3,12]. H2S如何影响NO产生? 研究发现[13,14], 单独应用H2S引起的血管舒张效应很微弱, 而在NO存在情况下, 血管舒张效应增加13倍. 其可能机制是, 一方面NO可以通过增加血管平滑肌CSE的活性; 另一方面NO还可以直接增加平滑肌CSE的转录, 从而上调CSE表达. 因此, 推测NO可能促进HSC合成、分泌H2S. 但是, 本研究初步结果发现, 通过一氧化氮合酶抑制剂-L-NAME, 抑制HSC NO产生, 其结果对H2S生成率无明显影响.
研究也发现, CO和H2S通过调节血管平滑肌的舒缩、增殖和凋亡, 从而参与高血压的发病过程[4,11]. 低氧性肺动脉高压大鼠中, H2S可上调肺动脉平滑肌细胞NO合成与分泌, 而给予NO底物后显著抑制血管平滑肌细胞中H2S生成, CSE mRNA的转录也明显下调, 提示NO对低氧性动脉高压大鼠血管平滑肌细胞H2S/CSE体系发挥抑制作用[13,14]. 在肝硬化门脉高压发生机制及高动力循环中, H2S/CSE是否有相似的调节作用, 仍不清楚[15]. 近年来, Fiorucci等[6]报道, 在CCl4大鼠肝硬化模型中发现, 肝脏组织H2S生成明显减少, 肝内阻力增加. 然而, H2S在肝脏的生成部位其机制仍不清楚. 研究发现[16], 低浓度H2S通过激活细胞KATP通道, 从而降低细胞内Ca2+浓度, 而高浓度H2S刺激细胞内Ca2+浓度增加, 提示H2S可能通过调节HSC Ca2+浓度, 从而影响HSC的生物学功能, 在调节肝脏微循环中也具有重要作用. 本研究发现, 活化HSC CSE mRNA阳性, 并且自分泌H2S; DL-PPG, CSE酶抑制剂, 可明显抑制HSC H2S的生成. 一定浓度(50 μmol/L)NaSH-H2S供体, 对HSC具有促增殖作用. 我们推测, 一定浓度H2S可能通过调节HSC收缩与增殖, 从而调节肝窦阻力的作用, 这可能是H2S在肝硬化门脉高压发生机制中的作用之一. 最近研究发现[17], H2S作为新的炎症介质, 可能在肝脏损伤的机制中也具有重要作用. 因此, 在肝硬化门脉高压的发生机制中, 肝脏H2S来源、CSE酶活性及其影响因素仍值得研究, 阐明H2S、NO及CO的相互关系及其机制, 可能为门脉高压的预防及治疗带来新策略.
感谢首都医科大学附属北京友谊医院肝病研究中心马红、贾继东教授在实验过程中的支持和帮助.
H2S、NO、CO三种气体信号分子均具有明显的舒张血管作用, 三者之间相互作用, 调节机体重要的生物学功能. H2S、NO、CO气体信号分子可能通过影响肝内阻力及门脉压力, 在肝硬化门脉高压症的病理生理机制具有重要作用.
范建高, 教授, 上海交通大学医学院附属新华医院消化内科.
H2S在高血压及肺动脉高压的病理生理机制的作用是国内外学者研究的热点.
本研究首次证明了肝脏活化HSC自分泌H2S, 并且影响其增殖, 认为H2S在肝损伤及肝硬化门脉高压症的发生机制中可能有重要作用.
阐明肝脏H2S的来源及H2S、NO及CO的相互关系及其机制, 可能为肝脏损伤及肝硬化门脉高压症的预防及治疗带来新策略.
H2S: 内源性H2S是由体内含硫氨基酸在胱硫醚-β-合酶、胱硫醚-γ-裂解酶作用下的代谢终末产物, 具有多种重要生物学功能的气体信号分子.
本研究选题有一定新意, 设计合理.
编辑: 李军亮 电编:吴鹏朕
| 1. | Reynaert H, Thompson MG, Thomas T, Geerts A. Hepatic stellate cells: role in microcirculation and pathophysiology of portal hypertension. Gut. 2002;50:571-581. [PubMed] |
| 2. | Garcia-Tsao G, Bosch J, Groszmann RJ. Portal hypertension and variceal bleeding--unresolved issues. Summary of an American Association for the study of liver diseases and European Association for the study of the liver single-topic conference. Hepatology. 2008;47:1764-1772. [PubMed] |
| 5. | Yang G, Wu L, Jiang B, Yang W, Qi J, Cao K, Meng Q, Mustafa AK, Mu W, Zhang S. H2S as a physiologic vasorelaxant: hypertension in mice with deletion of cystathionine gamma-lyase. Science. 2008;322:587-590. [PubMed] |
| 6. | Fiorucci S, Antonelli E, Mencarelli A, Orlandi S, Renga B, Rizzo G, Distrutti E, Shah V, Morelli A. The third gas: H2S regulates perfusion pressure in both the isolated and perfused normal rat liver and in cirrhosis. Hepatology. 2005;42:539-548. [PubMed] |
| 8. | 丁 惠国, 尚 宏伟, 王 兴翠, 唐 淑珍, 孙 异临, 贾 继东, 赵 春惠, 王 宝恩. 复方861对HSC超微结构及细胞骨架蛋白的影响. 中华肝脏病杂志. 2005;13:553-554. |
| 9. | Wang R. Two's company, three's a crowd: can H2S be the third endogenous gaseous transmitter? FASEB J. 2002;16:1792-1798. [PubMed] |
| 10. | Li L, Bhatia M, Moore PK. Hydrogen sulphide--a novel mediator of inflammation? Curr Opin Pharmacol. 2006;6:125-129. [PubMed] |
| 11. | Li W, Jin HF, Liu D, Sun JH, Jian PJ, Li XH, Tang CS, DU JB. Hydrogen sulfide induces apoptosis of pulmonary artery smooth muscle cell in rats with pulmonary hypertension induced by high pulmonary blood flow. Chin Med J (Engl). 2009;122:3032-3038. [PubMed] |
| 12. | Bosch J, Abraldes JG, Berzigotti A, Garcia-Pagan JC. Portal hypertension and gastrointestinal bleeding. Semin Liver Dis. 2008;28:3-25. [PubMed] |
| 13. | Yanfei W, Lin S, Junbao D, Chaoshu T. Impact of L-arginine on hydrogen sulfide/cystathionine-gamma-lyase pathway in rats with high blood flow-induced pulmonary hypertension. Biochem Biophys Res Commun. 2006;345:851-857. [PubMed] |
| 15. | Ebrahimkhani MR, Mani AR, Moore K. Hydrogen sulphide and the hyperdynamic circulation in cirrhosis: a hypothesis. Gut. 2005;54:1668-1671. [PubMed] |
| 16. | Zhao W, Zhang J, Lu Y, Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. EMBO J. 2001;20:6008-6016. [PubMed] |
| 17. | Zhang H, Bhatia M. Hydrogen sulfide: a novel mediator of leukocyte activation. Immunopharmacol Immunotoxicol. 2008;30:631-645. [PubMed] |