修回日期: 2010-02-10
接受日期: 2010-02-23
在线出版日期: 2010-04-08
目的: 探讨黄芪注射液对实验性急性胰腺炎大鼠NF-κB活性、NF-κB mRNA及TNF-α mRNA的影响.
方法: ♂SD大鼠60只, 随机分为假手术组、模型组和黄芪小剂量治疗组[0.10 mL/(100 g•d)]、中剂量治疗组[0.15 mL/(100 g•d)]、大剂量治疗组[0.20 mL/(100 g•d)]. 用5%牛磺胆酸钠胰管内注入[0.10 mL/(100 g•d)]诱导大鼠急性胰腺炎模型, 黄芪注射液各组造模前30 min给予黄芪注射液尾静脉注射, 造模6 h后处死大鼠取胰腺组织标本. 光镜观察胰腺组织的病理变化, 并对胰腺组织标本进行病理评分; 免疫组织化学法测定胰腺细胞NF-κB活性, RT-PCR法检测胰腺组织中NF-κB mRNA和TNF-α mRNA表达.
结果: 与假手术组比较, 模型组胰腺组织病理评分、NF-κB活性及TNF-α mRNA表达显著增加(P<0.01); 与模型组比较, 治疗各组病理评分、NF-κB活性及TNF-α mRNA表达显著下降(P<0.05或0.01). NF-κB活性及TNF-α mRNA表达呈正相关关系(r = 0.542, P<0.05), 各组NF-κB mRNA的表达均为阳性, 差异无显著性(P>0.05).
结论: 活化的NF-κB可通过上调TNF-α mRNA的表达参与急性胰腺炎的发生、发展, 黄芪注射液能显著降低实验性急性胰腺炎大鼠的NF-κB活性、TNF-α mRNA表达, 从而减轻急性胰腺炎损害程度.
引文著录: 张超贤, 郭晓凤, 秦咏梅. 黄芪注射液对急性胰腺炎大鼠NF-κB活性、NF-κB及TNF-α mRNA表达的影响. 世界华人消化杂志 2010; 18(10): 1051-1055
Revised: February 10, 2010
Accepted: February 23, 2010
Published online: April 8, 2010
AIM: To investigate the effects of Huangqi Injection on nuclear factor-κB (NF-κB) activity and NF-κB and tumor necrosis factor-α (TNF-α) mRNA expression in rats with acute pancreatitis.
METHODS: Sixty male Sprague-Dawley rats were randomly divided into five groups: sham-operation group, model control group, and low- [0.10 mL/(100 g•d)], medium- [0.15 mL/(100 g•d)] and high-dose [0.20 mL/(100 g•d)] Huangqi Injection groups. Acute pancreatitis was induced by injection of 5% sodium taurocholate [0.10 mL/(100 g•d)] into the pancreatic duct of rats. Huangqi Injection was injected into the tail vein 30 min before sodium taurocholate injection in the three treatment groups. The rats were killed 6 h after sodium taurocholate injection. The histomorphologic structure of the pancreas was observed under an optical microscope, and the severity of pancreatitis was evaluated using a pathologic grading system. The NF-κB activity in pancreatic acinar cells was determined by immunohistochemistry. The expression of NF-κB and TNF-α mRNAs in the pancreas was measured by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Compared with the sham-operation group, the pathologic grading score, NF-κB activity and TNF-α mRNA expression level increased obviously in the model group (both P < 0.01). The pathologic grading score, NF-κB activity and TNF-α mRNA expression level were significantly lower in the treatment groups than in the model group (all P < 0.05 or 0.01). A positive correlation was noted between NF-κB activity and TNF-α mRNA expression level (r = 0.542, P < 0.05). No significant difference was noted in NF-κB mRNA expression level among each group (all P > 0.01).
CONCLUSION: NF-κB activity and TNF-α mRNA expression are closely related with the severity of acute pancreatitis. Active NF-κB may play an important role in the pathogenesis of acute pancreatitis by up-regulating TNF-α mRNA expression. Huangqi Injection can significantly decrease NF-κB activity and TNF-α mRNA expression and therefore alleviate pancreatic injury in rats with acute pancreatitis.
- Citation: Zhang CX, Guo XF, Qin YM. Huangqi Injection reduces NF-κB activity and down-regulates TNF-α mRNA expression in rats with acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2010; 18(10): 1051-1055
- URL: https://www.wjgnet.com/1009-3079/full/v18/i10/1051.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i10.1051
急性胰腺炎(acute pancreatitis, AP)时, 炎症介质、细胞因子的过量产生与全身各系统的炎症反应(systemic inflammatory response syndrome, SIRS)和多器官功能衰竭(multiple organ dysfunction, MODF)的出现呈明显的因果关系[1]. 核转录因子-κB(nuclear factor kappa B, NF-κB)是一种能与体内多种细胞基因启动子部位相结合的核蛋白, 在机体的免疫和炎症反应、凋亡调控等方面发挥重要作用, 其过度活化可引起多种病理生理反应. 在AP发生、发展过程中NF-κB的过度活化可引起多种炎症反应相关基因的表达上调, 导致炎症介质、细胞因子的大量产生而参与AP的炎症反应进程[2]. 中药黄芪对AP有良好的治疗作用[3,4], 但这种作用是否与影响NF-κB活性及下游炎症因子的表达有关尚不清楚. 本实验旨在通过大鼠实验性AP时NF-κB活性及TNF-α mRNA的变化及黄芪处理对其影响的观察, 进一步探讨黄芪治疗AP的作用机制.
成年健康清洁级SD大鼠60只, ♂, 体质量220-250 g, 由新乡医学院实验动物中心提供. 黄芪注射液(地奥成都地奥九泓制药厂生产, 批号: 0706071, 每支10 mL, 相当于20 g生药), 牛黄胆酸钠(Sigma公司), NF-κB鼠单克隆抗体(Santa Cruz公司). DelDoc2000凝胶扫描仪(BLO-Rad公司, 美国), TRIzol试剂(美国Invitrogen公司), TNF-α、NF-κB及β-actin引物(上海生工生物工程公司), RT-PCR(一步法)试剂盒(宝生物工程有限公司).
1.2.1 急性胰腺炎模型建立: SD大鼠术前禁食12 h, 自由饮水, 随机分为5组: 假手术组、模型组、黄芪注射液小剂量组、中剂量组和大剂量组, 各12只. 参考文献[5,6]方法造模, 戊巴比妥钠35 mg/kg腹腔注射麻醉, 正中切口入腹, 入腹后寻及十二指肠, 于主胰管开口附近十二指肠系膜对缘切开十二指肠, 置一细塑料管于主胰管内, 用无损伤动脉钳夹闭胆胰管近肝门端, 经细塑料管缓慢注入5%牛磺胆酸钠(0.1 mL/100 g), 滞留5 min后拔去塑料管, 松开动脉钳, 缝合十二指肠, 关闭腹腔. 黄芪注射液各组在造模前30 min分别给予黄芪注射液0.10、0.15及0.20 mL/(100 g•d)尾静脉注射, 模型组在造模前予0.15 mL/(100 g•d)生理盐水注射, 假手术组注射生理盐水时间、剂量、途径均同模型组, 进腹后仅显露、牵拉十二指肠即关腹. 造模后6 h, 处死动物并剖腹, 快速切取胰腺组织供实验用.
1.2.2 胰腺组织病理观察: 取胰腺脾侧叶用200 g/L甲醛固定, 石蜡包埋, HE染色, 用于胰腺组织形态观察、光镜观察. 胰腺病理学评分, 胰腺组织病理积分参照评分标准参照相关文献[7]的标准.
1.2.3 NF-κB活性的检测: 胰腺4 μm厚石蜡切片, 常规脱蜡, 乙醇梯度脱水, 3% H2O2灭活内源性过氧化物酶以修复抗原, 5%羊血清封闭30 min, 1:100的NF-κB p65(一抗)37 ℃孵育1 h, 滴加羊抗兔IgGHRP室温15 min, DAB显色, 苏木素复染, 切片烤干封片. 阴性对照用PBS代替一抗. 阳性反应细胞胞质、胞核呈棕黄色染色. 在3个高倍镜视野下观察阳性细胞数N1和总细胞数N, 阳性率 = N1/N×100%.
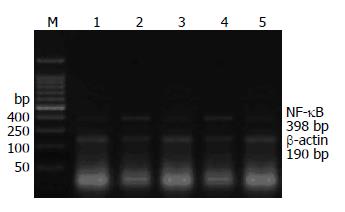
1.2.4 NF-κB mRNA的检测: 采用RT-PCR法检测NF-κB mRNA, NF-κB p65引物序列: 上游5'-GAAGAAGCGAGACCTGGAG-3', 下游5'-TCCGGAACACAATGGCCAC-3', 扩增产物长度398 bp. 内参β-肌动蛋白序列: 上游5'-TCCTAGCACCATGAAGATC-3', 下游5'-AAACGCAGCTCAGTAACAG-3', 扩增产物长度190 bp. PCR条件: 各扩增管先置于55 ℃水浴逆转录40 min, 然后直接置PCR扩增仪94 ℃变性45 s, 54 ℃退火45 s, 72 ℃延伸60 s, 共40个循环, 再72 ℃延伸5 min, PCR产物在1.5%琼脂糖凝胶上电泳, 在凝胶成像系统中计算NF-κB p65 mRNA与β-肌动蛋白的吸光度比值.
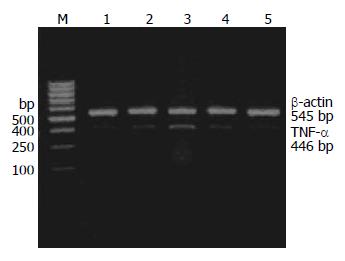
1.2.5 TNF-α mRNA的检测: 用TRIzol(Invitrogen公司)抽提RNA后, RT-PCR半定量法检测mRNA表达量, 以β-actin为内参照. TNF-α上游引物序列: 5'-TCTCAAAACTCGAGTGACAAG-3'; TNF-α下游引物序列为: 5'-AGTTGGTTGTCTTTGAGATCC-3', 产物长度446 bp; 设β-actin为内参照, 其上流引物序列为5'-TGGTACCACTGGCATTGTGA-3', 下游引物序列为5'-TCCTGCTTGCTGATCCACAT-3', 产物长度545 bp. 反应条件: 50 ℃ l h, 90 ℃ 5 min; 94 ℃ 30 min, 65 ℃ 30 min, 68 ℃ l min 30个循环; 65 ℃延伸2 min, 4 ℃保存. 2.0 g/L的琼脂糖凝胶电泳, 在凝胶成像系统中计算TNF-α mRNA与β-肌动蛋白的电泳条带的吸光度比值.
统计学处理 用SPSS11.5统计学软件进行分析, 数据以mean±SD表示, 组间比较经方差齐性检验示方差齐, 进行单因素方差分析. 相关分析采用直线相关的积差相关分析, 以P<0.05为有统计学意义.
假手术组胰腺正常, 小叶结构存在, 间质清晰. AP组小叶结构破坏, 腺泡排列紊乱, 间质明显水肿、出血、红细胞呈片状冲毁胰腺组织, 炎症细胞明显浸润; 大片腺细胞溶解坏死, 细胞膜溶解, 核消失. 黄芪治疗组可见胰腺小叶结构破坏明显减轻. 间质水肿好转, 变性情况明显改善, 炎细胞浸润减少. 胰腺细胞较清晰, 排列较整齐. 各组胰腺病理评分见表1.
模型组胰腺组织NF-κB活性、TNF-α mRNA表达较假手术组显著增高, 治疗组胰腺组织NF-κB活性、TNF-α mRNA表达明显低于模型组(P<0.01), 两指标呈正相关关系(r= 0.542, P<0.05), 模型组 NF-κB mRNA较假手术组有所升高, 治疗组较模型组有所降低, 但差异无统计学意义(P>0.05, 表1, 图1, 2).
TNF-α被认为是在AP中最早升高并起着重要作用的细胞因子, 是与重症急性胰腺炎(severe acute pancreatitis, SAP)的严重性相关并可作为SAP预后的指标之一[8]. 较高浓度的TNF-α不但具有直接损伤机体细胞的作用, 还能够诱发和调控多种炎性细胞因子如IL-1、IL-6、IL-8等的释放, 直接和间接参与引起了机体内两次高水平细胞因子血症, 引起炎症瀑布样级联反应, 进而导致SIRS并继发MODS[9,10]. NF-κB活化是众多炎症介质作用机制的共同通道, 诸多炎症因子在基因水平上都受到NF-κB的调控. NF-κB是一种具有多向转录调节作用的蛋白, p50/p65异源二聚体是NF-κB活化的最常见形式. 生理情况下NF-κB同其抑制因子(inhibitor of NF-κB, IκB)结合以无活性状态存在于细胞质内; 疾病过程中, 内毒素、脂多糖、磷脂酶A、溶血磷脂酰胆碱、氧化应激代谢产物、病毒、缺血-再灌注等均可诱导IκB的磷酸化和蛋白降解, 使IκB和NF-κB分离, NF-κB便迅速活化, 然后进入细胞核, 与其靶基因上的启动子或增强子结合而调节基因转录, 激活与细胞应激相关的基因和炎症早期反应基因, 如细胞因子、生长因子和急性期蛋白等, 产生大量的包括TNF-α、IL-1β等炎症因子. 另外, TNF-α等细胞因子也可以通过激活NF-κB诱导激酶(NIK)和丝裂原蛋白激酶的激酶1(MEKK1), 从而使IKK磷酸化而激活, 激活后的IKK再使IκB磷酸化, 后者最后被蛋白酶降解, 从而使NF-κB游离出来而活化, 使信号进一步放大[11]. 大量研究表明, NF-κB在AP中高度表达并诱导TNF-α、IL-1β、IL-6大量表达在AP中发挥重要的作用[12]. 研究显示, 用N-乙酰半胱氨酸(N-acetylcysteine, NAC)阻滞NF-κB活性, 能显著减少胰腺炎症细胞浸润, 降低TNF-α、IL-6等细胞因子基因表达, 有效改善胰腺组织炎症反应[13], 说明NF-κB在SAP发生与发展中发挥关键作用. 这些研究提示通过抑制NF-κB活化进而下调TNF-α mRNA表达是有效改善胰腺炎症损伤一个重要途径.
本研究显示, 模型组大鼠胰腺组织NF-κB活性、TNF-α mRNA表达与假手术组比较明显增高(P<0.01), 两者呈同一化的进程, 且与病理上胰腺炎症损害严重程度相平行, 这印证了细胞因子在体内呈现网络式的调节, 在AP的发生、发展过程中发挥着重要作用. 研究显示大鼠胰腺组织中NF-κB mRNA在各组间表达差异不明显, 提示NF-κB的活性并非完全由NF-κB mRNA表达所决定. NF-κB mRNA的表达从分子角度反映了基因的转录水平, 转录水平越高, NF-κB表达的数量越多, 一定程度上就可提高NF-κB的活性, 但NF-κB活性变化是受多因素影响的, 在AP发生发展过程中, NF-κB活性的增强主要是因为活化因素的变化导致, 而非NF-κB mRNA表达增多所致, 所以抑制NF-κB活性的有效手段是减少NF-κB活化因素、阻断NF-κB活化途径.
本研究显示黄芪注射液能显著降低大鼠模型胰腺组织NF-κB活性、TNF-α mRNA, 表明其能抑制NF-κB活性, 下调TNF-α等多种炎性因子基因的表达, 使炎症介质、细胞因子的产生减少, 减轻AP的炎症反应, 其机制可能是: (1)AP发生时机体内氧自由基产生增加, 大量产生的氧自由基可以一方面引发链式脂质过氧化反应损伤细胞膜, 产生大量脂质过氧化物, 而氧自由基和脂质过氧化物都是NF-κB重要刺激物, 黄芪有效成分硒、黄芪多糖、木糖-葡萄糖-环黄芪醇可启动DNA修补酶、刺激抗体产生、清除有害自由基, 启动使谷胱甘肽过氧化物酶、阻止黄嘌呤及黄嘌呤酶的氧化损伤发挥抗氧化作用, 抑制的脂质过氧化物的生成[14]; (2)黄芪甲苷可阻止TNF-α、细菌脂多糖诱导NF-κB的核移位与靶基因的κB位点的结合, 从而抑制TNF-α等相应基因的转录[15]. 这就从基因分子水平角度解释了黄芪治疗AP的机制.
急性胰腺炎时, 炎症介质、细胞因子的过量产生与全身各系统的炎症反应和多器官功能衰竭的出现呈明显的因果关系. 核转录因子-κB(NF-κB)是一种能与体内多种细胞基因启动子部位相结合的核蛋白, 在机体的免疫和炎症反应、凋亡调控等方面发挥重要作用, 其过度活化可引起多种病理生理反应. 在AP发生、发展过程中NF-κB的过度活化可引起多种炎症反应相关基因的表达上调, 导致炎症介质、细胞因子的大量产生而参与AP的炎症反应进程.
陈光, 教授, 吉林大学第一医院消化器官外科
抑制NF-κB活化进而下调下游炎症因子的表达是有效改善胰腺炎损伤一个重要途径. 中药黄芪对AP有良好的治疗作用, 但这种作用是否与影响NF-κB活性及下游炎症因子的表达有关尚不清楚.
TNF-α被认为是在AP中最早升高并起着重 要作用的细胞因子, 是与重症急性胰腺炎(SAP)的严重性相关并可作为SAP预后的指标之一, NF-κB活化是众多炎症介质作用机制的共同通道, 诸多炎症因子在基因水平上都受到NF-κB的调控.
本研究首次通过大鼠实验性AP时NF-κB活性及TNF-α mRNA的变化及黄芪处理对其影响的观察, 探讨黄芪治疗AP的作用机制.
本研究的贡献是从基因分子水平解释了黄芪治疗急性胰腺炎的机制, 对临床治疗有指导意义.
编辑: 李军亮 电编:何基才
| 2. | Algül H, Tando Y, Schneider G, Weidenbach H, Adler G, Schmid RM. Acute experimental pancreatitis and NF-kappaB/Rel activation. Pancreatology. 2002;2:503-509. [PubMed] [DOI] |
| 5. | Zhang XH, Zhu RM, Xu WA, Wan HJ, Lu H. Therapeutic effects of caspase-1 inhibitors on acute lung injury in experimental severe acute pancreatitis. World J Gastroenterol. 2007;13:623-627. [PubMed] [DOI] |
| 6. | Rau B, Paszkowski A, Lillich S, Baumgart K, Möller P, Beger HG. Differential effects of caspase-1/interleukin-1beta- converting enzyme on acinar cell necrosis and apoptosis in severe acute experimental pancreatitis. Lab Invest. 2001;81:1001-1013. [PubMed] [DOI] |
| 7. | Zhang XP, Zhang L, He JX, Zhang RP, Cheng QH, Zhou YF, Lu B. Experimental study of therapeutic efficacy of Baicalin in rats with severe acute pancreatitis. World J Gastroenterol. 2007;13:717-724. [PubMed] [DOI] |
| 9. | Zyromski N, Murr MM. Evolving concepts in the pathophysiology of acute pancreatitis. Surgery. 2003;133:235-237. [PubMed] [DOI] |
| 10. | Zhang Q, Ni Q, Cai D, Zhang Y, Zhang N, Hou L. Mechanisms of multiple organ damages in acute necrotizing pancreatitis. Chin Med J (Engl). 2001;114:738-742. [PubMed] |
| 11. | Bonizzi G, Karin M. The two NF-kappaB activation pathways and their role in innate and adaptive immunity. Trends Immunol. 2004;25:280-288. [PubMed] [DOI] |
| 12. | Vaquero E, Gukovsky I, Zaninovic V, Gukovskaya AS, Pandol SJ. Localized pancreatic NF-kappaB activation and inflammatory response in taurocholate-induced pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1197-G1208. [PubMed] |
| 13. | 邹 忠东, 张 再重, 宋 香全, 王 烈, 涂 小煌, 陈 少全, 王 瑜. N-乙酰半胱氨酸对重症急性胰腺炎大鼠肝损伤的保护作用. 世界华人消化杂志. 2008;16:3894-3899. [DOI] |
| 15. | Zhang WJ, Hufnagl P, Binder BR, Wojta J. Antiinflammatory activity of astragaloside IV is mediated by inhibition of NF-kappaB activation and adhesion molecule expression. Thromb Haemost. 2003;90:904-914. [PubMed] |