修回日期: 2010-01-18
接受日期: 2010-01-26
在线出版日期: 2010-04-08
目的: 研究乙型肝炎病毒复制子pHY106-BHBV转染肝癌细胞系基因表达谱的差异, 分析参与胆固醇代谢的差异表达基因.
方法: 应用包含20 000条人类全长基因的寡聚核苷酸芯片ImaGene3.0检测乙型肝炎病毒复制子pHY106-BHBV转染肝癌细胞系基因表达谱差异, 并选择其中参与胆固醇代谢的表达下调基因7-脱氢胆固醇还原酶和NADH-细胞色素b5还原酶, 用RT-PCR方法进行验证分析.
结果: 基因芯片筛选出差异表达的基因, 其中包括转录因子、细胞周期素、细胞因子相关蛋白、糖脂类物质代谢相关酶及细胞信号转导相关因子等, RT-PCR验证参与胆固醇代谢的几种表达差异的基因, 其中7-脱氢胆固醇还原酶和NADH-细胞色素b5还原酶表达明显下调, 与基因芯片分析结果一致.
结论: 乙型肝炎病毒复制子pHY106-BHBV转染肝癌细胞系存在基因表达差异, 乙型肝炎病毒感染可能通过抑制参与胆固醇代谢的7-脱氢胆固醇还原酶和NADH-细胞色素b5还原酶从而进一步影响机体胆固醇代谢.
引文著录: 赵凤林, 崔长青, 张锦前, 魏红山. HBV复制子pHY106-BHBV转染HepG2细胞基因表达差异. 世界华人消化杂志 2010; 18(10): 1041-1045
Revised: January 18, 2010
Accepted: January 26, 2010
Published online: April 8, 2010
AIM: To investigate the changes in gene expression profile of HepG2 cells transfected with HBV replicon pHY106-BHBV by cDNA microarray, and to identify differential genes involved in cholesterol metabolism.
METHODS: A cDNA microarray (Affymetrix) that contains 20 000 gene sequences was used to examine gene expression between HepG2 cells transfected with HBV replicon pHY106-BHBV and control plasmid. Differentially expressed genes that may contribute to cholesterol metabolism were subjected to real-time reverse transcription-polymerase chain reaction (RT-PCR) analysis.
RESULTS: The differentially expressed genes identified mostly encode transcription factors, cytokines, and molecules that are involved in signal transduction, glucose metabolism and lipid metabolism. Real-time RT-PCR results indicated that cholesterol metabolism-related genes 7-dehydrocholesterol reductase (dhcr7) and NADH-cytochrome b5 reductase (cyb5r) were down-regulated in HepG2 cells transfected with HBV replicon pHY106-BHBV.
CONCLUSION: Differential gene expression profile is detected between HepG2 cells transfected with HBV replicon pHY106-BHBV and control plasmid. The expression of cholesterol metabolism-related genes dhcr7 and cyb5r may be suppressed by HBV infection.
- Citation: Zhao FL, Cui CQ, Zhang JQ, Wei HS. Differential gene expression profiling of HepG2 cells transfected with a hepatitis B virus replicon. Shijie Huaren Xiaohua Zazhi 2010; 18(10): 1041-1045
- URL: https://www.wjgnet.com/1009-3079/full/v18/i10/1041.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i10.1041
肝炎病毒慢性持续感染除了引起肝脏损害外, 还与一些肝外组织的损害密切相关[1]. 近年来, 研究资料显示慢性HBV感染与糖尿病和脂肪肝等代谢性疾病的发病密切相关. 肝脏是脂类物质代谢的重要器官[2], 其病变常影响脂质代谢的正常进行, 大量研究表明肝病患者常伴有脂类物质代谢异常[1]. 此前未见HBV影响胆固醇代谢的相关报道, 因此本研究选用较常用的肝癌细胞系HepG2为实验对象, 应用HBV复制子pHY106-BHBV转染模拟HBV的感染过程, 并进行基因表达谱芯片分析后筛选其中的胆固醇代谢相关基因, 进行相关实验验证. 以期进一步深入研究HBV感染影响机体胆固醇代谢以及导致肝细胞膜结构的稳定性下降、胆固醇合成异常及能量代谢异常的可能机制.
pHY106空载体由本所保存, HBV复制子pHY106-BHBV由本所构建(该质粒为B型HBV的全长基因组DNA与pHY106连接组成), 人肝癌母细胞瘤细胞系HepG2为本所保存, 细胞培养相关试剂DMEM, 转染试剂Lipofectamine 2000, 总RNA提取试剂TRIzol, 购自Invitrogen公司, Oligotex mRNA Midi Kit购自Qiagen公司, 基因芯片检测由上海联合基因有限公司完成, 7-脱氢胆固醇还原酶(7-dehydrocholesterol reductase, 7DCR)、NADH-细胞色素b5还原酶(NADH-cytochrome b5 reductase, NADH-CYB5R)及磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)Realtime PCR引物由北京奥科生物公司合成, SYBR Green多聚酶链反应试剂购自TaKaRa公司.
1.2.1 细胞转染: 取6孔培养板, 向每孔中加入2 mL含(1-2)×105个细胞, 37 ℃ 50 mL/L CO2培养至50%-70%汇合时, 用2 mL不含血清培养液漂洗两次, 再加入1 mL不含血清培养液. 在聚苯乙烯管中制备以下两液(为转染每一个孔细胞所用的量)A液: 用不含血清培养基稀释3-5 μg DNA, 终量250 μL; B液: 用不含血清培养基稀释10 μL Lipofectamine 2000, 终量250 μL, 轻轻混合A、B液, 室温中置20 min, 把A/B复合物缓缓加入培养液中, 摇匀, 37 ℃温箱置4-6 h, 吸除无血清转染液, 换入正常培养液继续培养.
1.2.2 总RNA提取及mRNA纯化: 在35 mm培养皿中常规培养HepG2细胞, 细胞生长至对数期时分别将pHY106(对照组)及HBV复制子pHY106-BHBV(实验组)转染细胞48 h后收获细胞. 使用TRIzol试剂一步法分别提取细胞总RNA, 样品经分光光度计检测吸光度A值, 并行热稳定实验, 于-20 ℃和70 ℃保温1 h后, 经琼脂糖凝胶电泳检测28S、18S条带变化. 以Qiagen公司Oligotex mRNA Midi Kit纯化得mRNA, 并行电泳检测.
1.2.3 探针标记和芯片制备: 常规方法逆转录标记cDNA探针并纯化. Cy3-dUTP标记转染pHY106对照组细胞mRNA(5 μg), Cy5-dUTP标记转染HBV复制子pHY106-BHBV实验组细胞mRNA(5 μg). 乙醇沉淀后溶解在20 μL 5×SSC+2 g/L SDS杂交液中. 芯片包含的20 000个cDNA由上海联合基因有限公司提供, 包括原癌基因和抑癌基因、免疫调节相关基因、细胞凋亡和应激反应蛋白相关基因、信号转导相关基因等. 探针标记和芯片制备由上海联合基因有限公司完成.
1.2.4 杂交及洗涤: 将基因芯片和杂交探针在95 ℃水浴变性5 min, 将混合探针加在基因芯片上, 置于60 ℃杂交15-17 h. 后用SSC及SDS混合液洗涤10 min, 室温晾干. 用General Scanning公司的ScanArray 3000扫描芯片. 预先选定的内参照基因(24条管家基因, 每个基因点2个点, 共48个点)对Cy3和Cy5的原始提取信号进行均衡和修正. 用ImaGene3.0软件分析Cy3、Cy5两种荧光信号的强度, 计算Cy5/Cy3比值.
1.2.5 实时荧光定量多聚酶链反应: 实时荧光定量多聚酶链反应(QRT-PCR)由北京奥科生物公司合成7DCR、NADH-CYB5R及内参照物GAPDH基因的RT-PCR引物(表1), 将RNA反转录为cDNA, 随后将其与SYBR Green多聚酶链反应试剂及引物加入八联管中(反应体系见表2), 短暂离心后用ABI 7500以两步法PCR扩增, 其标准程序反应条件如下: 步骤1: 预变性: 95 ℃ 10 s, 20 ℃/s 1个循环. 步骤2: PCR反应: 95 ℃ 5 s, 20 ℃/s, 60 ℃ 20 s, 20 ℃/s, 40循环. 步骤3: 融解曲线分析: 95℃ 0 s, 20 ℃/s, 65 ℃ 15 s, 20 ℃/s, 95 ℃ 0 s, 0.1 ℃/s.
| 扩增基因 | 上游引物 | 下游引物 |
| 7-脱氢胆固醇还原酶 | 5'-GCCAACATCCTTGGCTATG-3' | 5'-GGGGAAGAAGTAGCCCTTGA-3' |
| NADH-细胞色素b5还原酶 | 5'-CTTGGTCTGCCATCCTGAAC-3' | 5'-GGTCGCTGAGCACTCACA-3' |
| GAPDH | 5'-CCTGTTCGACAGTCAGCCG-3' | 5'-CGACCAAATCCGTTGACTCC-3' |
| 试剂 | 使用量 |
| SYBR Premix Ex Taq | 10 μL |
| PCR Forword primer(10 μm) | 0.4 μL |
| PCR reverse primer(10 μm) | 0.4 μL |
| 模板(cDNA) | 1 μL |
| ddH2O | 加至 20 μL |
以Signal Log Ratio值定为±2标准, 用高通量基因表达谱芯片筛选. 基因芯片的阳性结果判断: Cy5/Cy3>2.0, 红色荧光, 显示表达增强; Cy5/Cy3<0.5, 为绿色荧光, 显示表达减弱. 实验组(HBV复制子pHY106-BHBV转染细胞)与对照组(pHY106转染细胞)比较: 筛选出差异表达基因共182条(上调基因36条, 下调基因146条), 其中与代谢相关基因的差异表达基因10条(上调基因4条, 下调基因6条)(表3, 4).
| 序号 | GenBank_ID | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_004525 | 低密度脂蛋白相关蛋白2 | 2.075 |
| 2 | NM_018947 | 细胞色素c | 2.007 |
| 3 | NM_014912 | 胞质多聚腺苷化组件结合蛋白3 | 2.201 |
| 4 | D86550 | 丝苏氨酸蛋白激酶 | 2.224 |
| 序号 | GenBank_ID | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_012218 | 磷酸甲羟戊酸激酶 | 0.411 |
| 2 | NM_000292 | 磷酸化酶激酶α2 | 0.444 |
| 3 | U53347 | 中性氨基酸转运蛋白B | 0.471 |
| 4 | Y11312 | 磷酸肌醇3激酶 | 0.344 |
| 5 | BC000054 | 7-脱氢胆固醇还原酶 | 0.376 |
| 6 | NM_007326 | NADH-细胞色素b5还原酶 | 0.490 |
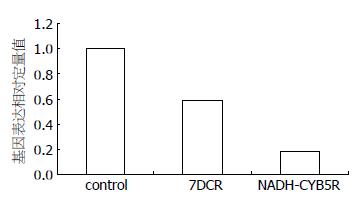
为进一步研究基因芯片的发现, 经基因数据库的检索发现7DCR、NADH-CYB5R基因可能与胆固醇代谢密切相关, 应用RT-PCR的方法检测基因表达水平, 分别得到其基因扩增曲线. 7DCR Realtime Ration值为0.59, NADH-CYB5R Realtime Ration值为0.18(图1). 结果提示HBV复制子转染HepG2细胞后使其7DCR和NADH-CYB5R基因表达下调.
肝脏是胆固醇的主要合成场所, 占合成总量的70%-80%. 胆固醇合成酶系存在于胞液及光面内质网膜上, 胆固醇的合成主要在肝细胞细胞质及内质网中进行[3], 胆固醇是细胞膜的重要组成部分. HBV慢性持续感染引起慢性肝炎主要导致肝脏持续性病变, 引起肝细胞变性坏死, 导致肝功能的损害, 同时还可引起机体脂类物质代谢异常.
本研究利用基因表达谱芯片技术筛选出大量差异表达的基因, 其中包括转录因子、细胞周期素、细胞因子相关蛋白、物质代谢相关酶类及细胞信号转导相关因子等, 说明HBV感染可能影响细胞增殖、基因表达、信号转导及物质代谢等多个方面, HBV的慢性持续感染可能改变了细胞的代谢模式, 从而影响器官的功能. 因此, 为研究HBV感染发病机制的环节中是否与胆固醇代谢相关, 所以从所筛选出的差异表达基因中选择参与胆固醇代谢的基因用RT-PCR的方法验证, 发现7-脱氢胆固醇还原酶和NADH-细胞色素b5还原酶存在表达下调.
NADH-细胞色素b5还原酶(NADH-cytochrome b5 reductase, NADH-b5R)是一种广泛分布于人体各组织细胞、具有重要生理功能的氧化还原酶类, 包括体细胞中的膜结合形式(结合与内质网、线粒体和其他内膜)和胚胎细胞中的游离形式. 膜结合形式主要存在于内质网的胞质侧其功能主要是脂肪酸的去饱和化和链延伸, 胆固醇的生物合成以及P450介导的药物代谢. 胚胎形式存在于循环细胞的可溶片段, 参与高铁血红蛋白的降解, 主要是使红细胞内的高铁血红蛋白还原为有携氧能力的亚铁血红蛋白. 膜结合形式既有膜结合又有催化结构域, 而可溶性形式只有催化形式. 这两种形式来源于基因的不同剪切体. 我们的实验证实该基因在HBV复制子转染的肝癌细胞中下调, 可能与HBV感染患者存在的脂质代谢异常及细胞膜结构的稳定性下降相关. 此前该基因的相关研究[4-7]多集中在其基因突变后会导致遗传性高铁血红蛋白血症, 而HBV感染过程中该基因表达下调的意义还需深入研究.
7-脱氢胆固醇还原酶(7-dehydrocholesterol reductase, 7DCR)参与多种细胞中胆固醇生成过程的最终步骤[8]. 具体地说, 7DCR将7-脱氢胆固醇转换成胆固醇. 胆固醇既可自身制造也可从食物中获取, 在生长发育及物质代谢方面其功能重要. 胆固醇与信号蛋白的相互作用和控制在大脑、四肢、生殖道和其他结构的发育中起着非常重要的作用; 其同时也是细胞膜、髓磷脂的结构成分; 另外, 胆固醇也是合成某些激素的原料并在胆汁酸的生成中起重要作用. 本研究中基因芯片及RT-PCR的实验结果发现并证实该基因也在HBV感染过程中存在表达下调, 这可能导致胞膜结构稳定性下降、类固醇激素降低, 但临床上此类激素并不降低且多数升高说明还有其他因素参与激素的代谢, 然而大部分文献[8-11]报道该基因突变可导致Smith-Lemli-Opitz综合征的一种隐形遗传病, 关于在HBV感染过程中该基因表达下调的意义仍有待进一步研究.
总之, HBV感染可能对细胞增殖、基因表达、信号转导、糖脂类物质代谢[12-14]等诸多方面存在不同程度的影响. RT-PCR和基因芯片技术都证实7DCR和NADH-b5R二者在HBV感染过程中存在表达下调, 这可能与HBV感染所致的肝细胞膜结构稳定性下降及脂质代谢异常相关, 而这种影响的可能性仍需进一步研究确定其相关机制也有待深入研究. 这可能对HBV感染所致相关疾病的发病机制和治疗方案提供新的研究思路、方法及方案.
肝炎病毒慢性持续感染除了引起肝脏损害外, 还与一些肝外组织的损害密切相关. 近年来, 研究资料显示慢性HBV感染与糖尿病和脂肪肝等代谢性疾病的发病密切相关. 肝脏是脂类物质代谢的重要器官, 其病变常影响脂质代谢的正常进行, 大量研究表明肝病患者常伴有脂类物质代谢异常.
曹洁, 副教授, 中国人民解放军第二军医大学微生物学教研室
肝炎病毒慢性持续感染导致糖尿病和脂肪肝等代谢性疾病已是不争的事实, 国内外大量研究文献可供参考, 该领域也是目前慢性肝炎病毒感染研究的研究的热点, 而相关机制的研究则鲜见报道且并不明确, 均亟待研究.
近年来, 国内外大量的研究报道提示HBV慢性感染与糖尿病、脂肪肝等代谢性疾病密切相关, 尤其是糖代谢异常比例明显高于普通人群.
本研究证实7-脱氢胆固醇还原酶和NADH-细胞色素b5还原酶二者在HBV感染过程中存在表达下调, 这可能与HBV感染所致的肝细胞膜结构稳定性下降及脂质代谢异常相关, 而这种影响的可能性仍需进一步研究确定其相关机制也有待深入研究.
本研究设计尚可, 结果可靠, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Mohammad Alizadeh AH, Fallahian F, Alavian SM, Ranjbar M, Hedayati M, Rahimi F, Khedmat H, Etemadi A, Zali MR, Azizi F. Insulin resistance in chronic hepatitis B and C. Indian J Gastroenterol. 2006;25:286-289. [PubMed] |
| 2. | Custro N, Carroccio A, Ganci A, Scafidi V, Campagna P, Di Prima L, Montalto G. Glycemic homeostasis in chronic viral hepatitis and liver cirrhosis. Diabetes Metab. 2001;27:476-481. [PubMed] |
| 3. | 周 爱儒. 生物化学. 第6版. 北京: 人民卫生出版社 2004; 128-131. |
| 4. | Fermo E, Bianchi P, Vercellati C, Marcello AP, Garatti M, Marangoni O, Barcellini W, Zanella A. Recessive hereditary methemoglobinemia: two novel mutations in the NADH-cytochrome b5 reductase gene. Blood Cells Mol Dis. 2008;41:50-55. [PubMed] [DOI] |
| 5. | Maran J, Guan Y, Ou CN, Prchal JT. Heterogeneity of the molecular biology of methemoglobinemia: a study of eight consecutive patients. Haematologica. 2005;90:687-689. [PubMed] |
| 6. | Percy MJ, Oren H, Savage G, Irken G. Congenital methaemoglobinaemia Type I in a Turkish infant due to a novel mutation, Pro144Ser, in NADH-cytochrome b5 reductase. Hematol J. 2004;5:367-370. [PubMed] [DOI] |
| 7. | Lukyanenko LM, Kozlova NM, Slobozhanina EI. Activity of membrane-bound NADH-methemoglobin reductase and physical state of lipids in erythrocyte membranes. Bioelectrochemistry. 2004;62:191-193. [PubMed] [DOI] |
| 8. | Jezela-Stanek A, Ciara E, Malunowicz EM, Korniszewski L, Piekutowska-Abramczuk D, Popowska E, Krajewska-Walasek M. Mild Smith-Lemli-Opitz syndrome: further delineation of 5 Polish cases and review of the literature. Eur J Med Genet. 2008;51:124-140. [PubMed] [DOI] |
| 9. | Waye JS, Eng B, Potter MA, Nowaczyk MJ, McFadden D, Langlois S. De novo mutation of the DHCR7 gene in a fetus with severe Smith-Lemli-Opitz (or RSH) syndrome. Am J Med Genet A. 2007;143A:1799-1801. [PubMed] [DOI] |
| 10. | Waye JS, Eng B, Nowaczyk MJ. Prenatal diagnosis of Smith-Lemli-Opitz syndrome (SLOS) by DHCR7 mutation analysis. Prenat Diagn. 2007;27:638-640. [PubMed] [DOI] |
| 11. | Witsch-Baumgartner M, Clayton P, Clusellas N, Haas D, Kelley RI, Krajewska-Walasek M, Lechner S, Rossi M, Zschocke J, Utermann G. Identification of 14 novel mutations in DHCR7 causing the Smith-Lemli-Opitz syndrome and delineation of the DHCR7 mutational spectra in Spain and Italy. Hum Mutat. 2005;25:412. [PubMed] [DOI] |