修回日期: 2009-11-20
接受日期: 2009-11-30
在线出版日期: 2010-01-08
目的: 探讨经典激活的巨噬细胞(Mφ1)和选择性激活的巨噬细胞(Mφ2)培养上清液对人γδT细胞增殖、表面标志、杀瘤活性的影响及其作用机制.
方法: 在体外用GM-CSF和IFN-γ诱导培养Mφ1, 用M-CSF培养Mφ2, 已戊烯焦磷酸法扩增外周血γδT细胞. 用流式细胞术(FCM)检测巨噬细胞、γδT细胞表面标志, 用酶联免疫吸附试验(ELISA)检测IL-10、IL-12含量, 用四甲基偶氮唑蓝(MTT)法检测巨噬细胞培养上清对γδT细胞增殖的影响. 用乳酸脱氢酶(LDH)释放法检测巨噬细胞培养上清对γδT细胞的杀瘤活性的影响.
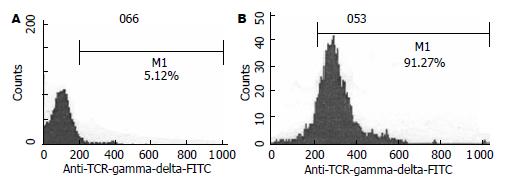
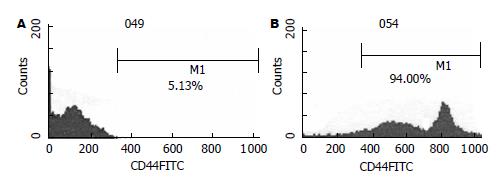
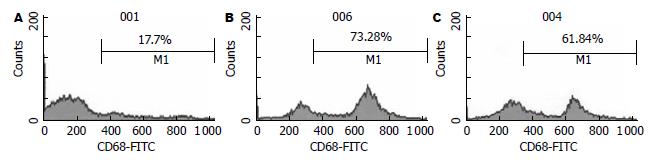
结果: 体外诱导培养10 d的Mφ1和Mφ2均高表达CD68(73.2% vs 61.8%), Mφ1分泌IL-12的浓度显著高于Mφ2 (35 mg/L vs 9 mg/L, P<0.01), Mφ1分泌IL-10的浓度明显低于Mφ2(15 mg/L vs 87 mg/L, P<0.01). 不同浓度Mφ1上清组对γδT细胞的增值率均高于对照组或Mφ2组(338% vs 11%, 0, P<0.01). Mφ1培养上清作用后的γδT细胞表面标志γδT CR表达率高于Mφ2组和对照组, 有统计学意义(97.3% vs 89.1%, 91.3%, P<0.05). 不同浓度Mφ1上清组对γδT细胞的杀瘤活性均高于对照组或Mφ2组(70.18% vs 51.38%, 47.25%, P<0.01).
结论: Mφ1能够促进γδT细胞生长, 而且能够提高γδT细胞对胃癌SGC-7901细胞的杀伤活性, Mφ2对γδT细胞作用不明显.
引文著录: 武侠, 费素娟, 刘军权, 陈复兴, 吴萍. Mφ1和Mφ2对γδT细胞体外抗胃癌细胞SGC-7901作用的影响. 世界华人消化杂志 2010; 18(1): 20-27
Revised: November 20, 2009
Accepted: November 30, 2009
Published online: January 8, 2010
AIM: To investigate the effects of the culture supernatants of classically activated macrophages (Mφ1) and alternatively activated macrophages (Mφ2) on the proliferation, cytotoxicity, and surface maker expression of gamma delta T (γδT) cells and explore potential mechanisms involved.
METHODS: Mφ1 were induced in vitro with granulocyte-macrophage colony-stimulating factor (GM-CSF) and interferon-γ (IFN-γ), while Mφ2 were induced with macrophage colony-stimulating factor (M-CSF). The isopentenyl pyrophosphate method was used to amplify human peripheral blood γδT cells. The surface markers on macrophages and γδT cells were determined by flow cytometry (FCM). Interleukin-10 (IL-10) and IL-12 levels in the culture supernatants of Mφ1 and Mφ2 were determined by enzyme-linked immunosorbant assay (ELISA) using commercial kits. The proliferation of γδT cells induced with the culture supernatants of Mφ1 and Mφ2 was investigated by methyl thiazoly tetrazolium (MTT) assay. The lactate dehydrogenase (LDH) method was used to detect the cytotoxicity of γδT cells against gastric cancer SGC-7901 cells.
RESULTS: After 10 days of induction culture, approximately 73.2% and 61.8% of Mφ1 and Mφ2 highly expressed CD68, respectively. The level of IL-12 secreted by Mφ1 was significantly higher than that secreted by Mφ2 (35 mg/L vs 9 mg/L, P < 0.001). The level of IL-10 secreted by Mφ1 was significantly lower than that secreted by Mφ2 (15 mg/L vs 87 mg/L, P < 0.001). The culture supernatant of Mφ1 could increase the proliferation of γδT cell when compared with those of Mφ2 and control cells (338% vs 11% and 0%, respectively; both P < 0.01). The positive rate of surface maker γδT cell receptor (γδTCR) on γδT cells induced with the culture supernatant of Mφ1 was higher than those on γδT cells induced with the culture supernatants of Mφ2 and control cells (97.3% vs 89.1% and 91.3%, respectively; both P < 0.05). The culture supernatant of Mφ1 could increase the cytotoxicity of γδT cells when compared with those of Mφ2 and control cells (70.18% vs 51.38% and 47.25%, respectively; both P < 0.01).
CONCLUSION: The culture supernatant of Mφ1 can increase the proliferation and cytotoxicity of γδT cells, whereas the culture supernatant of Mφ2 has no significant effects.
- Citation: Wu X, Fei SJ, Liu JQ, Chen FX, Wu P. Effects of the culture supernatants of Mφ1 and Mφ2 on the killing activity of human γδT cells against gastric cancer SGC-7901 cells in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(1): 20-27
- URL: https://www.wjgnet.com/1009-3079/full/v18/i1/20.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i1.20
胃癌是人类常见的恶性肿瘤, 我国是胃癌高发国家, 其发病率和死亡率居各种恶性肿瘤首位[1], 严重威胁着人类的健康, 因此对其防治的研究具有重要的临床意义. 免疫治疗是一种采用多种免疫细胞治疗恶性肿瘤的新技术, 能提高患者免疫系统对肿瘤抗原的识别和提呈能力, 达到减少肿瘤复发和转移的目的. 在肿瘤免疫均衡期和免疫逃逸期, 必须联合固有免疫和适应性免疫中的抗肿瘤效应细胞一起应用, 才能达到清除肿瘤的目的[2]. 巨噬细胞在特异性免疫反应的诱发和免疫调节中起关键作用. 近年来人们逐渐发现成熟巨噬细胞能在各种因素诱导下出现表型和功能分化, 即极化现象[3-5]. 人单个核细胞在粒细胞/巨噬细胞集落刺激因子(granulocyte-macrophage-CSF, GM-CSF)和巨噬细胞集落刺激因子(macrophage-CSF, M-CSF)诱导下分别分化为经典激活的巨噬细胞(classic activated macrophage, CAM/Mφ1)和选择性激活的巨噬细胞(alternative activation of macrophage, AAM/Mφ2)[6,7]. γδT细胞是体内T细胞固有免疫的一个重要细胞群[8,9], 在肿瘤免疫监视中具有重要作用[10-13]. 巨噬细胞如能和γδT细胞进行综合性细胞免疫治疗, 将会明显提高肿瘤患者的细胞免疫治疗效果. 目前国内外有关巨噬细胞和γδT细胞相互作用的研究主要局限在炎症组织[14,15], 尚未见有关巨噬细胞对γδT细胞抗肿瘤作用的影响方面的报道, 特别是比较不同极化状态的巨噬细胞对γδT细胞抗肿瘤作用的研究. 本实验旨在体外成功培养Mφ1和Mφ2, 并给予鉴定. 观察Mφ1和Mφ2培养上清对γδT细胞的增殖、表面受体的表达以及杀伤活性的影响, 并探讨其可能的机制.
人胃癌细胞株SGC-7901(中国科学院上海细胞生物学研究所); rhGM -CSF、rhM-CSF (Promega公司); rhIL-2、rhIFN-γ(厦门特宝生物工程股份有限公司); RPMI-1640培养基、小牛血清、胰蛋白酶(Gibco公司); 四甲基偶唑篮(MTT)、二甲亚砜(DMSO)(Sigma公司); PE标记的鼠抗人单克隆抗体CD3、FICT标记的鼠抗人单克隆CD68、CD44、γδTCR(联科生物有限公司); IL-10, IL-12试剂盒(Abender公司); 乳酸脱氢酶试剂盒(购于日本世诺临床诊断制品株式会社); 恒温CO2培养箱(Heraeuas公司)、倒置显微镜(德国Wilovert公司)、超净工作台、流式细胞仪(FCM, 美国BD公司)、低速离心机.
1.2.1 γδT细胞的培养和鉴定: 取健康献血者末梢抗凝血10 mL, 加入淋巴细胞分离液, 以2 000 r/min离心15 min, 吸取外周血单核细胞(peripheral blood mononuclear cells, PBMC), 用生理盐水洗涤3遍(1 500 r/min离心, 每次10 min), 加入RPMI 1640培养液(含10%小牛血清、5%人AB血清、IL-2 150 kU/L和IPP 2 µg/L)中后按陈复兴等[16]提出方法进行γδT细胞培养. 收集培养10 d的贴壁生长γδT细胞进行细胞表面标志γδTCR和CD44检测和随后的γδT细胞生长及杀伤活性试验.
1.2.2 巨噬细胞的培养: 健康志愿者6例, 每例抽血200 mL, 以淋巴细胞分离液分离PBMC, 用RPMI 1640完全培养基将PBMC配成2×109/L, 加入6孔板细胞培养板中, 每孔5 mL, 于37 ℃、50 mL/L CO2培养箱中培养2 h后, 用PBS将未贴壁细胞洗掉, 贴壁细胞热盐水洗1次, 应用含700 kU/L GM-CSF和10%胎牛血清的RPMI 1640培养基, 于50 mL/L CO2, 37 ℃培养, 每2 d半量换培养基1次, 第6天加入166 kU/L的IFN-γ, 孵育24 h后即得Mφ1. 同法用50 µg/L的M-CSF代替GM-CSF诱导Mφ2[7], 但第6天不加IFN-γ.
1.2.3 流式细胞术(flow cymetory, FCM)检测巨噬细胞表面标志CD68的表达: 分别将6份标本用胰蛋白酶消化收获的培养7、10、13 d的Mφ1, Mφ2, 用PBS调细胞浓度为5×109/L, PBS离心洗涤后重悬, 分别取100 µL加入离心管, 加入荧光标记的单克隆抗体CD68(FITC标记), 终浓度为5 mg/L, 4 ℃暗处孵育标记20 min, PBS液洗涤, 然后用FCM检测细胞表型.
1.2.4 Mφ1、Mφ2培养上清液中IL-10和IL-12的检测: 分别吸取培养第4、6、8、10、12和14天Mφ1和Mφ2上清液0.5 mL, 置-20 ℃保存. 收集完标本后检测其中IL-10, IL-12含量. 操作过程严格按照说明书进行.
1.2.5 四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT)测定Mφ1、Mφ2培养上清液对γδT细胞增殖的影响: 将上述方法培养10 d的γδT细胞配成1×109/L, 加入96孔板, 每孔0.2 mL, 每组设5个复孔, 置于50 mL/L CO2、37 ℃培养箱中培养24 h后分别加入培养10 d的Mφ1、Mφ2培养上清混合液, 设不加巨噬细胞上清为对照组, 最终培养液量为每孔0.2 mL, 继续置37 ℃、 50 mL/L CO2培养72 h后, 每孔加入MTT 20 µL, 37 ℃、50 mL/L CO2培养箱中继续孵育4 h, 弃去上清, 加二甲基亚砜(DMSO)每孔100 µL, 震荡10 min后, 待其沉淀产物完全溶解, 置酶标仪上570 nm波长测定各孔的吸光度(A). 细胞增殖率 = (试验组A值/对照组A值-1)×100%.
1.2.6 FCM检测Mφ1, Mφ2培养上清液对γδT细胞表型的影响: 收集经培养10 d的Mφ1、Mφ2培养上清液作用72 h后的γδT细胞(实验组, Mφ1或Mφ2上清:1640培养基体积比为1:8)和没有上清作用的γδT细胞(对照组), 用PBS液调细胞浓度为2×109/L, 分别取100 µL加入离心管, 加入FITC荧光标记的γδTCR单克隆抗体、抗人CD44-FITC抗体, 终浓度为5 mg/L, 4 ℃暗处孵育, 标记20 min, PBS液洗涤, 然后用FCM检测.
1.2.7 经Mφ1、Mφ2培养上清液作用后γδT细胞杀瘤活性的测定: 以乳酸脱氢酶释放法测定细胞杀伤活性[17], 将SGC-7901胃癌细胞用高糖DMEM培养基培养至对数生长期, 收集细胞用Hank液洗2次, 配成2×108/L为靶细胞. 经不同浓度(Mφ1或Mφ2上清:1640培养基体积比为1:4、1:8、1:32、1:64)Mφ1、Mφ2培养上清液诱导72 h后的γδT细胞配成2×109/L为效应细胞, 将效靶细胞数按10:1比例混合. 以500 r/min离心5 min, 置37 ℃、50 mL/L CO2培养箱中孵育6 h后, 轻轻混匀细胞, 再以1 500 r/min离心10 min. 每次测试分别加入未经巨噬细胞上清诱导的γδT细胞悬液做对照组, 每组设5个复管. 收集培养上清液, 用Encore全自动生化分析仪, 测定LDH的活性单位(U/L). γδT细胞杀伤活性 = (测定管LDH单位-效应细胞自然释放LDH单位)/(最大释放管LDH单位-靶细胞自然释放管LDH单位)×100%.
统计学处理 采用SPSS统计软件, 数值以mean±SD表示, 两组比较采用t检验, 多组之间比较采用单因素方差分析, P<0.05认为有统计学意义.
PBMC在γδT细胞培养诱导体系中培养24 h即可见贴壁生长, 48 h后集落开始变大, 培养10 d可见大的集落和单个贴壁生长细胞, 单个细胞可见细胞呈条梭状, 也有小量呈悬浮生长细胞. 收集培养前后细胞进行mAb荧光标记后经FCM检测并分析结果, 培养前γδT细胞数的比例为4.21%, 其细胞表面黏附分子CD44的表达率仅为5.13%; 培养10 d时γδT细胞数的比例达91.27%, 其CD44表达为94.00%(图1, 2), 符合γδT细胞的特征.
PBMC分别在Mφ1、Mφ2培养诱导体系中培养24 h即可见贴壁生长, 48 h后集落开始变大, 每个集落约3-6个细胞, 培养7 d可见大的集落和极少量单个贴壁生长细胞, 单个细胞可见细胞呈不规则形, 培养7 d的巨噬细胞涂片行瑞姬氏染色发现大多数细胞体积大, 呈椭圆或不规则形, 细胞核大多为椭圆或不规则形, 核染质疏松, 核膜不规则, 有凸起; 胞质丰富, 染成灰蓝色, 形态不规则, 有的像伪足, 近核处有淡染现象, 也有呈不规则形. 培养前后细胞表面CD68的表达率有明显改变, 培养前CD68表达率为17.7%, 培养后Mφ1的CD68表达率为73.2%, Mφ2的CD68表达率为61.8%(图3).
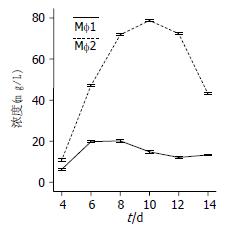
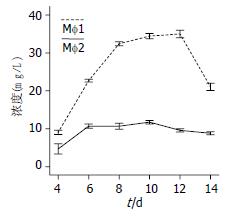
Mφ1、Mφ2可通过分泌不同的细胞因子, 发挥免疫调节作用, 其中IL-10介导负向调节功能, 为此我们检测巨噬细胞不同培养时间IL-10的分泌水平, 结果表明, 培养第6天时Mφ2分泌IL-10的水平开始升高, 8-12 d达到峰值(8、10、12 d IL-10浓度比较无统计学意义, P>0.05), 14 d时分泌量下降, 而Mφ1各培养时间段分泌的IL-10水平无明显差异(P>0.05). 但在相同培养时间点, Mφ1与Mφ2 IL-10分泌水平比较有显著差异(P<0.01), 尤其在培养10 d Mφ1、Mφ2分泌IL-10的浓度分别为15 µg/L和87 µg/L, 经统计学比较有显著性差异(P<0.001, 图4).
IL-12介导正向调节功能, 培养第6天时Mφ1分泌的IL-12的水平开始升高, 8-12 d达到峰值, 8、10、12d IL-12浓度比较无统计学意义(P>0.05), 14 d时分泌量下降, 而Mφ2各培养时间段分泌的IL-12水平无明显差异. 但在相同培养时间点, Mφ1与Mφ2 IL-12分泌水平有显著差异(P<0.01), 尤其是培养12 d Mφ1、Mφ2分泌IL-12浓度分别为35 µg/L和9 µg/L, 经统计学比较有非常显著性差异(P<0.001, 图5).
γδT细胞分别经培养10 d的Mφ1和Mφ2培养上清混合液作用后发现, 不同浓度Mφ1上清组对γδT细胞的增值率均显著高于对照组或Mφ2组(P<0.01). 在Mφ1上清:1640培养基体积比从1:1至1:8比例组, 随Mφ1培养上清液浓度的减少, γδT细胞的增殖率逐渐升高, 体积比在1:8时γδT细胞增殖率达峰值(338%), 当Mφ1上清:1640培养基体积比至1:16以下时, γδT细胞增殖率逐渐下降. 与Mφ1相反, 在Mφ2每一浓度组γδT细胞增值率均为负值, 与Mφ1组比较, 均有显著性差异(P<0.01), 但与对照组比较无统计学意义(P>0.05, 表1).
| M:1640 (体积比) | γδT细胞增殖(A值) | γδT细胞增殖率(%) | ||
| Mφ1培养组 | Mφ2培养组 | Mφ1培养组 | Mφ2培养组 | |
| 对照组 | 0.430±0.026 | 0.433±0.031 | 0.00 | 0.00 |
| 1:1 | 1.647±0.097b | 0.377±0.066 | 283.32b | -5.12 |
| 1:2 | 1.829±0.036b | 0.408±0.028 | 325.68b | -12.28 |
| 1:4 | 1.871±0.021b | 0.384±0.003 | 335.53b | -10.63 |
| 1:8 | 1.882±0.029b | 0.381±0.054 | 338.09b | -11.40 |
| 1:16 | 1.554±0.044b | 0.357±0.006 | 261.60b | -16.83 |
| 1:32 | 1.569±0.011b | 0.280±0.031 | 265.09b | -34.83 |
| 1:64 | 1.040±0.069b | 0.357±0.026 | 142.12b | -16.99 |
| 1:128 | 0.914±0.050b | 0.333±0.019 | 112.08b | -22.43 |
γδT细胞分别经培养10 d的Mφ1和Mφ2培养上清混合液作用(Mφ1或Mφ2上清:1640培养基体积比为1:8)后发现, Mφ1培养上清作用后的γδT细胞表面标志γδTCR表达率为97.3%, 明显高于Mφ2组(89.1%)和对照组(91.27%), 有统计学意义(P<0.05). 提示Mφ1能上调γδT细胞的表面标志γδTCR的表达(表2).
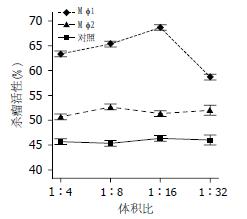
γδT细胞分别经培养10 d的Mφ1和Mφ2培养上清混合液作用后发现, 不同浓度Mφ1上清组γδT细胞的杀瘤活性均高于对照组或Mφ2组(P<0.01). 在Mφ1上清:1640培养基体积比从1:4至1:16比例组, 随Mφ1培养上清液浓度的减少, γδT细胞的杀瘤活性逐渐升高, 体积比在1:16时γδT细胞杀瘤活性达峰值(70.18%), 当Mφ1上清: 1640培养基体积比至1:32时, γδT细胞增殖率下降. Mφ2每一浓度组γδT细胞杀瘤活性无明显变化, 与Mφ1组比较, 有统计学意义(P<0.05), 但与对照组比较无统计学意义(P>0.05, 图6).
巨噬细胞具有吞噬、递呈抗原、分泌细胞因子等多种功能, 在免疫细胞和非免疫细胞构成的细胞网络及各种细胞因子构成的分子网络中, 巨噬细胞处于中心地位, 在特异性免疫反应的诱发和免疫调节中起关键作用[18]. 免疫效应细胞在免疫反应中并非是表型单一的活化细胞, 在局部微环境因素的影响下, 活化的细胞分化成具有不同表型的亚细胞型, 这些亚型细胞适应局部环境同时又是局部环境不可或缺的组分. 他们分布不同, 表型特征有别: 表达不同的表面分子, 分泌不同细胞因子, 功能也不同. 近年来人们逐渐发现成熟巨噬细胞能在各种因素诱导下出现表型和功能分化, 即极化现象. Baron-Bodo等[19]采用GM-CSF、IFN-γ培养Mφ1, 证实用IFN-γ活化培养好的巨噬细胞可以增加巨噬细胞的抗肿瘤能力. Verreck等[7]用M-CSF诱导Mφ2. GM-CSF和M-CSF能明显增加培养巨噬细胞的数量, 在体外培养增加杀肿瘤细胞的能力, 而且可生成更多的炎性细胞因子[20,21]. IL-12高表达和IL-10低表达是Mφ1的特征, 而IL-10高表达和IL-12产生减少被认为是广义的Mφ2共同的表型标志. CD68是分布于细胞表面的跨膜糖蛋白, 相对分子质量为110 kDa. 单核细胞表面的CD68较少, 一旦向巨噬细胞转化, CD68表达即明显增加, 即CD68是人巨噬细胞公认的检测标记[22].
γδT细胞是体内T细胞固有免疫的一个重要细胞群, 约占外周血中T细胞的5%-15%, 他以MHC非限制方式识别各类抗原, 广泛分布于消化系统和呼吸系统上皮组织内; 末梢血中也有一定数量的γδT细胞[23]. 近几年来, 大量的研究证明, γδT细胞在肿瘤免疫监视和免疫治疗中具有重要作用[24-28]. 本实验发现培养前后Mφ1、Mφ2表面CD68表达均明显增加, 分别由培养前17.7%增加到73.2%和61.8%. 培养第6天Mφ2分泌的IL-10的量开始增多, Mφ1分泌的IL-12的量开始增多, 8-12 d达到顶峰, 14 d时分泌量下降. Mφ1高分泌IL-12、低分泌IL-10; Mφ2高分泌IL-10、低分泌IL-12, 符合Mφ1和Mφ2的特征, 提示我们已成功完成了由人外周血单核细胞培养为巨噬细胞的实验. γδTCR是γδT细胞表面表达的主要与炎症、肿瘤等免疫相关的受体, Dalton等[29,30]证实巨噬细胞和γδT细胞相互作用是Vδ1亚型的特性. Vγ1+细胞结合巨噬细胞是TCR介导的. γδTCR可以结合巨噬细胞, 影响巨噬细胞抗原提呈功能和分泌细胞因子, 介导炎症反应和肿瘤免疫. 另外, γδTCR的杀伤活性与肿瘤细胞表达相应的配体如MICA/MICB, ULBPI-4有关. γδT细胞分别经培养10 d的Mφ1和Mφ2培养上清混合液作用后发现, Mφ1培养上清作用后的γδT细胞表面标志γδTCR表达率明显高于Mφ2组和对照组. 提示Mφ1能上调γδT细胞的表面标志γδTCR的表达. 本组资料MTT实验发现, γδT细胞分别经培养10 d的Mφ1和Mφ2培养上清混合液作用后发现, 不同浓度Mφ1上清组对γδT细胞的增殖率均显著高于对照组或Mφ2组. 浓度在1:8时γδT细胞增殖率达峰值(338%), 当Mφ1上清γδT细胞体积比至1:16以下时, γδT细胞增殖率逐渐下降. 与Mφ1相反, 在Mφ2每一浓度组γδT细胞增值率均为负值, 但与对照组比较无统计学意义. 这说明Mφ1培养上清能够促进γδT细胞生长, 为γδT细胞提供了一种增效途径. 如果仅仅是抗原刺激, 并不能引起γδT细胞的增殖和扩增, 需要补充细胞因子如IL-2或与辅助性T细胞共培养. IL-2是较早确定的可以激活或共刺激γδT细胞的体外因素. 除此之外, 其他细胞因子同样可以影响γδT细胞激活, 如IL-7、IL-12、IL-15、IL-18、IL-21等, 但作用各有侧重. IL-2和IL-15侧重于引导增殖, IL-12和IL-18则侧重于介导γδT细胞分泌功能性IFN-γ. IL-12联合IL-2可以使γδT细胞数量增加到一个很大的程度, 同时γδT细胞抗瘤活性明显提高; IL-12还可以上调γδT细胞TNF-α受体数量, 增加对TNF-α的易感性. Dieli等[31]在体外用卡介苗感染的Dc与T细胞共培养, 发现两种细胞无-论是接触共培养还是隔离共培养, 均可以激活γδT细胞, 产生大量的IFN-γ, 说明卡介苗感染的DC分泌的某种可溶性因子起着一定作用. 分别加入IL-12抗体、IL-18抗体和γδT细胞受体(T cell receptor, TCR)抗体后, 只有IL-12抗体强烈抑制了IFN-γ 分泌, 确定了IL-12对γδT细胞的作用. 本实验Mφ1上清组中IL-12分泌较多, 且能明显促进γδT细胞的增殖, 也证实了IL-12对γδT细胞的作用. 我们的实验发现, 与Mφ2组及对照组相比, Mφ1培养上清液能加强γδT细胞对人胃腺癌SGC-7901细胞的杀伤作用, 其机制可能是由于Mφ1高分泌促Th1的细胞因子IL-12, 而且促进γδTCR的表达. IL-l2最初被发现时被认为是细胞毒T细胞的成熟因子, 并可单独激活NK细胞, 后逐渐发现其可以介导外周血淋巴细胞产生IFN-γ, 增加NK细胞的细胞毒作用, 促进T细胞增殖, 释放细胞因子IFN-γ和TNF-α等, 起到杀伤肿瘤的作用. γδT在γδTCR活化后上调FasL表达, 引发胃癌细胞的凋亡. 巨噬细胞上清联合γδT细胞治疗胃癌的机制可能为: (1)利用巨噬细胞和γδT细胞直接杀伤癌细胞, 弥补MHC限制性杀伤的不足; (2)通过补充各种免疫细胞之间的相互作用和细胞因子的作用, 增加和健全体内抗肿瘤免疫网络的功能. 总之, 巨噬细胞对γδT细胞体外抗胃癌细胞SGC-7901作用有影响, 不同极化状态的巨噬细胞作用不同, 本实验利用巨噬细胞上清和γδT细胞作用, 排除了直接的细胞细胞接触作用. 但作用机制、细胞通路等问题需进一步的研究.
在肿瘤免疫均衡期和免疫逃逸期, 必须联合固有免疫和适应性免疫中的抗肿瘤效应细胞一起应用, 才能达到清除肿瘤的目的. 巨噬细胞具有极化现象(Mφ1、Mφ2), 在免疫细胞和非免疫细胞构成的细胞网络及各种细胞因子构成的分子网络中, 巨噬细胞处于中心地位. 不同极化状态的细胞表达不同的表面分子, 分泌不同细胞因子, 功能也不同. γδT细胞在固有性肿瘤免疫监视和适应性肿瘤特异性应答中均具有重要作用. 巨噬细胞如能和γδT细胞进行综合性细胞免疫治疗, 将会明显提高肿瘤患者的细胞免疫治疗效果.
李瑗, 教授, 广西肿瘤研究所.
开发有效治疗肿瘤的方法已成为当今医学研究的重要课题, 细胞免疫治疗是一种采用多种免疫细胞治疗恶性肿瘤的新技术, 能提高患者免疫系统对肿瘤抗原的识别、提呈和杀伤能力, 达到减少肿瘤复发和转移的目的.
Baron-Bodo等在体外用GM-CSF、IFN-γ培养Mφ1, 并证实Mφ1可通过杀伤肿瘤细胞和限制肿瘤细胞的扩增, 发挥抗肿瘤作用; Corvaisier等研究证实, γδT细胞能识别肿瘤细胞和自身细胞, 对自体肿瘤细胞和异体肿瘤细胞均有杀伤作用, 对正常细胞无杀伤作用.
目前国内外有关巨噬细胞和γδT细胞相互作用的研究主要局限在炎症组织, 尚未见有关巨噬细胞对γδT细胞抗肿瘤作用的影响方面的报道, 特别是比较不同极化状态的巨噬细胞对γδT细胞抗肿瘤作用的研究. 实验发现Mφ1能够促进γδT细胞生长, 而且能够提高γδT细胞对胃癌SGC-7901细胞的杀伤活性, Mφ2对γδT细胞作用不明显.
Mφ1能够促进γδT细胞生长, 为γδT细胞提供了一种增效途径; 而且能够提高γδT细胞对胃癌细胞SGC-7901的杀伤活性, 为Mφ1和γδT细胞用于胃癌的免疫治疗提供了一定理论依据; Mφ2对γδT细胞作用不明显.
本研究内容丰富, 研究结果数据详实, 有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况 分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 2. | Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Ann Rev Immunol. 2004;22:329-360. [PubMed] [DOI] |
| 3. | Siveen KS, Kuttan G. Role of macrophages in tumour progression. Immunol Lett. 2009;123:97-102. [PubMed] [DOI] |
| 4. | Chen JJ, Lin YC, Yao PL, Yuan A, Chen HY, Shun CT, Tsai MF, Chen CH, Yang PC. Tumor-associated macrophages: the double-edged sword in cancer progression. J Clin Oncol. 2005;23:953-964. [PubMed] [DOI] |
| 5. | Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 2008;8:958-969. [PubMed] [DOI] |
| 6. | Coffelt SB, Hughes R, Lewis CE. Tumor-associated macrophages: effectors of angiogenesis and tumor progression. Biochim Biophys Acta. 2009;1796:11-18. [PubMed] |
| 7. | Verreck FA, de Boer T, Langenberg DM, Hoeve MA, Kramer M, Vaisberg E, Kastelein R, Kolk A, de Waal-Malefyt R, Ottenhoff TH. Human IL-23-producing type 1 macrophages promote but IL-10-producing type 2 macrophages subvert immunity to (myco)bacteria. Proc Natl Acad Sci U S A. 2004;101:4560-4565. [PubMed] [DOI] |
| 8. | Kabelitz D, Wesch D, He W. Perspectives of gammadelta T cells in tumor immunology. Cancer Res. 2007;67:5-8. [PubMed] [DOI] |
| 9. | Casetti R, Martino A. The plasticity of gamma delta T cells: innate immunity, antigen presentation and new immunotherapy. Cell Mol Immunol. 2008;5:161-170. [PubMed] |
| 10. | Born WK, Reardon CL, O'Brien RL. The function of gammadelta T cells in innate immunity. Curr Opin Immunol. 2006;18:31-38. [PubMed] [DOI] |
| 11. | Moser B, Brandes M. Gammadelta T cells: an alternative type of professional APC. Trends Immunaol. 2006;27:112-118. [PubMed] [DOI] |
| 12. | Kobayashi H, Tanaka Y, Yagi J, Osaka Y, Nakazawa H, Uchiyama T, Minato N, Toma H. Safety profile and anti-tumor effects of adoptive immunotherapy using gamma-delta T cells against advanced renal cell carcinoma: a pilot study. Cancer Immunol Immunother. 2007;56:469-476. [PubMed] [DOI] |
| 13. | Bennouna J, Bompas E, Neidhardt EM, Rolland F, Philip I, Galéa C, Salot S, Saiagh S, Audrain M, Rimbert M. Phase-I study of Innacell gammadelta, an autologous cell-therapy product highly enriched in gamma9delta2 T lymphocytes, in combination with IL-2, in patients with metastatic renal cell carcinoma. Cancer Immunol Immunother. 2008;57:1599-609. [PubMed] [DOI] |
| 16. | 陈 复兴, 刘 军权, 冯 霞, 张 娟, 张 颂. 一种体外扩增人γδT细胞的新方法. 细胞与分子免疫学杂志. 2007;23:662-664. |
| 19. | Baron-Bodo V, Doceur P, Lefebvre ML, Labroquère K, Defaye C, Cambouris C, Prigent D, Salcedo M, Boyer A, Nardin A. Anti-tumor properties of human-activated macrophages produced in large scale for clinical application. Immunobiology. 2005;210:267-277. [PubMed] [DOI] |
| 20. | Wallace PK, Romet-Lemonne JL, Chokri M, Kasper LH, Fanger MW, Fadul CE. Production of macrophage-activated killer cells for targeting of glioblastoma cells with bispecific antibody to FcgammaRI and the epidermal growth factor receptor. Cancer Immunol Immunother. 2000;49:493-503. [PubMed] [DOI] |
| 21. | Solinas G, Germano G, Mantovani A, Allavena P. Tumor-associated macrophages (TAM) as major players of the cancer- related inflammation. J Leukoc Biol. 2009;86:1065-1073. [PubMed] [DOI] |
| 22. | Gordon S. Alternative activation of macrophages. Nat Rev Immunol. 2003;3:23-35. [PubMed] |
| 23. | 陈 复兴, 刘 军权, 冯 霞, 王 涛, 张 娟, 张 颂, 陈 桂林. 人末梢血γδT细胞对消化系统肿瘤细胞的杀伤作用. 世界华人消化杂志. 2007;15:1591-1595. [DOI] |
| 24. | Beck BH, Kim HG, Kim H, Samuel S, Liu Z, Shrestha R, Haines H, Zinn K, Lopez RD. Adoptively transferred ex vivo expanded gammadelta-T cells mediate in vivo antitumor activity in preclinical mouse models of breast cancer. Breast Cancer Res Treat. 2009; Sep 18. [Epub ahead of print]. [PubMed] [DOI] |
| 25. | Kondo M, Sakuta K, Noguchi A, Ariyoshi N, Sato K, Sato S, Sato K, Hosoi A, Nakajima J, Yoshida Y. Zoledronate facilitates large-scale ex vivo expansion of functional gammadelta T cells from cancer patients for use in adoptive immunotherapy. Cytotherapy. 2008;10:842-856. [PubMed] [DOI] |
| 26. | Yuasa T, Sato K, Ashihara E, Takeuchi M, Maita S, Tsuchiya N, Habuchi T, Maekawa T, Kimura S. Intravesical administration of gammadelta T cells successfully prevents the growth of bladder cancer in the murine model. Cancer Immunol Immunother. 2009;58:493-502. [PubMed] [DOI] |
| 27. | Viey E, Fromont G, Escudier B, Morel Y, Da Rocha S, Chouaib S, Caignard A. Phosphostim-activated gamma delta T cells kill autologous metastatic renal cell carcinoma. J Immunol. 2005;174:1338-1347. [PubMed] [DOI] |
| 28. | 韩 露艳, 费 素娟, 陈 复兴, 刘 军权, 陈 桂林. 唑来膦酸对人末梢血γδT细胞杀伤胃癌细胞株SGC-7901作用的影响. 世界华人消化杂志. 2009;17:181-185. [DOI] |
| 29. | Dalton JE, Pearson J, Scott P, Carding SR. The interaction of gamma delta T cells with activated macrophages is a property of the V gamma 1 subset. J Immunol. 2003;171:6488-6494. [PubMed] |
| 30. | Dalton JE, Howell G, Pearson J, Scott P, Carding SR. Fas-Fas ligand interactions are essential for the binding to and killing of activated macrophages by gamma delta T cells. J Immunol. 2004;173:3660-3667. [PubMed] |
| 31. | Dieli F, Caccamo N, Meraviglia S, Ivanyi J, Sireci G, Bonanno CT, Ferlazzo V, La Mendola C, Salerno A. Reciprocal stimulation of gammadelta T cells and dendritic cells during the anti-mycobacterial immune response. Eur J Immunol. 2004;34:3227-3235. [PubMed] [DOI] |