修回日期: 2009-11-09
接受日期: 2009-11-16
在线出版日期: 2010-01-08
目的: 研究BrdU标记猪脂肪干细胞(adipose-derived stem cells, ADSCs)的最佳剂量及时间, 探讨其作为干细胞标记示踪方法的可行性.
方法: 自中华实验猪背部提取脂肪组织, 采用贴壁法分离培养ADSCs, 取第3代细胞以终浓度分别为10、15、20、25及30 μmol/L BrdU进行标记; 另一孔不含BrdU作为对照组, 分别培养12、24、48、72及96 h. 免疫荧光法检测各组细胞BrdU标记率, 找出BrdU的最佳标记方法, 通过台盼蓝排斥试验、MTT及细胞凋亡检测, 观察BrdU对ADSCs生长情况的影响. 对第3代的ADSCs采用最佳标记方法后更换普通培养基继续培养, 适时传代, 连续检测第4、5、6、7、8代ADSCs的BrdU标记率.
结果: 原代培养的ADSCs的形态主要为长梭形, 第3代ADSCs经BrdU标记后胞核呈红色荧光, 随浓度的升高及时间的延长, BrdU阳性标记率逐渐升高, 以终浓度20 μmol/L BrdU标记48 h后阳性率达90%以上, 且连续传5代标记率仍达40%. MTT、台盼蓝排斥试验及细胞凋亡检测发现BrdU对ADSCs生长增殖基本无影响.
结论: BrdU标记ADSCs的最佳剂量和时间为20 μmol/L和48 h, 该方法标记率高, 对细胞影响小, 可用于动态研究ADSCs在移植体内生长、分化.
引文著录: 顾广祥, 施晓雷, 杭化莲, 丁义涛. BrdU作为脂肪干细胞标记示踪法的可行性. 世界华人消化杂志 2010; 18(1): 14-19
Revised: November 9, 2009
Accepted: November 16, 2009
Published online: January 8, 2010
AIM: To investigate the optimal dosage and treatment duration of bromodeoxyuridine (BrdU) for labeling of porcine adipose-derived stem cells (ADSCs) in vitro and explore the feasibility of using BrdU as a tracer to label stem cells.
METHODS: ADSCs were isolated from swine fat tissue by type I collagenase digestion and purified by differential adhesion. ADSCs at passage 3 were labeled with BrdU at different concentrations (10, 15, 20, 25 and 30 μmol/L). The labeling rates were determined by immunofluorescence at 12, 24, 48, 72 and 96 h after incubation with BrdU to find the optimal labeling parameters. The impact of BrdU on the growth of ADSCs was examined by trypan blue exclusion, methyl thiazoly tetrazolium (MTT) assay and cell apoptosis assay. ADSCs at passage 3 were labeled with BrdU using the optimal labeling parameters and then cultured and passaged in essential medium without BrdU. The labeling rates in ADSCs between 4-8 passages were determined to observe the attenuation of BrdU incorporation.
RESULTS: The majority of primary ADSCs were fusiform in shape. After BrdU labeling, the nuclei of ADSCs showed red fluorescence. With the increase in labeling concentration and duration, the BrdU labeling rate gradually increased. After labeling with 20 μmol/L BrdU for 48 hours, the labeling rate exceeded 90%. The labeling rate decreased with increased passages, declining to 40% after 5 passages. MTT assay, trypan blue exclusion and cell apoptosis assay showed that BrdU labeling had no significant impact on the growth of ADSCs.
CONCLUSION: The optimal labeling dosage and duration of BrdU are 20 μmol/L and 48 hours, respectively. The BrdU-labeling method achieves a high labeling rate, has little impact on the growth of ADSCs and can therefore be used for dynamic observation of the survival, growth and differentiation of implanted ADSCs.
- Citation: Gu GX, Shi XL, Hang HL, Ding YT. Bromodeoxyuridine labeling of swine adipose-derived stem cells in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(1): 14-19
- URL: https://www.wjgnet.com/1009-3079/full/v18/i1/14.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i1.14
急性肝衰竭是一个非常严重的临床综合征, 死亡率高达80%-90%[1]. 近年来, 细胞移植为急性肝衰竭的治疗提供了一条新途径[2], 但仍存在着许多问题, 如细胞移植后, 常常不能区分供体细胞和宿主细胞, 不能观察植入的存活和生长情况, 也就难以对细胞移植的功效作出一个客观评价. 5-溴脱氧尿嘧啶核苷(bromodeoxyuridine, BrdU)作为近年出现的一种标志物, 具有操作简便、迅速、敏感等特点, 在肿瘤生物学、遗传学、分子生物学、药物代谢动力学及核医学等领域得到广泛应用. 因此, 本实验采用BrdU标记猪脂肪干细胞(adipose-derived stem cells, ADSCs), 探索BrdU对连续传代的ADSCs的标记方法及其条件, 为进一步研究ADSCs在宿主体内的分布、增殖和分化研究奠定基础.
中华实验猪, ♂, 体质量15-20 kg, 由南京鼓楼医院动物中心提供. Ⅰ型胶原酶、BrdU、小鼠抗BrdU一抗、MTT购自美国Sigma公司; 山羊抗小鼠IgG-TRITC购自Bioworld公司; DMEM/F12培养基、FBS、2.5 g/L胰酶、双抗购自美国Gibco公司; 倒置荧光显微镜购自德国Zeiss公司.
1.2.1 ADSC的分离、培养: 动物麻醉后, 于无菌条件下切取背部皮下脂肪5-10 mL, 剔除血管后, PBS反复冲洗, 剪成1 mm×1 mm×1 mm大小颗粒, 0.1% Ⅰ型胶原酶37 ℃消化60 min, 400 g离心10 min后去除上层脂肪细胞及上清液, 沉淀重悬后200目筛网过滤, PBS清洗3次后, 以5×104细胞的密度种植于含100 mL/L胎牛血清DMEM/F12培养液中, 24 h后首次换液弃除未贴壁细胞, 以后每2-3 d换液, 并于倒置显微镜下观察细胞生长, 待细胞生长融合到80%-90%时用2.5 g/L胰酶消化、传代. 第3代的ADSCs用于BrdU标记.
1.2.2 Brdu标记: 取第3代ADSCs, 以1×105的密度种植于预置盖玻片的6孔板中, 共5块, 培养箱中孵育48 h后, 每块分别加入终浓度为10、15、20、25和30 μmol/L的BrdU, 其中有一孔不含BrdU作为空白对照组, 分别孵育12、24、48、72及96 h后取出, 行免疫荧光染色.
1.2.3 免疫荧光染色: 细胞爬片取出后, 用40 g/L多聚甲醛固定30 min, PBS冲洗5 min, 3次; 2 mol/L的HCl室温下变性20-30 min, 0.1 mol/L的硼酸钠中和10 min, PBS冲洗5 min, 3次; 37 ℃预热的1.0 g/L胰酶消化20 min, PBS冲洗5 min, 3次; 5%的山羊血清封闭20 min, 去除多余的液体不洗; 抗BrdU一抗4 ℃湿盒过夜, PBS冲洗5 min, 3次; 山羊抗小鼠IgG-TRITC于37 ℃孵育1 h, PBS冲洗5 min, 3次; 加入适量抗荧光淬灭剂后封片, 荧光倒置显微镜下观察. 阳性对照为BrdU标记的ADSCs, 阴性对照为未经BrdU标记的ADSCs, 空白对照为PBS代替一抗.
1.2.4 MTT实验测定细胞增殖: 取第3代的ADSCs, 以5×103细胞的密度种植于96孔板中孵育48 h后, 加入20 μmol/L的BrdU继续培养, 以不含BrdU的细胞作为空白对照, 分别于实验第1、3、5、7、9天取出1个孔板, 换液后每孔加入20 μL 5 g/L的MTT, 37 ℃继续孵育4 h, 取出孔板, 加入150 μL的DMSO, 振荡10 min, 用酶标仪于490 nm波长处测定吸光值, 绘制细胞生长曲线.
1.2.5 台盼蓝排斥试验: 收集以浓度为20 μmol/L BrdU标记48 h的ADSCs, 制成单细胞悬液, 随机分成5份, 加入预先配制的0.4%台盼蓝溶液, 以未标记的ADSCs作为对照组, 光镜下观察细胞成活率.
1.2.6 细胞凋亡分析: 将BrdU标记与未标记的ADSCs用不含EDTA的胰酶消化制成单细胞悬液, 每个样品约含5×105个细胞, 加入500 μL的Binding Buffer及5 μL Annexin V-FITC混匀后, 再加入5 μL PI混匀, 室温避光反应15 min后立即用FACScan行流式细胞术定量检测, 同时以不加Annexin V-FITC及PI的标本作阴性对照.
1.2.7 BrdU标记后细胞生长观察: 将以浓度为20 μmol/L、BrdU标记48 h的第3代ADSCs进行传代培养, 以未经BrdU标记的细胞作为对照, 倒置显微镜下观察连续传代细胞的生长情况, 免疫荧光法观察细胞传代后的BrdU标记情况.
统计学处理 实验结果用mean±SD表示. 两组间采用成组资料t检验, 多组间比较采用单因素方差分析. 所有数据比较均采用SPSS15.0软件处理, P<0.05有统计学意义.
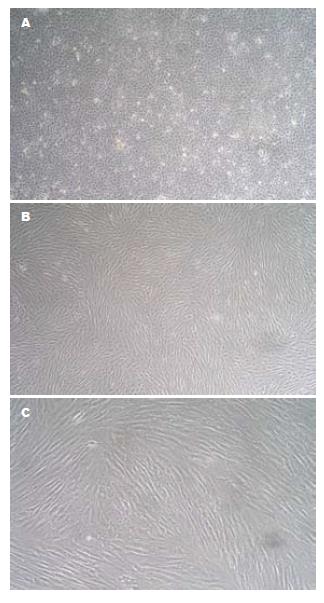
原代细胞培养: 24 h后有少量梭形细胞贴壁, 形态不一; 2-3 d细胞呈短梭形, 形态不一, 并有小集落形成; 7 d后细胞生长融合成片, 聚集形式有一定的方向性, 但杂质细胞仍较多(图1A). 传至第3代时细胞呈长梭形, 纯度较高(图1B, C).
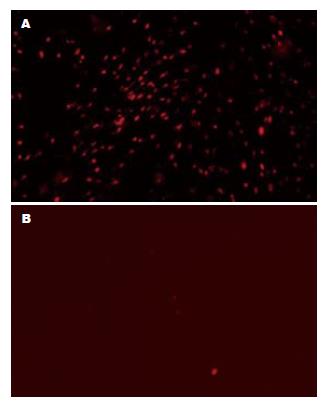
免疫荧光结果显示: 不同浓度BrdU标记ADSCs, 10、15 μmol/L组的标记率远低于20、25、30 μmol/L组, 除12 h外有统计学差异(P<0.05), 但后3组之间无统计学差异(P>0.05); 不同标记时间显示, BrdU标记率随时间延长均有所增加, 48 h时BrdU标记率达90%以上(图2A). 不同浓度BrdU在不同时间的阳性标记率见表1.
| 浓度(μmol/L) | 12 h | 24 h | 48 h | 72 h | 96 h |
| 10 | 32.52±3.35 | 59.62±2.72 | 88.38±2.24 | 90.68±2.54 | 91.38±2.69 |
| 15 | 33.06±3.55 | 61.56±2.83 | 89.22±2.55 | 91.36±2.53 | 92.58±2.27 |
| 20 | 35.44±3.82 | 65.86±1.15a | 92.74±2.58a | 94.80±2.20a | 95.52±1.51a |
| 25 | 36.10±4.88 | 67.78±2.28 | 93.12±2.48 | 94.92±2.20 | 95.90±1.23 |
| 30 | 37.48±4.31 | 67.98±3.52 | 94.80±1.63 | 95.68±2.61 | 96.16±1.14 |
| 0 | 0 | 0 | 0 | 0 | 0 |
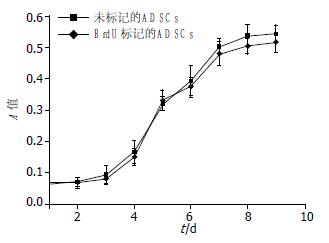
两组细胞生长曲线均呈倒"S"型, BrdU标记与未标记的细胞在各时间点均无统计学差异(P>0.05), 两者生长趋势基本一致(图3).
BrdU标记后的ADSCs活细胞率为95.1%±2.0%; 未标记的ADSCs, 活细胞率为96.2%±1.5%, 两者无统计学差异(P>0.05).
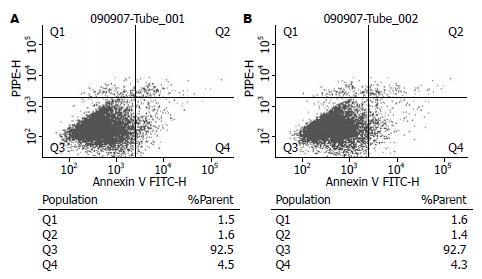
流式细胞仪检测结果显示(图4), BrdU标记的ADSCs中凋亡细胞(Q2+Q4)约占6.1%, 与未标记的ADSCs的凋亡细胞(约占5.7%)结果基本一致.
倒置显微镜下观察标记与未标记的ADSCs, 其形态与生长速度无明显差异, 随着传代的增加, BrdU标记率逐渐下降, 连续传5代仍可见阳性细胞, 标记率约为40%.
目前, 细胞移植是延长急性肝功能衰竭患者生命、并向肝移植手术过渡的一种替代性治疗手段. 近年来研究较多的细胞为胚胎干细胞和骨髓间充质干细胞, 但胚胎干细胞存在着免疫排斥及伦理问题, 骨髓间充质干细胞的获取具有创伤, 且来源有限, 限制了临床的广泛应用. 自从Zuk等[3]首次从抽脂术中抽取的脂肪组织分离出干细胞以来, 一些学者也先后从动物或者人的脂肪组织中分离出ADSCs[4-6], 在体外培养中, ADSCs表现出与MSCs类似的分化潜能[ 7, 8], 能分化为多种不同的细胞, 如成骨细胞[9]、软骨细胞[4], 神经细胞[10]、内皮细胞[11]、心肌细胞[12]及肝细胞[13]等. 由于ADSCs容易大量获取, 且体外具有强大的增殖和分化能力, 是细胞移植中细胞的理想来源.
为了证实移植细胞能够在宿主体内存活及移植后宿主局部的组织形态、功能的改变是由移植细胞引起的, 需要对移植细胞在体内的存活、分布及增殖、分化进行检测. 为区分移植细胞和宿主细胞, 需要有效的方法对移植细胞进行标记. 目前细胞标记主要有荧光染料标记(DAPI标记、Dil标记)、核素标记(3H-TdR标记)、Y染色体标记、基因转染(GFP)、磁标记细胞MRI活体示踪成像及BrdU标记法等. BrdU作为一种嘧啶类似物, 在细胞周期S期他可与内源性胸腺嘧啶核苷竞争掺入DNA中, 并随标记细胞增殖传代; 有研究表明BrdU标记和检测是反映细胞增殖及跟踪检测移植细胞动态变化的理想指标[14]. 与GFP标记方法相比, BrdU标记法操作简单, 费用低廉. 另有报道GFP对肝细胞、心肌及神经干细胞等有一定的细胞毒性[15]; 与核素标记法相比其避免了放射性污染, 安全性高; 与荧光染料相比, BrdU抗体不与胸腺嘧啶发生交叉反应, 有很高的特异性, 其在冰冻或石蜡切片中均可被显示; 在研究干细胞体内移植后的分化时, 更可采用双标法显示干细胞的其他特性, 故能对所标记的移植细胞起着很好的"跟踪"作用. 本实验利用BrdU标记连续培养的猪ADSCs, 由于细胞处于S期时BrdU才能掺入到DNA中, 所以在细胞进入对数生长期时, 给予10、15、20、25及30 μmol/L浓度BrdU标记, 在标记12, 24, 48, 72, 96 h后进行免疫荧光染色鉴定, 结果显示10、15 μmol/L组的标记率远低于20、25、30 μmol/L组, 而后3组的标记率没有统计学差异, 说明BrdU的标记率随着BrdU浓度的增加而增大, 浓度为20 μmol/L时达到最大. 可能是因为10、15 μmol/L组内所含BrdU量相对不足, DNA分子周围分布的BrdU量较少, 从而减慢了BrdU插入DNA分子的速度, 而20 μmol/L组内的BrdU含量充足, 所以即使浓度再增加, 也不能使标记率明显提高; 20 μmol/L组内标记不同时间结果显示, 48、72、96 h组的标记率远高于前两组, 说明BrdU的标记率随着时间的延长而增大, 48 h时达到90%以上. 因为BrdU插入DNA时需要一定的时间, 12、24 h时间相对较短, 而48 h已基本达到了在此种条件下应用此种方式进行标记所能达到的最大标记率, 考虑到随着时间的延长, 培养液中养分的减少及代谢产物的增加将影响细胞的增殖, 因此我们选择猪ADSCs的最佳标记浓度和时间为20 μmo/L和48 h, 与文献报道基本相似[16-18]. 通过MTT、台盼蓝排斥试验及细胞凋亡检测BrdU标记对细胞增殖的影响, MTT结果显示, BrdU标记和未标记的两组细胞标记率在各时间点均无统计学差异, 两组细胞生长曲线接近, 活细胞率、细胞凋亡检测结果显示两组亦无统计学差异, 表明BrdU对细胞的生长增殖基本无影响. 标记后的细胞在传代的过程中BrdU标记率不断衰减, 但经过4 wk的体外扩增, 细胞的标记率约为40%, 提示移植细胞可在体内连续追踪观察, 为进一步追踪移植细胞在体内的动态变化提供理论指导. 总之, 利用BrdU标记的ADSCs的方法简单, 安全, 标记率高, 可作为跟踪监测ADSCs移植治疗急性肝衰竭的理想指标, 为今后进一步研究ADSCs在移植体内的增殖分化奠定基础.
近年来, 细胞移植为急性肝衰竭的治疗提供了一条新途径, 但仍存在着许多问题, 如细胞移植后, 常常不能区分供体细胞和宿主细胞, 不能观察植入的存活和生长情况, 也就难以对细胞移植的功效作出一个客观评价. BrdU作为近年出现的一种标志物, 具有操作简便、迅速、敏感等特点, 在肿瘤生物学、遗传学、分子生物学、药物代谢动力学及核医学等领域得到广泛应用.
余宏宇, 教授, 中国人民解放军第二军医大学第二附属医院(上海长征医院)病理科.
近年来研究较多的细胞为胚胎干细胞和骨髓间充质干细胞, 但胚胎干细胞存在着免疫排斥及伦理问题, 骨髓间充质干细胞的获取具有创伤, 且来源有限, 限制了临床的广泛应用.
有研究表明BrdU标记和检测是反映细胞增殖及跟踪检测移植细胞动态变化的理想指标.
本研究方法合理, 结果可信, 结论可靠, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Vaquero J, Blei AT. Etiology and management of fulminant hepatic failure. Curr Gastroenterol Rep. 2003;5:39-47. [PubMed] [DOI] |
| 2. | Nagata H, Ito M, Cai J, Edge AS, Platt JL, Fox IJ. Treatment of cirrhosis and liver failure in rats by hepatocyte xenotransplantation. Gastroenterology. 2003;124:422-431. [PubMed] [DOI] |
| 3. | Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001;7:211-228. [PubMed] [DOI] |
| 4. | Huang JI, Beanes SR, Zhu M, Lorenz HP, Hedrick MH, Benhaim P. Rat extramedullary adipose tissue as a source of osteochondrogenic progenitor cells. Plast Reconstr Surg. 2002;109:1033-1041; discussion 1042-1043. [PubMed] [DOI] |
| 5. | Winter A, Breit S, Parsch D, Benz K, Steck E, Hauner H, Weber RM, Ewerbeck V, Richter W. Cartilage-like gene expression in differentiated human stem cell spheroids: a comparison of bone marrow-derived and adipose tissue-derived stromal cells. Arthritis Rheum. 2003;48:418-429. [PubMed] [DOI] |
| 6. | Aust L, Devlin B, Foster SJ, Halvorsen YD, Hicok K, du Laney T, Sen A, Willingmyre GD, Gimble JM. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 2004;6:7-14. [PubMed] [DOI] |
| 7. | Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-147. [PubMed] [DOI] |
| 8. | Strem BM, Hicok KC, Zhu M, Wulur I, Alfonso Z, Schreiber RE, Fraser JK, Hedrick MH. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 2005;54:132-141. [PubMed] [DOI] |
| 9. | Weinzierl K, Hemprich A, Frerich B. Bone engineering with adipose tissue derived stromal cells. J Craniomaxillofac Surg. 2006;34:466-471. [PubMed] [DOI] |
| 10. | Ning H, Lin G, Lue TF, Lin CS. Neuron-like differentiation of adipose tissue-derived stromal cells and vascular smooth muscle cells. Differentiation. 2006;74:510-518. [PubMed] [DOI] |
| 11. | Planat-Benard V, Silvestre JS, Cousin B, André M, Nibbelink M, Tamarat R, Clergue M, Manneville C, Saillan-Barreau C, Duriez M. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation. 2004;109:656-663. [PubMed] [DOI] |
| 12. | Rangappa S, Fen C, Lee EH, Bongso A, Sim EK. Transformation of adult mesenchymal stem cells isolated from the fatty tissue into cardiomyocytes. Ann Thorac Surg. 2003;75:775-779. [PubMed] [DOI] |
| 13. | Seo MJ, Suh SY, Bae YC, Jung JS. Differentiation of human adipose stromal cells into hepatic lineage in vitro and in vivo. Biochem Biophys Res Commun. 2005;328:258-264. [PubMed] [DOI] |
| 14. | Kaminker P, Plachot C, Kim SH, Chung P, Crippen D, Petersen OW, Bissell MJ, Campisi J, Lelièvre SA. Higher-order nuclear organization in growth arrest of human mammary epithelial cells: a novel role for telomere-associated protein TIN2. J Cell Sci. 2005;118:1321-1330. [PubMed] [DOI] |
| 15. | Liu HS, Jan MS, Chou CK, Chen PH, Ke NJ. Is green fluorescent protein toxic to the living cells? Biochem Biophys Res Commun. 1999;260:712-717. [PubMed] [DOI] |
| 16. | Staszkiewicz J, Gimble J, Cain C, Dietrich M, Burk D, Kirk-Ballard H, Gawronska-Kozak B. Flow cytometric and immunohistochemical detection of in vivo BrdU-labeled cells in mouse fat depots. Biochem Biophys Res Commun. 2009;378:539-544. [PubMed] [DOI] |
| 17. | Sauerzweig S, Baldauf K, Braun H, Reymann KG. Time-dependent segmentation of BrdU-signal leads to late detection problems in studies using BrdU as cell label or proliferation marker. J Neurosci Methods. 2009;177:149-159. [PubMed] [DOI] |
| 18. | Zhu WZ, Li X, Qi JP, Tang ZP, Wang W, Wei L, Lei H. Experimental study of cell migration and functional differentiation of transplanted neural stem cells co-labeled with superparamagnetic iron oxide and BrdU in an ischemic rat model. Biomed Environ Sci. 2008;21:420-424. [PubMed] [DOI] |