修回日期: 2009-02-16
接受日期: 2009-02-16
在线出版日期: 2009-03-18
目的: 探讨选择性诱导型一氧化氮合酶抑制剂氨基胍(aminoguanidine, AG)对肝硬化大鼠门脉高压性胃黏膜病变的防治作用及其机制.
方法: 将SD大鼠30只随机分为对照组(n = 10)、模型组(n = 10)和AG组(n = 10), 予400 mL/L CCl4皮下注射12 wk建立肝硬化大鼠模型, AG组为皮下注射CCl4同时予AG饮用. 观察比较各组大鼠胃黏膜形态及组织学变化, 应用免疫组化法检测胃黏膜诱导型一氧化氮合酶(iNOS)的表达, 并测定胃黏膜溃疡指数、门静脉压力.
结果: AG组胃黏膜病变程度较模型组减轻, 溃疡指数明显低于模型组(3.00±2.31 vs 10.60±3.47, P<0.01); 模型组胃黏膜iNOS吸光度、面密度值均较对照组增高(0.64±0.04 vs 0.25±0.03; 0.344±0.068 vs 0.017±0.008, 均P<0.01), AG组胃黏膜iNOS吸光度值、面密度值(0.46±0.09, 0.159±0.021)均较模型组明显下降(均P<0.01). AG组门脉压力较模型组降低.
结论: AG可在一定程度上减轻门脉高压性胃黏膜病变, 其机制可能主要通过抑制胃黏膜iNOS表达.
引文著录: 王凝, 展玉涛, 高福生, 刘宾. 选择性iNOS抑制剂对肝硬化大鼠门脉高压性胃黏膜病变的影响. 世界华人消化杂志 2009; 17(8): 813-816
Revised: February 16, 2009
Accepted: February 16, 2009
Published online: March 18, 2009
AIM: To investigate the effect and mechanism of aminoguanidine (AG) on the portal hypertensive gastropathy in cirrhotic rats.
METHODS: Thirty male SD rats were randomly divided into three groups: control group (n = 10), model group (n = 10) and AG treatment group (n = 10) (AG group). The model group was induced through subcutaneous injection of CCl4 for 12 weeks, AG group was given subcutaneous injection of CCl4 together with oral administration of AG. The morphological and histological changes in gastric mucosa were evaluated. The expression of iNOS in gastric mucosa was detected by SABC immunohistochemical methods. And the ulcer-index (UI) of gastric mucosa, and portal pressure were measured in each group.
RESULTS: Histological changes of gastric mucosa was milder and ulcer index of gastric mucosa was significantly lower in AG group than in model group (3.00 ± 2.31 vs 10.60 ± 3.47, P < 0.01). The expression of iNOS (optical density and area density) in gastric mucosa was significantly higher in model group than in control group (0.64 ± 0.04 vs 0.25 ± 0.03; 0.344 ± 0.068 vs 0.017 ± 0.008, both P < 0.01). Optical density and area density were significantly lower in AG group than in model group (0.46 ± 0.09 vs 0.64 ± 0.04; 0.159 ± 0.021 vs 0.344 ± 0.068, both P < 0.01), and the portal pressure were lower in AG group than in model group.
CONCLUSION: Aminoguanidine may ameliorate the development of portal hypertensive gastropathy through significantly inhibiting the expression of iNOS in gastric mucosa.
- Citation: Wang N, Zhan YT, Gao FS, Liu B. Effect of iNOS inhibitor on portal hypertensive gastropathy in cirrhotic rats. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 813-816
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/813.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.813
门脉高压性胃病(portal hypertensive gastropathy, PHG)是肝硬化常见并发症, 且已成为重要致死病因[1], 目前尚缺乏有效治疗手段. 近年研究表明NO是肝硬化及门脉高压形成的重要因素, 并可能参与门脉高压性胃病的形成[2], 参与致病的NO则主要在病理状态下由诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)合成. 氨基胍(aminoguanidine, AG)是近年发现的一种特异性iNOS抑制剂, 国外学者已在动物实验中观察到AG可改善门脉高压时的高动力循环状态[3-4], 但其对门脉压力及门脉高压性胃病有无防治作用目前尚无深入研究. 本实验应用CCl4制备大鼠肝硬化模型, 旨在观察AG对门脉高压性胃黏膜病变的作用及可能机制.
健康♂SD大鼠30只, 体质量200±50 g, 由北京同仁医院实验动物中心提供. CCl4及橄榄油购自北京化学试剂公司; 氨基胍购自美国SIGMA公司; iNOS试剂、SABC试剂盒及DAB显色剂购自武汉博士德生物工程有限公司.
1.2.1 分组与造模: 健康♂SD大鼠随机分为模型组(n = 10), 予sc 3 mL/kg 的400 mL/L CCl4橄榄油溶液, 每周2次, 共12 wk; AG组(n = 10)按模型组注射CCl4同时予氨基胍50 mg/(kg·d)饮用(即予1/1000氨基胍水溶液自由饮用[5]); 对照组(n = 10)予sc橄榄油3 mL/kg, 每周2次.
1.2.2 门脉压力测定: 氯氨酮40 mg/kg ip麻醉后正中切口开腹, 分离门静脉主干, 以26号套管针穿刺, 接测压管.
1.2.3 组织标本制备及胃黏膜溃疡指数测定: 处死后迅速取出肝脏及胃, 将胃沿大弯侧剪开, 生理盐水冲洗后展平, 观察糜烂、出血情况, 按Guth标准[6]记录溃疡指数. 将部分肝脏及胃放入100 g/L甲醛中固定, 常规石蜡包埋, 连续4 µm切片行HE染色.
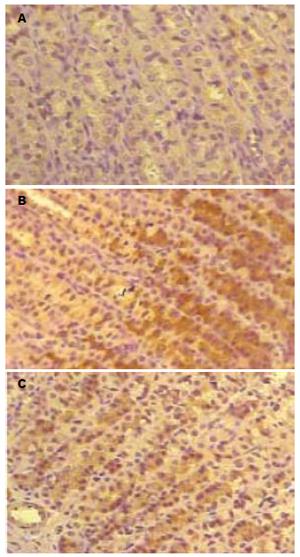
1.2.4 胃黏膜iNOS染色及图像分析: 按照SABC试剂盒提供的操作方法进行免疫组化染色, 一抗为兔抗-iNOS IgG多克隆抗体, 工作浓度1:200, PBS为阴性对照, 二抗为生物素化山羊抗兔IgG, 最后以DAB显色(显微镜下控制反应时间约5 min), 苏木精复染, 脱水透明封片. 应用医学图像分析管理系统测定iNOS阳性反应产物染色强度, 以吸光度值(A)表示; 测量阳性反应产物的面积与其窗口面积的比值, 记做面密度值(area density, AD). 每张切片随机选取10个视野, 取均值.
统计学处理 应用SPSS11.5统计软件进行数据分析, 检测数据以mean±SD表示, 计量资料两组间比较采用t检验. P<0.05为差异具有显著性.
模型组大鼠肝脏呈黄褐色无光泽, 体积缩小, 表面呈大小不等结节样改变, 门静脉明显增粗、迂曲, 组织学证实肝硬化形成. AG组大鼠肝脏表面呈均一细小结节, 组织学示肝纤维化程度减轻.
文献报道大鼠门静脉压力(portal vessel pressure, PVP)大于16 cmH2O可诊断门脉高压[7]. 模型组PVP水平较对照组明显增高(19.23±3.64 cmH2O vs 9.25±1.30 cmH2O, P<0.01), 均存在门脉高压; AG组PVP较模型组明显降低, 有非常显著性差异(15.21±2.10 cmH2O vs 19.23±3.64 cmH2O, P<0.01).
对照组大鼠胃黏膜光滑; 模型组大鼠胃黏膜充血、糜烂明显, 溃疡形成伴出血, 组织学改变可见上皮细胞脱落、灶性坏死, 毛细血管扩张, 黏膜下水肿等, 黏膜下血管尤以小静脉扩张、迂曲明显; AG组大鼠胃黏膜充血、糜烂病变及组织学改变均较模型组明显减轻. 胃黏膜溃疡指数测定示模型组胃黏膜溃疡指数较对照组明显增高, 有非常显著性差异(P<0.01); AG组胃黏膜溃疡指数明显低于模型组, 有非常显著性差异(P<0.01, 表1).
本研究示肝硬化模型组大鼠均出现明显胃黏膜病变, 胃黏膜iNOS表达较对照组明显升高. 在肝硬化形成过程中给予AG干预治疗, 则可见AG组大鼠胃黏膜病变程度较肝硬化模型组明显减轻, 胃黏膜iNOS表达较模型组明显降低(P<0.01), 提示AG对胃黏膜iNOS合成有明显抑制作用, 导致NO生成减少, 胃黏膜病变程度减轻; 另一方面我们也观察到AG组大鼠PVP水平较模型组降低, 肝脏纤维化程度减轻, 提示AG对降低门脉压力、改善肝脏病理变化也有一定作用, 与Tsugawa et al[8]报道一致.
目前研究认为NO参与了肝硬化门脉高压的形成, 而门脉高压所致门-体分流引起内毒素血症, 内毒素刺激TNF-α、IFN-γ、ET-1、IL-1等细胞因子大量产生, 可刺激包括肝内及胃黏膜iNOS的表达及活性明显增强[9], 使局部及循环血内NO合成增加, 并持续大量产生形成恶性循环. 过量合成的NO一方面使胃黏膜及黏膜下血管显著扩张, 即"主动充血"; 另一方面由于门脉高压, 致胃黏膜血液回流受阻、血液淤滞, 即"被动充血", 二者的共同作用导致胃黏膜有效循环血流量显著减少; 同时Tarnawski et al经实验证实[10]过量NO通过细胞毒作用可引起细胞和组织的炎性损伤; 过量NO还可破坏胃黏膜的防御机制[11], 导致胃肠运动障碍[12], 并可能增加胃酸分泌[13-14]等.
病理状态下产生的过量NO通过多个途径参与PHG发生, 是PHG发生中的一重要因素, 而病理状态NO主要由iNOS生成, AG正是选择性iNOS抑制剂. 1992年Corbett et al[15]首先做了这一报道, 发现AG可在NO的合成过程中起竞争性抑制作用. 结合本实验, AG明显抑制了胃黏膜iNOS表达, 从而有效减少过量NO生成, 随着NO生成减少, 即可通过改善黏膜充血、淤血状态, 减轻组织炎性损伤, 保护线粒体功能, 改善胃肠道的动力[16-17], 减少有害物质与胃黏膜接触的时间等途径减轻PHG程度, 这可能是AG防治作用的主要机制. 另一方面, 从本次实验结果看, AG可有效降低门脉压力,减轻肝硬化程度, 我们先前的研究也证实AG可通过减少晚期糖基化终末产物减轻肝脏病变[18]. 这可能是AG减轻PHG的另一机制.
总之, 在肝硬化门脉高压时胃黏膜iNOS表达显著增加, 胃黏膜病变严重; 应用AG干预后, 胃黏膜iNOS表达显著降低, 胃黏膜病变相应减轻. 认为AG对门脉高压性胃病的形成有一定防治作用, 其主要机制是通过减少胃黏膜iNOS表达及NO合成, 他可能为PHG的临床治疗提供一条新的途径. 而AG防治PHG可能还存在其他一些途径如降低门脉高压、改善肝功能、减轻肝硬化程度等, 值得我们进一步深入研究.
门脉高压性胃病是引起肝硬化上消化道出血的重要病因之一, 目前缺乏有效治疗手段.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科; 郑鹏远, 教授, 郑州大学第二附属医院消化科
NO, iNOS在PHG形成中的重要作用是近年研究热点, 其他尚包括TNF-α、IFN-γ、ET-1、CO等热点因子, 但其形成机制复杂, 尚未寻找到合适的治疗切入点, 本研究尚处于初步探索阶段, 缺乏大样本及更细致深入研究, 最终希望能进入临床研究阶段.
国外动物实验中观察到AG对内毒素休克性肝损伤或免疫性肝损伤有一定保护作用, 并可改善肝硬化门脉高压时的高动力循环状态.
本文通过动物实验证明氨基胍可明显减轻PHG病变程度, 为临床应用提供实验依据及新的治疗思路.
本研究用选择性iNOS抑制剂对肝硬化大鼠门脉高压性胃黏膜病变的影响抑制剂对肝硬化大鼠门脉高压性胃黏膜病变的影响进行研究, 对消化内科常见的肝硬化的并发症立题, 选题准确, 有一定的理论意义和实用价值.
编辑: 李军亮 电编:何基才
| 1. | de Franchis R, Primignani M. Natural history of portal hypertension in patients with cirrhosis. Clin Liver Dis. 2001;5:645-663. [PubMed] [DOI] |
| 3. | Wei CL, Hon WM, Lee KH, Khoo HE. Chronic administration of aminoguanidine reduces vascular nitric oxide production and attenuates liver damage in bile duct-ligated rats. Liver Int. 2005;25:647-656. [PubMed] [DOI] |
| 4. | Lee FY, Wang SS, Tsai YT, Lin HJ, Lin HC, Chu CJ, Wu SL, Tai CC, Lee SD. Aminoguanidine corrects hyperdynamic circulation without ameliorating portal hypertension and portal hypertensive gastropathy in anesthetized portal hypertensive rats. J Hepatol. 1997;26:687-693. [PubMed] [DOI] |
| 5. | Soulis-Liparota T, Cooper M, Papazoglou D, Clarke B, Jerums G. Retardation by aminoguanidine of development of albuminuria, mesangial expansion, and tissue fluorescence in streptozocin-induced diabetic rat. Diabetes. 1991;40:1328-1334. [PubMed] [DOI] |
| 6. | Lo SK, Leung FW, Guth PH. Protection against absolute-ethanol-induced gastric antral and corpus mucosal injury. A gross and histologic study. Dig Dis Sci. 1988;33:1403-1408. [PubMed] [DOI] |
| 7. | Schneider AR, Benz C, Adamek HE, Jakobs R, Riemann JF, Arnold JC. Minilaparoscopy versus conventional laparoscopy in the diagnosis of hepatic diseases. Gastrointest Endosc. 2001;53:771-775. [PubMed] [DOI] |
| 8. | Tsugawa K, Hashizume M, Migou S, Kishihara F, Kawanaka H, Tomikawa M, Tanoue K, Sugimachi K. Role of nitric oxide and endothelin-1 in a portal hypertensive rat model. Scand J Gastroenterol. 2000;35:1097-1105. [PubMed] [DOI] |
| 9. | Helmer KS, West SD, Shipley GL, Chang L, Cui Y, Mailman D, Mercer DW. Gastric nitric oxide synthase expression during endotoxemia: implications in mucosal defense in rats. Gastroenterology. 2002;123:173-186. [PubMed] [DOI] |
| 10. | Tarnawski AS, Tomikawa M, Kawanaka H. Increased oxygen free radicals, nitrotyrosine and enhanced lipid peroxydation in portal hypertensive gastric mucosa: A key to increased susceptibility to injury. Gastroenterology. 1999;116:A1282. |
| 11. | Baatar D, Kitano S, Yoshida T, Bandoh T, Ninomiya K, Tsuboi S. The role of nitric oxide in the inhibition of gastric epithelial proliferation in portal hypertensive rats. J Hepatol. 1999;30:1099-1104. [PubMed] [DOI] |
| 12. | Guslandi M. Nitric oxide: an ubiquitous actor in the gastrointestinal tract. Dig Dis. 1994;12:28-36. [PubMed] [DOI] |
| 15. | Corbett JA, Tilton RG, Chang K, Hasan KS, Ido Y, Wang JL, Sweetland MA, Lancaster JR, Williamson JR, McDaniel ML. Aminoguanidine, a novel inhibitor of nitric oxide formation, prevents diabetic vascular dysfunction. Diabetes. 1992;41:552-556. [PubMed] [DOI] |
| 16. | Patel S, Berrada D, Lembo A. Review of tegaserod in the treatment of irritable bowel syndrome. Expert Opin Pharmacother. 2004;5:2369-2379. [PubMed] [DOI] |
| 17. | Karras PJ, Michalos A, Smith ME. The role of nitric oxide in esophageal and gastric motor function in the cat. Gastroenterology. 1993;104:530A. |