修回日期: 2009-02-14
接受日期: 2009-02-16
在线出版日期: 2009-03-18
目的: 研究川芎有效成分川芎嗪对HSC-T6细胞增殖的影响.
方法: 以HSC-T6浓度2.0×108/L、每孔0.1 mL接种96孔板, 培养24 h后将不同稀释度的川芎嗪按0.1 mL/孔加入培养孔. 实验第4天以MTT法测定细胞A值, 计算增殖抑制率. 实验另设培养液空白对照组和细胞对照组.
结果: 川芎嗪具有较明显的抑制HSC-T6增殖的作用, 随着药物浓度的增大, 其对HSC-T6增殖的抑制作用逐渐增强, 有一定的量效关系. 川芎嗪原液和1/2、1/4倍稀释浓度时的抑制率分别为42.5%、28.8%和26%, 1/8以下浓度则抑制率虽然有所降低但下降趋势较缓.
结论: 川芎嗪有抑制HSC-T6细胞增殖的作用并有明显的浓度依赖.
引文著录: 汪晓军, 马赟, 李秀惠, 张奉学, 刘妮. 川芎嗪对HSC-T6增殖的影响. 世界华人消化杂志 2009; 17(8): 809-812
Revised: February 14, 2009
Accepted: February 16, 2009
Published online: March 18, 2009
AIM: To study influence of ligustrazine, the main ingredients of Chinese herbal medicine named Chuanxiong, on cell proliferation of hepatic-stellate-cell-T6 cell line.
METHODS: HSC-T6 was incubated into 96-well plate at a concentration of 2.0×108/L, 24 h later, ligustrazine at different concentrations were added 0.1 mL/well. At the forth day, value of cell was measured using MTT. The inhibition ratio of proliferation was measured.
RESULTS: Proliferation of HSC-T6 was inhibited by ligustrazine. The higher the concentration was, the stronger the inhibitory effects were. It had a dose-dependent relationship. Inhibition ratios of proliferation at different concentrations were 42.5%, 28.8%, and 26%, respectively.
CONCLUSION: Ligustrazine has obvious inhibitory effect on proliferation of HSC-T6 in a dosage-dependent manner.
- Citation: Wang XJ, Ma Y, Li XH, Zhang FX, Liu N. Influence of ligustrazine on the proliferation of hepatic stellate cell line T6. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 809-812
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/809.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.809
肝星状细胞(hepatic stellate cell, HSC)位于Disse间隙, 紧贴肝窦内皮细胞和肝细胞, 正常肝脏中HSC的数目很少, 约占肝细胞总数的5%-8%, 富含VitA脂滴, 参与VitA代谢和合成细胞外基质(extracellular matrix, ECM)[1-2]. 肝星状细胞是肝脏病理情况下ECM沉积的主要细胞来源, HSC在纤维化发生发展以及转变中处于中心细胞环节的地位. 川芎是活血化瘀中药的常用药, 川芎嗪是川芎的主要成分, 本研究旨在观察川芎嗪对HSC增殖的影响, 探讨其减少胶原分泌、阻止肝纤维化的作用方式.
HSC-T6细胞系, 上海中医药大学肝病研究所所长徐列明教授惠赠. 川芎嗪(C8H12N2: 136.2)由中药川芎经加工提取而成, 本实验所用的标准品川芎嗪购自广州市药物研究中心. 高糖DMEM培养液、HEPEPS购自美国Gibco公司; 胎牛血清购自中国医学科学院血液学研究所; L-谷氨酰胺、二甲基噻唑二苯基四唑溴盐(MTT)、二甲基亚砜(DMSO)和胰蛋白酶均购自Sigma公司; EDTA自上海生工生物工程公司Amresco进口分装; 青霉素、链霉素购自华北制药有限公司. YJ-875型医用净化工作台, 苏州净化设备公司; 细胞培养瓶(Corning公司); 细胞培养板(Braun公司); 细胞计数板; 微孔滤膜(0.45 µm、0.2 µm), 上海半岛实业有限公司; Leica荧光生物显微镜; 倒置显微镜(Olympus, BX60); -86℃超低温冰箱(美国Revco); 美国SHELDON2300-2E型电热恒温二氧化碳培养箱; 美国宝特ELX800型全自动酶标仪.
1.2.1 药物处理: 实验前配制备用原液: 川芎嗪20 mmol/L(2.724 g/L). 将药液先60℃水浴2 h以增加药效, 然后置80℃水浴30 min, 连续3 d以间歇灭菌处理, 继用离心机以1000 r/min速度离心10 min, 并用0.45和0.22 μm双层微孔滤膜过滤除菌处理, -20℃保存备用. 临用时配成能维持细胞基本生活需要的含20 g/L胎牛血清的高糖DMEM培养液并倍比稀释为十种所需浓度.
1.2.2 细胞生长动态观察: 取第3代单细胞悬液, 常规细胞计数, 以保持细胞良好生长状态的含50 g/L胎牛血清的高糖DMEM培养液稀释成所需浓度. 按细胞浓度0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0×108(个/L)、0.1 mL/孔分别接种于96孔板. 置培养箱培养, 每24 h观察细胞形态及其生长状况, 以MTT法用酶标仪测定490 nm波长处细胞吸光度值(A值)并取均数, 实验另设培养液空白对照组和细胞对照组各四孔. 根据每天所测A值均数与对照组A值的比值, 绘制细胞生长曲线.
1.2.3 细胞增殖活性的检测: 不同浓度及生长时间细胞A值的测定按噻唑蓝比色法(MTT法)检测[3]. 轻轻吸取培养孔中的培养液并弃去, 向培养孔中加入400 mg/L的MTT液0.1 mL/孔, 置于37℃、50 mL/L CO2培养箱内孵育, 4 h后即可见有黄黑色甲瓒(Formazan)颗粒, 轻轻吸去MTT液但不接触细胞层, 继则加入100% DMSO 0.1 mL/孔, 37℃、50 mL/L CO2培养箱内密闭孵育待甲瓒颗粒完全溶解(约10 min)呈蓝紫色, 轻轻摇匀或在微型振荡器震荡5 min后, 用全自动酶标仪在490 nm波长处作比色法测定各孔A值, 空白对照孔中加入100% DMSO 0.1 mL/孔, 测得的各复孔A值取平均数.
1.2.4 细胞复苏与冻存: 采用常规方法操作.
1.2.5 细胞培养与传代: 参考文献方法[4-5]和本实验室经验, 高糖DMEM培养液培养, 临用时添加胎牛血清至终浓度为100 mL/L, 谷氨酰胺终浓度为0.03%, 青霉素、链霉素为各100 IU/mL, 用0.238% Hepes调pH值至6.8. 常规细胞复苏后接种于培养瓶, 待细胞生长至铺满瓶底60%面积时, 用2.5 g/L胰蛋白酶和0.02% EDTA消化30 s-1 min左右, 静置约30 s-1 min左右, 加入培养液16 mL, 轻轻吹打贴壁细胞, 将制成的单个细胞悬液按每瓶8 mL分别接种于两个培养瓶, 置37℃、饱和湿度、50 mL/L CO2培养箱内培养, 传代后的细胞在6-8 h便可贴壁生长, 24 h后更换1次培养液.
1.2.6 实验方案和技术路线: 根据实验的基本要求, 设立实验及对照组. 具体可将培养的HSC-T6分为三组, 每组可分为若干药物浓度小组, 各小组按需由多个复孔组成. 正常细胞组: 实验前后和检测指标时没有施加因素. 对照细胞组: 培养基中加正常含血清培养液, 检测指标时作阳性对照组. 药物作用组: 培养基中加含药物培养液.
1.2.7 药物对HSC-T6细胞增殖的影响: 将复苏后处于对数生长期的HSC-T6细胞, 用2.5 g/L胰蛋白酶将HSC-T6细胞分散成单个细胞悬液, 以含50 g/L胎牛血清的高糖DMEM培养液混匀稀释成浓度为2.0×108个/L, 并以0.1 mL/孔接种于96孔板中, 置于37℃、饱和湿度、50 mL/L CO2培养箱内培养, 24 h后将川芎嗪的各种不同稀释浓度的药物按0.1 mL/孔加入培养孔, 各个浓度均设3个复孔.
实验开始后, 每24 h观察细胞形态及其生长状况, 实验第4天轻轻吸去各药物各浓度下3孔培养细胞的上清液, 所余细胞以MTT法用酶标仪测定A值(490 nm)并取均数. 实验另设培养液空白对照组和细胞对照组, 分别设4个和2个复孔. 按文献方法[6], 根据所测的药物组和对照组细胞的吸光度值的比值计算出药物对细胞增殖的抑制率, 探索药物对细胞生长规律的影响. 公式如下: IE = 1-Ai/A0. IE表示药物对细胞增殖率的抑制率, Ai表示某药物浓度下的吸光度值, A0表示对照组细胞的吸光度值.
统计学处理 各组数值与对照细胞比较采用单样本t检验, SPSS10.0统计学软件处理.
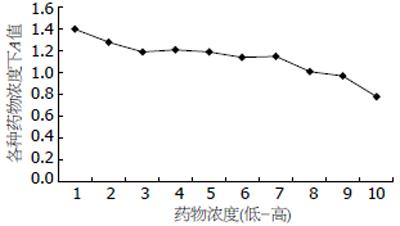
川芎嗪具有较明显的抑制HSC-T6增殖的作用, 与对照组比较差异显著(P<0.05). 随着药物浓度的增大, 其对HSC-T6增殖的抑制作用逐渐增强, 有一定的量效关系, 药物的高浓度与低浓度对细胞增殖抑制作用有差别. 结合显微镜下的观察结果可以看出, 川芎嗪对细胞增殖的抑制作用较为稳定, 且对细胞生长的负面影响或破坏程度较低(表1, 图1).
| 川芎嗪稀释度 | 对照细胞 | ||||||||||
| 1/1 | 1/2 | 1/4 | 1/8 | 1/16 | 1/32 | 1/64 | 1/128 | 1/256 | 1/512 | ||
| A | 0.782 | 0.969 | 1.006 | 1.153 | 1.138 | 1.194 | 1.214 | 1.186 | 1.28 | 1.397 | 1.317 |
| IE(%) | 42.5 | 28.8 | 26.0 | 15.2 | 16.3 | 12.2 | 10.7 | 12.8 | 5.9 | -2.7 | - |
1/1-1/2川芎嗪浓度时, 可见轻度细胞破坏. 细胞生长缓慢, 有细胞皱缩现象, 胞质可有减少, 胞核、胞质颜色有所加深, 透亮度下降, 可见少量细丝状突起, 细胞形态欠佳, 多数聚集成岛状, 亦有散在细胞贴壁生长. 培养液基本清澈, 无脱落细胞和漂浮物. 1/4浓度时细胞破坏±, 较上两组细胞损伤较轻, 少部分细胞形态略差, 可见颜色加深、胞质减少和胞核缩小. 大多数细胞生长较好, 数量较多, 形态基本正常, 细胞连接成片状, 密度较正常略低, 可见星状突起或丝状突出互相连接. 1/8-1/512浓度时无细胞破坏, 细胞生长致密, 形态正常.
肝纤维化是肝脏对各种慢性损伤的一种修复应答反应, 其病理中心环节之一是HSC由静止状态转变为活化状态, 成为肝纤维化形成的主要细胞学基础. HSC又称Ito细胞, 贮脂细胞, 位于Disse间隙, 正常状态下, HSC主要贮存和代谢维生素A脂滴, 肝受损时, HSC在多种因素下被激活, 转化为肌成纤维细胞(myofibroblast, MFB)表达多种细胞因子和受体, 进一步增殖, 合成并分泌大量ECM, 并表达α-平滑肌肌动蛋白(alpha smooth muscle actin, α-SMA), 具有收缩功能[7]. HSC的活化具体表现在: 细胞体积增大, 伸出星状伪足, 含维生素A的脂肪滴明显减少, 细胞表型向成纤维母细胞和肌成纤维样细胞(myofibroblast-like cell)转化; 细胞获得增殖能力; 纤维化能力增强, 能生成大量细胞外基质; 表达平滑肌细胞骨架蛋白等. HSC活化与增殖是密切相关的过程, 活化的HSC不仅具备了活跃的分裂增殖能力, 而且可激活其他静止状态的HSC转变为活化状态的HSC, 最终转化为肌成纤维样细胞. HSC活化是肝纤维化过程中的重要病理过程, 而HSC增殖又是HSC活化的重要特征之一, 抑制HSC增殖即可显著影响HSC的活化过程, 即是其抗肝纤维化的作用机制和作用途径之一.
我们已经证实, 药物的主要有效成分对HSC-T6细胞分泌uPA和PAI-1有明显的影响和调节作用, 由于HSC的活跃增殖能力与肝纤维化的发生、发展密切相关, 同时也与uPA和PAI-1的分泌密切相关. 因此, 通过川芎嗪对HSC-T6细胞增殖抑制作用的研究, 有利于揭示川芎影响或调节HSC-T6细胞分泌uPA和PAI-1的机制, 有助于揭示活血化瘀药对HSC增殖的抑制作用与其抗肝纤维化作用的真正关系.
药物对细胞增殖的抑制理论上就意味着对细胞的损伤, 只是程度轻重、可逆与否的问题, 与药物浓度呈明显相关并有明显的量效关系, 从理论上分析是基本一致并有一定根据的. 川芎嗪对HSC-T6细胞也有一定的损伤, 并且对HSC-T6细胞增殖的抑制作用与其破坏和损伤作用似乎显示有一定的相关关系. 判断药物对细胞增殖的抑制作用的同时, 须考虑药物对细胞活性、功能和结构的影响、损伤甚至破坏作用. 从实验结果和示图来看, 川芎嗪对HSC-T6细胞有明显的抑制作用且抑制作用比较稳定, 较高浓度和中低浓度对细胞均无明显的损伤和影响.
川芎的有效成分对HSC-T6细胞增殖有明显的抑制作用, 可以促进HSC-T6细胞分泌uPA或(和)抑制PAI-1的分泌继而促进细胞外基质的降解而逆转肝纤维化, 因此在一定程度内可以提示, 这种药物对HSC-T6细胞增殖的抑制作用与对HSC-T6细胞分泌系统的调节存在可能的相关性. 但由于细胞的分泌机制是十分复杂的过程, 细胞内环境失衡、外环境改变及多种致变因素都能够改变或影响细胞的分泌过程, 而目前还没有根据证明该药物对HSC-T6细胞增殖的抑制是影响HSC-T6细胞分泌的直接因素, 所以有待于进一步的研究中探讨其相关机制.
川芎嗪对HSC-T6细胞均有明显抑制HSC- T6增殖的作用, 且有明显的浓度依赖. 川芎的抗肝纤维化作用可能与其对HSC细胞增殖的抑制作用有关.
感谢上海中医药大学肝病研究所徐列明教授对本课题的支持.
肝星状细胞(HSC)活化并合成大量的细胞外基质(ECM)在肝内沉积是肝纤维化形成、发展的核心环节. 目前抗纤维化治疗的主要靶点集中在活化的HSC及其相关细胞因子方面, 抑制HSC增殖对于控制肝纤维化有重要意义. 川芎是肝纤维化治疗的常用药, 川芎嗪则可能是其发挥作用的主要药物成分.
石统东, 副教授, 重庆医科大学附属第二医院感染病科
在抗纤维化的实验研究中如何控制中心细胞环节、减少细胞外基质的沉积及相关机制仍是学者们探讨和研究的重点.
肝星状细胞的活化是肝纤维化的中心细胞环节, 近年研究发现血管紧张素Ⅱ、过氧化物酶体增殖物激活受体γ等对HSC增殖均有一定抑制, 从而对控制纤维化起到重要作用, 这为相关中医药的研究开启思路.
本实验通过川芎嗪作用于体外培养的星状细胞并观察其对细胞增殖的影响, 探讨川芎嗪抗纤维化作用的机制.
本研究结果可信, 论据充分, 讨论科学, 具有一定的科学指导意义.
编辑: 李军亮 电编:何基才
| 3. | Sargent JM, Taylor CG. Appraisal of the MTT assay as a rapid test of chemosensitivity in acute myeloid leukaemia. Br J Cancer. 1989;60:206-210. [PubMed] [DOI] |
| 6. | 程 宝鸾. 动物细胞培养技术. 第1版. 广州: 华南理工大学出版社 2001; 131-132. |
| 7. | Lee KS, Lee SJ, Park HJ, Chung JP, Han KH, Chon CY, Lee SI, Moon YM. Oxidative stress effect on the activation of hepatic stellate cells. Yonsei Med J. 2001;42:1-8. [PubMed] [DOI] |