修回日期: 2009-02-06
接受日期: 2009-02-16
在线出版日期: 2009-03-08
目的: 探讨奥曲肽(OCT)对胃癌细胞SGC-7901中Fas, FasL, P53, P21, P27和c-Myc表达的影响.
方法: 流式细胞术和RT-PCR法分别用于检测经OCT(1×10-7 mol/L)处理前后胃癌细胞SGC-7901中Fas, FasL, P53, P21, P27, c-Myc阳性癌百分率、mRNA表达和蛋白表达及细胞周期G0/G1、S、G2/M的变化.
结果: 胃癌细胞SGC-7901经OCT诱导6、12、24和48 h后, Fas和FasL mRNA表达均明显增加, P53 mRNA表达则显著减少, 而P21, P27和c-Myc mRNA表达均无明显变化; 胃癌细胞SGC-7901经OCT诱导12 h后, Fas和FasL蛋白相对表达强度也显著增加, P53蛋白相对表达强度则明显降低(5.5±0.3 vs 3.2±0.1, 5.1±0.3 vs 4.5±0.1, 3.3±0.2 vs 4.9±0.3, P<0.05或0.01), 而P21, P27和c-Myc蛋白相对表达强度均无明显改变. 细胞周期G0/G1、S、G2/M在OCT处理前后的变化并不明显.
结论: OCT能上调SGC-7901胃癌细胞中Fas和FasL表达, 下调突变型p53表达, 是其诱导凋亡作用的重要机制之一.
引文著录: 唐卓斌, 杜楠, 房殿春. 奥曲肽对SGC-7901胃癌细胞中Fas, FasL及P53表达的影响. 世界华人消化杂志 2009; 17(7): 694-698
Revised: February 6, 2009
Accepted: February 16, 2009
Published online: March 8, 2009
AIM: To investigate whether OCT affects the expression of Fas, FasL, P53, P21, P27 and c-Myc in SGC-7901 HGC cells.
METHODS: Expression percentage of Fas, FasL, P53, P21, P27, c-Myc-positive cells and G0/G1, S, G2/M stage were detected by using flow cytometry (FCM) with or without OCT treatment. Reverse transcription-polymerase chain reaction (RT-PCR) and FCM in SGC-7901 HGC cells were applied to evaluate the mRNA and protein expression levels of Fas, FasL, P53, P21, P27 and c-Myc in SGC-7901 HGC cells treated with and without OCT.
RESULTS: After treatment with 1 × 10-7 mol/L OCT for 6, 12, 24, 48 h, although P53 mRNA expression was significantly decreased, Fas and FasL mRNA expression were both significantly increased in SGC-7901 HGC cells. However, P21, P27 and c-Myc mRNA expression did not significantly change in SGC-7901 HGC cells with or without OCT treatment. The relative intensity of Fas and FasL protein expression were also enhanced, but the relative intensity of P53 protein expression was decreased in SGC-7901 HGC cells (5.5 ± 0.3 vs 3.2 ± 0.1, 5.1 ± 0.3 vs 4.5 ± 0.1, 3.3 ± 0.2 vs 4.9 ± 0.3, P < 0.05 or 0.01). The relative intensity of P21, P27 and c-myc protein expression did not change. However, G0/G1, S, G2/M stage did not significantly change in SGC-7901 HGC cells with or without OCT treatment.
CONCLUSION: Our data suggest that OCT leading to apoptosis is associated with down-regulation of mutant-type P53 and up-regulation of Fas and FasL in SGC-7901 HGC cells.
- Citation: Tang ZB, Du N, Fang DC. Effects of octreotide on expression of Fas, FasL and P53 in human gastric cancer SGC-7901 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(7): 694-698
- URL: https://www.wjgnet.com/1009-3079/full/v17/i7/694.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i7.694
奥曲肽(octreotide, OCT)是近年人工合成的一种长效八肽生长抑素类似物, 其分子结构为一环形肽, 具有活性的四个氨基酸排列顺序与SS相同, OTC的生物学活性明显强于SS, 且作用时间更加持久. 目前OTC主要应用于消化系疾病和多种内分泌肿瘤的治疗. 临床和基础大量研究均表明, OTC不仅能抑制多种内分泌激素分泌, 而且具有抑制肿瘤增殖的功能, 他对肿瘤细胞的抑制作用正受到越来越多的重视[1-6]. 我们以前的研究发现OTC可抑制人胃癌细胞株SGC-7901的生长并可诱导其凋亡[7], 但其抗凋亡机制目前仍不清楚. 为此, 我们就OTC对胃癌细胞SGC-7901中Fas, FasL, p53, p21, p27和c-myc基因的调控作用进行了研究.
OTC由瑞士Sandoz药厂惠赠, 人胃癌细胞株SGC-7901为中国人民解放军第三军医大学西南医院全军消化内科中心冻存细胞. 37℃水浴快速复苏后, 加入5 mL含100 mL/L小牛血清, 100 U/mL链霉素和青霉素的RPMI 1640培养液中, 置37℃、50 mL/L CO2的环境中培养. 总RNA提取试剂盒(TripureTM Isolation Reagent)为德国Boehringer Mannheim(B.M)公司产品, RT-PCR检测试剂盒(Access RT-PCR system, A1250)为美国Promega公司产品, DNA Marker为上海华美公司产品. Fas引物序列: F: 5'-GACCCAGAATACCAAGTGCAGATGTA-3' R: 5'-CTGTTTCAGGATTTAAGGTTGGAGATT-3', 产物长度296 bp. FasL引物序列: F: 5'-CTGGGGATGTTTCAGCTCTTC-3', R: 5'-CTTCACTCCAGAAAGCAGGAC-3' 产物长度304 bp. p53引物序列: F: 5'-TTGGATCCATGTTTTGCCAACTGGCC-3', R: 5'-TTGAATTCAGGCTCCCCT TTCTTGCG-3', 产物长度489 bp. p21引物序列: F: 5'-CTCAGAGGAGGCGCCATG-3', R: 5'-GGG CGGATTAGGGCTTCC-3', 产物长度517 bp. p27引物序列: F: 5'-AGGATGTCAGCGGGAGCCGG-3', R: 5'-CTTCTTGGGCGTCTGCTCCA-3', 产物长度250 bp. c-myc引物序列: F: 5'-CCAGGACTGTATGTGGAGCG-3', R: 5'-CCTGAGGACCAGTGGGCTGT-3', 产物长度505 bp. 看家基因GAPDH引物序列: F: 5'-CCACCCATGGCAAATTCCATGGCA-3', R: 5'-TCTAGACGGCAGGTCAGGTCCAC-3', 产物长度598 bp. 所有引物均由上海Sangon公司合成, PAGE纯化.
1.2.1 反转录聚合酶链反应(RT-PCR): 选择对数生长期SGC-7901细胞, 以4.5×108个/L浓度接种于6孔培养板中, 每孔1.5 mL, 待其生长至对数生长期, 每孔加入终浓度为1×10-7 mol/L的OTC, 继续无血清培养6、12、24、48 h. 设未经OTC(1×10-7 mol/L)处理的胃癌细胞为空白对照. RNA 提取采用Tripure提取液(宝灵曼公司), 按宝灵曼RNA提取试剂盒说明书操作. RT-PCR采用一步一管法, 反应体系为: 总体积25 µL, 5×Buffer 5 µL、MgSO4 1 µL、dNTP 0.5 µL、Primer mix 1.5 µL、AMV 0.5 µL、Tf1 0.5 µL、模板RNA 1 µL, 加灭菌水至终体积25 µL. 2400型PCR仪(美国Perkin-Elmer公司产品)扩增反应参数为: 首先将RNA反转录成cDNA, 于94℃变性2 min后, 开始PCR的热循环: 94℃变性30 s, 60℃退火40 s, 68℃延伸1 min, 共35个循环; 最后68℃延伸7 min. 用GAPDH作为外参照物. PCR产物在15 g/L琼脂糖凝胶上电泳. 电泳结果经Gel Doc 100型成像仪(美国Bio-Rad公司产品)输入电脑, 应用四星SX-100图象分析软件(上海四星生物技术实业有限公司产品), 对条带进行吸光度峰值下面积积分, 各个目的基因与其相应的GAPDH积分之比, 即为该目的基因mRNA相对水平.
1.2.2 流式细胞术分析: 消化收集经OTC(1×10-7 mol/L)作用12 h后的SGC-7901细胞, PBS清洗两次, 加入1∶100稀释的一抗100 µL, 在37℃恒温水浴中温育30 min, PBS洗2次, 然后加入1∶20稀释的FITC标记的二抗100 µL, 37℃水浴30 min, PBS洗2次, 离心去上清, 除去未结合的多余荧光抗体. 加入1.0 mL PBS, 经200目滤网过滤, 上机检测. 测量数据及图形输入计算机, 应用相应程序软件进行资料处理, 测定前以鸡血红细胞标准样品调整仪器的CV值在5%以内. 设未经OTC(1×10-7 mol/L)处理的胃癌细胞为空白对照.
1.2.3 流式细胞仪检测胃癌细胞凋亡: 消化收集经OTC(1×10-7 mol/L)诱导6、12、24 h后的胃癌细胞, 细胞用PBS清洗两次, 加入700 mL/L冷乙醇固定24 h以上(4℃). 随后清洗细胞, 与含1 g/L RNA酶的PBS缓冲液(pH7.4)200 µL(含4% Triton X-100)共同孵育(37℃)30 min. 然后用碘丙锭(PI)400 µL作细胞DNA染色, 暗处15 min或4℃过夜. 200目尼龙膜过滤. 应用流式细胞仪FACS 420(美国BD公司)检测, 观察是否存在凋亡细胞并测定其含量, 设未经OTC(1×10-7 mol/L)处理的胃癌细胞为空白对照. 所有资料均经IysisⅡ软件收集, 储存和分析.
统计学处理 实验数据以mean±SD表示, 组间比较行t检验.
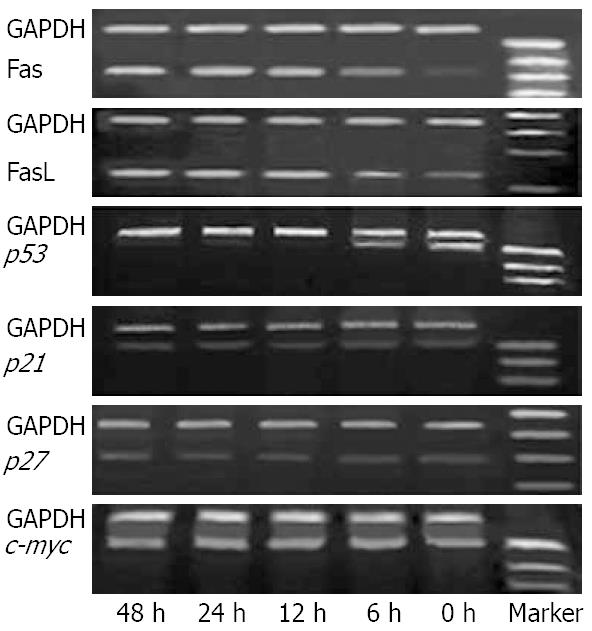
经RT-PCR检测, 在胃癌细胞SGC-7901中均发现有Fas, FasL, p53, p21, p27和c-myc产物的出现. 胃癌细胞SGC-7901经OCT诱导6、12、24和48 h后, Fas和FasL mRNA表达均明显增加, p53 mRNA表达则显著减少, 而p21, p27和c-myc mRNA表达均无明显变化(图1).
胃癌细胞SGC-7901经OCT诱导12 h后, Fas和FasL蛋白阳性细胞比例明显增加, P53蛋白阳性细胞比例则显著降低, 与OCT处理前相比均有显著性差异(P<0.05, P<0.01, 表1), 但P21, P27和c-Myc蛋白阳性细胞比例在OCT处理前后的变化并不明显, 未显示显著性差异(P>0.05, 表2).
| OCT | P21 | P27 | c-Myc | |||
| (mol/L) | 阳性率 | 相对强度 | 阳性率 | 相对强度 | 阳性率 | 相对强度 |
| 0 | 65.4±6.5 | 4.7±0.1 | 60.7±2.6 | 5.4±0.3 | 72.6±8.5 | 4.2±0.4 |
| 1×10-7 | 68.2±5.7 | 5.1±0.2 | 63.8±3.1 | 4.9±0.1 | 70.1±7.4 | 3.8±0.2 |
诱导细胞凋亡可能是OCT杀伤肿瘤细胞的途径之一, 但其具体机制尚不清楚. 为此, 我们就OTC对胃癌细胞SGC-7901中凋亡及细胞周期相关基因的调控作用进行了研究. Fas/FasL信号传导途径是一个独特的凋亡途径. 目前认为FasL是死亡因子, 而Fas抗原是他的受体, Fas与FasL的结合抗Fas抗体交联Fas, 可诱导表达Fas的靶细胞凋亡[8-9]. 人类某些肿瘤细胞常常异常高表达Fas抗原, 但对于不表达或低表达Fas抗原的肿瘤细胞也可以通过某些细胞因子[10], 诱导其表达或增量表达. 有研究表明胃癌细胞上Fas受体表达的量低于正常的胃组织, 胃癌细胞从基因水平下调Fas分子的表达[11], 从而逃避机体Fas/FasL系统的监控, 细胞凋亡受抑制, 使得胃癌细胞不断增殖. 如果使肿瘤细胞的Fas表达上调, 可恢复肿瘤细胞对Fas/FasL介导的凋亡的敏感性. 本实验的结果显示OCT不仅可使SGC-7901细胞中的Fas mRNA和蛋白表达增加, 而且还可使FasL mRNA和蛋白表达显著增加. 结果提示OCT可通过上调Fas和FasL基因的mRNA和蛋白表达, 以诱导SGC-7901细胞凋亡.
目前认为, 在诱导凋亡过程中, p53和c-myc有协同作用[12]. 在许多肿瘤中, c-myc的高表达和p53功能缺失同存[13]. 张青云 et al发现胃癌细胞SGC-7901第6外显子204位密码子由GAG-GCG, 使编码的Glu变成Ala. 即SGC-7901的第6个外显子发生了点突变及缺失, 因而可使其表达的P53蛋白结构发生变化, 野生型p53丧失了功能[14]. 有研究表明突变型p53不但失去了抑癌功能, 而且还能促进细胞异常生长, 并能阻止细胞凋亡[13,15-17]. 我们发现胃癌细胞SGC-7901经OCT处理后, 突变型p53表达明显减少, 而c-myc表达无明显变化. 本实验结果提示在胃癌细胞SGC-7901中, 失去了p53和c-myc在诱导凋亡过程中的协同作用, OCT可通过下调突变型p53表达, 抑制胃癌细胞SGC-7901生长, 促进细胞凋亡.
p53和c-myc都是半衰期很短的转录因子, 前者对细胞周期负调控, 使细胞阻滞于G期, 而后者则正调控, 可取消p53诱导的G1期阻滞, 从而促进细胞进入增殖周期, 两者的作用是对立的[18]. p27能抑制cyclinD1/CDK4功能, 从而阻滞G1期[15]. 含野生型p53的细胞, 在DNA受到损伤时, 此信号传递给P53, 表现为P53蛋白的升高. P53蛋白启动p21的转录, 又使P21蛋白迅速升高. p21是细胞周期内通用性抑制物, 通过抑制CDK的激活, 导致G1期阻滞, 使细胞赢得时间, 在进入S期之前修复损伤的DNA[19-20]. 当p53突变时, 其促进p21转录的功能丧失, 从而使细胞不能阻滞于G1期以修复损伤的DNA. 有报告OCT不引起癌细胞G1期阻滞, 与OCT不能诱导p2l、pRb、c-myc有关[21-22]. 这与我们的研究结果-致.
总之, OCT可通过上调Fas和FasL表达, 下调突变型p53表达, 诱导SGC-7901细胞凋亡, 抑制细胞生长. OCT诱导SGC-7901细胞凋亡并不需要G1期阻滞, 这与OCT不能诱导p2l、pRb、c-myc有关. 这可能是OCT诱导细胞凋亡和抑制细胞生长的重要机制之一, 为OTC应用到临床治疗胃癌提供了新的思路和实验依据.
奥曲肽(OCT)是近年人工合成的一种长效八肽生长抑素类似物, 其分子结构为一环形肽, 具有活性的四个氨基酸排列顺序与SS相同, OTC的生物学活性明显强于SS, 且作用时间更加持久. 目前OTC主要应用于消化系疾病和多种内分泌肿瘤的治疗. 临床和基础大量研究均表明, OTC不仅能抑制多种内分泌激素分泌, 而且具有抑制肿瘤增殖的功能, 他对肿瘤细胞的抑制作用正受到越来越多的重视.
关玉盘, 教授, 首都医科大学附属北京朝阳医院消化科; 葛海燕, 教授, 同济大学附属第十人民医院普通外科
诱导细胞凋亡可能是OCT杀伤肿瘤细胞的途径之一, 但其具体机制尚不清楚.
张青云 et al发现胃癌细胞SGC-7901第6外显子204位密码子由GAG-GCG, 使编码的Glu变成Ala. 即SGC-7901的第6个外显子发生了点突变及缺失, 因而可使其表达的P53蛋白结构发生变化, 野生型P53丧失了功能.
本研究方法较成熟, 语言流畅, 但是该论文只是研究了胃癌细胞株SGC-7901的变化, 如果能检测临床上胃癌患者的相关变化, 则更加有说服力.
编辑: 李军亮 电编:何基才
| 1. | Lamberts SW, van der Lely AJ, de Herder WW, Hofland LJ. Octreotide. N Engl J Med. 1996;334:246-254. [PubMed] [DOI] |
| 2. | Kath R, Höffken K. The significance of somatostatin analogues in the antiproliferative treatment of carcinomas. Recent Results. Cancer Res. 2000;153:23-43. [PubMed] |
| 3. | Zou Y, Xiao X, Li Y, Zhou T. Somatostatin analogues inhibit cancer cell proliferation in an SSTR2-dependent manner via both cytostatic and cytotoxic pathways. Oncol Rep. 2009;21:379-386. [PubMed] |
| 4. | Ferrante E, Pellegrini C, Bondioni S, Peverelli E, Locatelli M, Gelmini P, Luciani P, Peri A, Mantovani G, Bosari S. Octreotide promotes apoptosis in human somatotroph tumor cells by activating somatostatin receptor type 2. Endocr Relat Cancer. 2006;13:955-962. [PubMed] [DOI] |
| 5. | Wang JH, Xing QT, Yuan MB. Antineoplastic effects of octreotide on human gallbladder cancer cells in vitro. World J Gastroenterol. 2004;10:1043-1046. [PubMed] |
| 8. | Akagi T, Yoshino T, Kondo E. The Fas antigen and Fas-mediated apoptosis in B-cell differentiation. Leuk Lymphoma. 1998;28:483-489. [PubMed] |
| 9. | Takahashi T, Tanaka M, Inazawa J, Abe T, Suda T, Nagata S. Human Fas ligand: gene structure, chromosomal location and species specificity. Int Immunol. 1994;6:1567-1574. [PubMed] [DOI] |
| 10. | Owen-Schaub LB, Radinsky R, Kruzel E, Berry K, Yonehara S. Anti-Fas on nonhematopoietic tumors: levels of Fas/APO-1 and bcl-2 are not predictive of biological responsiveness. Cancer Res. 1994;54:1580-1586. [PubMed] |
| 11. | Li Z, Wang Z, Zhao Z, Zhang Y, Ke Y. [Expression of Fas, FasL and IFN-gamma in gastric cancer]. Beijing Daxue Xuebao. 2003;35:386-389. [PubMed] |
| 12. | Bello-Fernandez C, Packham G, Cleveland JL. The ornithine decarboxylase gene is a transcriptional target of c-Myc. Proc Natl Acad Sci U S A. 1993;90:7804-7808. [PubMed] [DOI] |
| 13. | Hermeking H, Eick D. Mediation of c-Myc-induced apoptosis by p53. Science. 1994;265:2091-2093. [PubMed] [DOI] |
| 14. | 张 青云, 吕 有勇, 李 净, 李 文梅, 崔 建涛, 谢 山海, 邓 国仁. 人胃癌细胞系中p53抑癌基因变异的检测及其序列分析. 中国生物化学与分子生物学报. 1995;11:311-315. |
| 15. | Culotta E, Koshland DE Jr. p53 sweeps through cancer research. Science. 1993;262:1958-1961. [PubMed] [DOI] |
| 16. | Clarke AR, Purdie CA, Harrison DJ, Morris RG, Bird CC, Hooper ML, Wyllie AH. Thymocyte apoptosis induced by p53-dependent and independent pathways. Nature. 1993;362:849-852. [PubMed] [DOI] |
| 17. | Lowe SW, Schmitt EM, Smith SW, Osborne BA, Jacks T. p53 is required for radiation-induced apoptosis in mouse thymocytes. Nature. 1993;362:847-849. [PubMed] [DOI] |
| 18. | Hoshino R, Tanimura S, Watanabe K, Kataoka T, Kohno M. Blockade of the extracellular signal-regulated kinase pathway induces marked G1 cell cycle arrest and apoptosis in tumor cells in which the pathway is constitutively activated: up-regulation of p27(Kip1). J Biol Chem. 2001;276:2686-2692. [PubMed] [DOI] |
| 19. | Bourdon JC, Deguin-Chambon V, Lelong JC, Dessen P, May P, Debuire B, May E. Further characterisation of the p53 responsive element--identification of new candidate genes for trans-activation by p53. Oncogene. 1997;14:85-94. [PubMed] [DOI] |
| 20. | Sheikh MS, Chen YQ, Smith ML, Fornace AJ Jr. Role of p21Waf1/Cip1/Sdi1 in cell death and DNA repair as studied using a tetracycline-inducible system in p53-deficient cells. Oncogene. 1997;14:1875-1882. [PubMed] [DOI] |
| 21. | Sharma K, Patel YC, Srikant CB. Subtype-selective induction of wild-type p53 and apoptosis, but not cell cycle arrest, by human somatostatin receptor 3. Mol Endocrinol. 1996;10:1688-1696. [PubMed] [DOI] |
| 22. | Sharma K, Srikant CB. Induction of wild-type p53, Bax, and acidic endonuclease during somatostatin-signaled apoptosis in MCF-7 human breast cancer cells. Int J Cancer. 1998;76:259-266. [PubMed] [DOI] |