修回日期: 2009-01-12
接受日期: 2009-01-19
在线出版日期: 2009-03-08
目的: 观察内毒素耐受状态下Kupffer细胞中白介素-1受体相关激酶-M(IRAK-M)的表达并探讨其在Kupffer细胞内毒素耐受形成中的作用.
方法: 通过脂多糖(LPS, 10 μg/L)预处理建立内毒素耐受Kupffer细胞模型, 并与对照组细胞进行比较; 在LPS(100 μg/L)刺激后不同时点, 用酶联免疫吸附试验(ELISA)检测细胞培养液中TNF-α水平, 逆转录聚合酶链反应(RT-PCR)检测细胞中TNF-α和IRAK-M的mRNA表达, TransAM NF-κB Kit检测细胞中NF-κB活性, 蛋白印迹法(Western blot)检测细胞中IRAK-M蛋白表达.
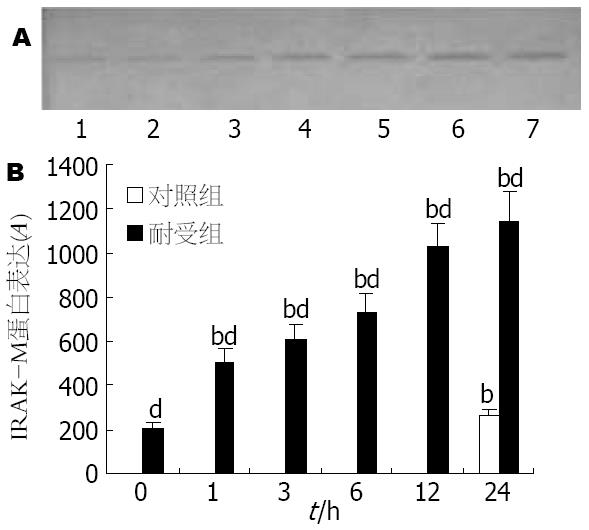
结果: LPS刺激在两组细胞中均引起TNF-α释放增加, TNF-α mRNA表达以及NF-κB活性增强, 但耐受组细胞的三种指标明显低于对照组(P<0.05); 对照组细胞在LPS刺激24 h后才能检测出IRAK-M mRNA的表达, 而耐受组细胞在LPS刺激前已可检测到IRAK-M的基因表达, 且该表达在LPS刺激后迅速增强, 于6 h达高峰, 24 h时仍明显高于对照组(P<0.05); 对照组细胞在LPS刺激24 h后才有微弱的IRAK-M蛋白表达, 而耐受组细胞在LPS刺激前已有IRAK-M的蛋白表达, 并随LPS刺激进一步上调, 两组有显著差异(P<0.01).
结论: 内毒素耐受状态下, Kupffer细胞中的IRAK-M表达明显增强, IRAK-M可能在Kupffer细胞内毒素耐受形成中起重要作用.
引文著录: 李旭宏, 陈先锋, 游海波, 刘海忠, 刘作金, 龚建平. IRAK-M在内毒素诱导Kupffer细胞耐受中的表达及其意义. 世界华人消化杂志 2009; 17(7): 652-656
Revised: January 12, 2009
Accepted: January 19, 2009
Published online: March 8, 2009
AIM: To observe the expression of IRAK-M in endotoxin-tolerant Kupffer cells and to explore its role in endotoxin tolerance of Kupffer cells.
METHODS: The model of endotoxin-tolerant Kupffer cells was established by lipopolysaccharide (LPS, 10 μg/L) pretreatment, and was compared with control cells. At different time points after LPS (100 μg/L) stimulation, the TNF-α level in culture medium was measured by ELISA. The mRNA expression of TNF-α and IRAK-M in Kupffer cells was detected by RT-PCR. TransAM NF-κB Kit was used to examine the activation of NF-κB. The expression of IRAK-M protein in Kupffer cells was detected by Western blot.
RESULTS: In both groups, LPS stimulation increased TNF-α level in culture medium, and enhanced TNF-α mRNA expression and NF-κB activation in Kupffer cells, but these parameters were significantly lower in tolerant group than in control group (P < 0.05). In control group, the expression of IRAK-M mRNA could not be detected until 24 h after LPS stimulation. However, this expression was slight in tolerant group before LPS stimulation and was rapidly up-regulated after stimulation, peaking at 6 h and was still stronger than the expression in control group at 24 h (P < 0.05). In addition, there was no IRAK-M protein expression in control group until 24 h after LPS stimulation, but this expression could be detected in tolerant group before LPS stimulation and was up-regulated in a time-dependent manner. There was significant difference between two groups (P < 0.01).
CONCLUSION: IRAK-M expression is significantly up-regulated in endotoxin-tolerant Kupffer cells and it may play an important role in endotoxin tolerance of Kupffer cells.
- Citation: Li XH, Chen XF, You HB, Liu HZ, Liu ZJ, Gong JP. Expression of IRAK-M in endotoxin-tolerant Kupffer cells and its significance. Shijie Huaren Xiaohua Zazhi 2009; 17(7): 652-656
- URL: https://www.wjgnet.com/1009-3079/full/v17/i7/652.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i7.652
内毒素又名脂多糖(lipopolysaccharide, LPS), 为G-细菌最重要的致病物质, 他能激活单核-巨噬细胞系统(mononuclear phagacytic system, MPS), 引起TNF-α等大量炎症介质释放, 导致全身过度炎症反应及器官损害[1-3]. 内毒素耐受(endotoxin tolerance)是生物在长期进化过程中形成的一种保守的负反馈调节机制, 是一种适应性应答, 能避免机体对LPS刺激的持续过度反应. 所谓内毒素耐受是指: 机体或单核-巨噬细胞受LPS初次刺激后, 对LPS的再次刺激呈低反应性[4-5]. 最近有研究表明, 白介素1受体相关激酶-M(interleukin-1 receptor associated kinase-M, IRAK-M)对LPS信号通路起负性调节作用, 可能参与内毒素耐受的形成机制[6-7]. 业已证明, IRAK-M主要在单核-巨噬细胞中表达[6-9]. Kupffer细胞为常驻肝血窦的巨噬细胞, 占单核-巨噬细胞总量的80%-90%, 是MPS的典型代表[10-11]. 但目前尚无有关Kupffer细胞中IRAK-M表达的研究报道. 本研究通过建立内毒素耐受Kupffer细胞模型, 观察IRAK-M在Kupffer细胞中的表达, 并探讨其在Kupffer细胞内毒素耐受形成中的作用.
♂健康成年昆明小鼠, 清洁级, 体质量20-25 g, 购自重庆医科大学实验动物中心; 脂多糖(E.coli. O111:B4)及Ⅳ型胶原酶购自美国Sigma公司; DMEM培养基及特级胎牛血清购自美国Hyclone公司; 兔抗IRAK-M多克隆抗体购自美国AnaSpec公司; 小鼠TNF-α ELISA试剂盒、Western blot检测试剂盒等购自武汉博士德生物技术有限公司; RT-PCR试剂盒为TaKaRa公司产品; 核蛋白提取试剂盒Nuclear Extraction Kit及NF-κB活性检测试剂盒TransAM NF-κB Kit为美国Active Motif公司产品.
1.2.1 Kupffer细胞分离、培养和鉴定: 阻断肝上下腔静脉, 经门静脉插管灌注, 灌注液由肝下下腔静脉插管引出; 用D-Hanks液灌注洗净肝内血液后, 行肝脏原位循环灌注0.05% Ⅳ型胶原酶; 充分消化后切下肝脏用200目不锈钢滤网过滤后经50 g离心5 min去掉实质细胞; 非实质细胞在50%与25%的Percoll配成的梯度离心液上经1000 g离心15 min进一步纯化后, 于含100 mL/L胎牛血清的DMEM培养基中孵育, 6 h后洗去未贴壁细胞即得Kupffer细胞. 台盼蓝染色显示细胞成活率>95%. 乳胶颗粒吞噬试验显示枯否细胞纯度>90%.
1.2.2 细胞模型建立及分组: 将纯化后的Kupffer细胞用含100 mL/L FBS的DMEM培养基调整细胞浓度为5×108/L并接种于24孔培养板中, 每孔1 mL, 培养12 h后随机分为两组: (1)对照组, 细胞换用新鲜培养基继续培养, 24 h后再换用含LPS 100 μg/L的培养基进行培养; (2)耐受组, 细胞先在含LPS 10 μg/L的培养基中孵育, 24 h后处理同对照组. 各组在随后的相应时相点收集标本. 每时点均设有重复孔.
1.2.3 培养液中TNF-α含量: 各组分别在相应时间收集培养上清液, 于-70℃保存备用; 采用武汉博士德生物技术有限公司的小鼠TNF-α ELISA试剂盒检测, 具体方法参见试剂盒说明书.
1.2.4 Kupffer细胞中NF-κB活性: 提取各细胞样本的核蛋白并定量, 按2 μg/孔加入96孔板(孔内已包被与NF-κB结合位点相一致的脱氧寡核苷酸序列), 置100 r/min摇床室温孵育1 h; 洗涤后, 每孔加入1∶1000的NF-κB p65亚单位抗体100 μL, 室温孵育1 h; 洗涤后, 每孔加入1:1000辣根过氧化物酶标记的二抗100 μL, 室温孵育1 h; 洗涤后, 每孔加入显色液100 μL, 室温避光孵育10 min; 每孔加入终止液100 μL, 于5 min内用全自动酶标仪在450 nm波长下测出A值, 即表示NF-κB相对活性.
1.2.5 Kupffer细胞中TNF-α和IRAK-M的mRNA表达: 采用美国Life Technologies公司的TRIzol试剂盒提取Kupffer细胞总RNA; 用TaKaRa公司两步法逆转录聚合酶链反应(RT-PCR)试剂盒检测细胞中的mRNA表达; PCR引物由上海鼎安生物科技有限公司设计并合成. IRAK-M引物: 上游5'-GAA AAC GAC CCT GGA CCT CT-3', 下游5'-CAC GGC TGA GTG TTG TGC AA-3', 扩增产物大小为500 bp; TNF-α引物: 上游5'-TCT ACT GAA CTT CGG GGT GA-3', 下游5'-AGT AGA CCT GCC CGG ACT C-3', 扩增产物大小为542 bp; 内参照β-actin引物: 上游5'-CAT TGT GAT GGA CTC CGG AG-3', 下游5'-ATA GTG ATG ACC TGG CCG TC-3', 扩增产物大小为300 bp. PCR条件为: 94℃ 45 s, 55℃ 1 min, 72℃ 1 min, 30个循环, 72℃延伸5 min. 扩增产物经15 g/L琼脂糖凝胶电泳后, 采用Gel Doc 2000凝胶成像系统成像, 并作半定量分析, 结果以相对吸光度值(RA)×面积(mm2)表示. mRNA相对含量 = (目的基因条带RA×mm2)/(β-actin条带RA×mm2).
1.2.6 Western blot检测Kupffer细胞中IRAK-M蛋白表达: 提取Kupffer细胞的胞质蛋白并定量; 将蛋白经100 g/L SDS-聚丙烯酰胺凝胶电泳进行分离并电转印至硝酸纤维素(NC)膜; 将NC膜用含50 g/L脱脂奶粉的PBS-Tween液室温封闭1 h; 洗涤后, 与兔抗IRAK-M多克隆抗体溶液在37℃孵育2 h; 洗涤后, 再与辣根过氧化酶标记的羊抗兔IgG在37℃孵育1 h; 洗涤后, NC膜用二氨基联苯胺显色. 用Gel Doc 2000凝胶成像系统对目的条带成像并作半定量分析, 蛋白含量以相对吸光度值(RA)×面积(mm2)表示.
统计学处理 实验数据以mean±SD表示, 组间比较采用SPSS10.0软件进行方差分析, P<0.05表示差异有显著性.
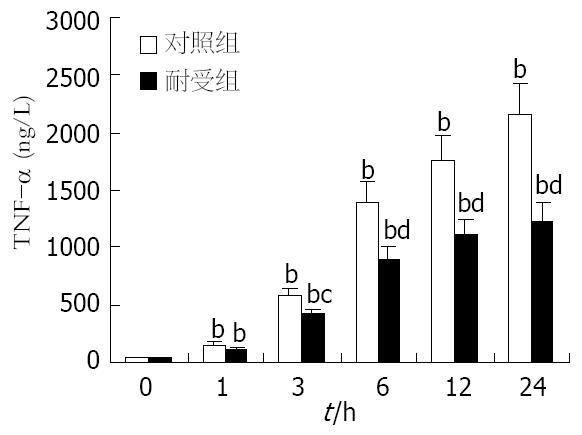
两组细胞培养液中TNF-α水平均随LPS刺激的持续呈逐渐升高趋势, 刺激后1 h与刺激前相比已有显著差异(P<0.01); 但耐受组细胞培养液中的TNF-α水平升高相对缓慢, 自LPS刺激后3 h开始显著低于对照组(P<0.05), 自6 h起差异更加显著(P<0.01, 图1).
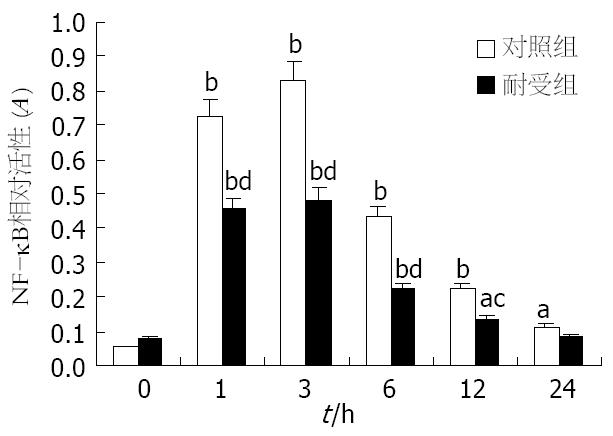
LPS刺激后, 两组细胞中的NF-κB活性迅速增强, 并于3 h达高峰, 而后逐渐下降; 但耐受组细胞的NF-κB活性在LPS刺激后明显低于对照组细胞, 两组间的显著性差异一直持续到LPS刺激后12 h(P<0.05), 而在此之前两组间的差异更为显著(P<0.01, 图2).
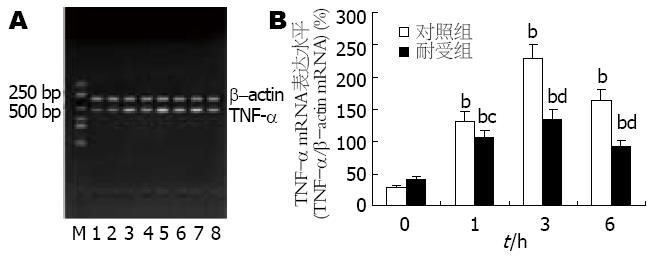
LPS刺激后, 两组细胞中的TNF-α mRNA表达均明显增强, 并于3 h达高峰; 但耐受组细胞的表达强度弱于对照组, LPS刺激后1 h两组间已有显著差异(P<0.05), 3 h及6 h时两组间的差异更加显著(P<0.01, 图3).
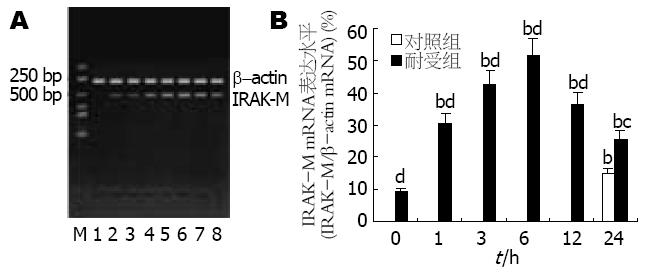
对照组细胞直到LPS刺激后24 h才能检测到IRAK-M mRNA的微弱表达. LPS刺激前, 耐受组细胞内已有微弱的IRAK-M mRNA表达; LPS刺激后, 耐受细胞中的IRAK-M mRNA表达迅速上调并于6 h达高峰, 与对照组细胞有显著差异(P<0.01), 24 h时表达虽有所减弱, 但仍强于对照组(P<0.05, 图4).
Western blot检测显示, 对照组细胞直到LPS刺激24 h后才能检测到微弱的IRAK-M蛋白表达. 耐受组细胞在LPS刺激前已有微弱的IRAK-M蛋白表达, LPS刺激后该表达迅速上调, 且随LPS刺激的时间进一步增强, 与对照组相比有显著性差异(P<0.01, 图5).
内毒素又名脂多糖(LPS), 是G-细菌细胞壁上的重要成分, 且属病原相关分子模式(pathogen associated molecular patterns, PAMPs)能为单核-巨噬细胞表面的Toll样受体4(toll like recepto 4, TLR4)所识别, 并经髄样分化因子88(myeloid differentiation factor 88, MyD88)、白介素-1受体相关激酶(Interleukin-1 receptor-associated kinase, IRAK)、TNF受体相关因子6(TNF receptor associated factor 6, TRAF6)等细胞内信号分子的参与, 引起NF-κB等转录因子的活化, 从而导致TNF-α等大量炎症介质释放, 造成机体过度炎症反应及器官损害[12-14]. 然而, 生物在长期进化过程中形成了一种针对内毒素损害的内源性保护机制, 即内毒素耐受, 能避免了机体对LPS刺激的持续过度反应. 所谓内毒素耐受是指: 机体或单核-巨噬细胞经LPS预处理后, 对LPS的再次刺激呈低反应性[4-5].
IRAK-M是IRAK家族成员之一, 主要在单核-巨噬细胞内表达, 为无活性的激酶[6-9]. 近来有研究表明, IRAK-M对LPS信号通路具有负性调节作用并可能参与内毒素耐受的形成[6-7]. Kupffer细胞是定居在肝脏中的巨噬细胞, 其数量占体内单核-巨噬细胞总数的80%-90%, 是单核-巨噬细胞系统中最大的细胞群及典型代表[10-11]. 因位于肝血窦内, Kupffer细胞能清除进入门静脉血液的肠源性细菌及其毒性产物如LPS, 故成为机体的一道重要防线. 然而, 当大量LPS随血液循环进入肝脏后, 则可引起Kupffer细胞的过度激活. 此时的Kupffer细胞作为一个巨大的"炎症介质库", 对机体过度炎症反应和器官损害的发生起重要作用[10-11,15-16]. 由于Kupffer细胞代表着单核-巨噬细胞的绝大部分功能, 因此Kupffer细胞的内毒素耐受与整个机体内毒素耐受状态密切相关. 然而, 目前尚无有关Kupffer细胞中IRAK-M表达的研究报道.
本实验中, 我们在成功分离小鼠肝脏Kupffer细胞的基础上, 采用低浓度LPS(10 μg/L)预处理的方式诱导Kupffer细胞的内毒素耐受状态. 研究发现, 经低浓度LPS预处理后的Kupffer细胞对更高浓度LPS(100 μg/L)刺激呈现出明显的低反应性, 表现为: (1)细胞对TNF-α的释放明显减少; (2)细胞中的TNF-α mRNA的表达明显减弱; (3)细胞中转录因子NF-κB的活化程度降低. 上述结果从转录因子活化、前炎症细胞因子的基因表达及释放等不同层面证实了内毒素耐受Kupffer细胞模型的成功建立. 此外, 我们发现对照组细胞在LPS刺激后24 h才开始有IRAK-M的基因转录及蛋白表达, 且程度微弱; 而耐受组细胞在LPS再度刺激前在mRNA和蛋白水平上均能检测出IRAK-M的表达, 且两种水平的表达在LPS刺激后均迅速上调, 同时伴随着NF-κB活化程度的减弱. 由于NF-κB活化是LPS激活单核-巨噬细胞的中心环节, 也是LPS信号转导的必然结果[17-18], 故本实验结果表明IRAK-M可能对Kupffer细胞的LPS信号通路起负性调节作用, 并可能通过该作用参与Kupffer细胞内毒素耐受状态的形成.
内毒素又名脂多糖, 是G-细菌最重要的致病物质, 能激活单核-巨噬细胞系统并引起大量炎症介质释放, 导致全身过度炎症反应及器官损害. 内毒素耐受是生物在长期进化过程中形成的一种保守的负反馈调节机制, 能避免机体对脂多糖刺激的持续过度反应.
陈光, 教授, 吉林大学第一医院普外科; 戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
白介素1受体相关激酶-M(IRAK-M)对脂多糖信号通路起负性调节作用, 可能参与内毒素耐受的形成机制.
文献报道, IRAK-M主要在单核-巨噬细胞中表达. Kupffer细胞为常驻肝血窦的巨噬细胞, 占单核-巨噬细胞总量的80%-90%, 是单核-巨噬细胞系统的典型代表, 但目前尚无有关Kupffer细胞中IRAK-M表达及其作用的研究报道.
本研究从蛋白质与mRNA水平研究了IRAK-M在内毒素诱导Kupffer细胞耐受中的表达及其意义.
本研究表明IRAK-M可能对Kupffer细胞的LPS信号通路起负性调节作用, 并可能参与Kupffer细胞内毒素耐受状态的形成, 为内毒素血症的临床治疗提供了潜在的干预靶点.
内毒素耐受: 指机体或单核-巨噬细胞受脂多糖初次刺激后, 对脂多糖的再次刺激呈低反应性.
本研究对机体炎症介质释放, 信号分子传递造成机体过度炎症反应及器官损害的可能机制进行了较深入的探讨, 具有一定的理论意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Li L, Pan J, Yu Y. Development of sorbent therapy for multiple organ dysfunction syndrome (MODS). Biomed Mater. 2007;2:R12-R16. [PubMed] [DOI] |
| 2. | Chiao CW, Lee SS, Wu CC, Su MJ. Thaliporphine increases survival rate and attenuates multiple organ injury in LPS- induced endotoxaemia. Naunyn Schmiedebergs Arch Pharmacol. 2005;371:34-43. [PubMed] [DOI] |
| 3. | Martins JO, Ferracini M, Ravanelli N, Landgraf RG, Jancar S. Insulin inhibits LPS-induced signaling pathways in alveolar macrophages. Cell Physiol Biochem. 2008;21:297-304. [PubMed] [DOI] |
| 4. | West MA, Koons A. Endotoxin tolerance in sepsis: concentration-dependent augmentation or inhibition of LPS-stimulated macrophage TNF secretion by LPS pretreatment. J Trauma. 2008;65:893-898; discussion 898-900. [PubMed] [DOI] |
| 5. | Fan H, Cook JA. Molecular mechanisms of endotoxin tolerance. J Endotoxin Res. 2004;10:71-84. [PubMed] [DOI] |
| 6. | Kobayashi K, Hernandez LD, Galán JE, Janeway CA Jr, Medzhitov R, Flavell RA. IRAK-M is a negative regulator of Toll-like receptor signaling. Cell. 2002;110:191-202. [PubMed] [DOI] |
| 7. | del Fresno C, Soler-Rangel L, Soares-Schanoski A, Gómez-Piña V, González-León MC, Gómez-García L, Mendoza-Barberá E, Rodríguez-Rojas A, García F, Fuentes-Prior P. Inflammatory responses associated with acute coronary syndrome up-regulate IRAK-M and induce endotoxin tolerance in circulating monocytes. J Endotoxin Res. 2007;13:39-52. [PubMed] [DOI] |
| 8. | Rosati O, Martin MU. Identification and characterization of murine IRAK-M. Biochem Biophys Res Commun. 2002;293:1472-1477. [PubMed] [DOI] |
| 9. | Janssens S, Beyaert R. Functional diversity and regulation of different interleukin-1 receptor-associated kinase (IRAK) family members. Mol Cell. 2003;11:293-302. [PubMed] [DOI] |
| 10. | Naito M, Hasegawa G, Ebe Y, Yamamoto T. Differentiation and function of Kupffer cells. Med Electron Microsc. 2004;37:16-28. [PubMed] [DOI] |
| 11. | Xu FL, You HB, Li XH, Chen XF, Liu ZJ, Gong JP. Glycine attenuates endotoxin-induced liver injury by downregulating TLR4 signaling in Kupffer cells. Am J Surg. 2008;196:139-148. [PubMed] [DOI] |
| 12. | Palsson-McDermott EM, O'Neill LA. Signal transduction by the lipopolysaccharide receptor, Toll-like receptor-4. Immunology. 2004;113:153-162. [PubMed] [DOI] |
| 13. | Medvedev AE, Piao W, Shoenfelt J, Rhee SH, Chen H, Basu S, Wahl LM, Fenton MJ, Vogel SN. Role of TLR4 tyrosine phosphorylation in signal transduction and endotoxin tolerance. J Biol Chem. 2007;282:16042-16053. [PubMed] [DOI] |
| 14. | Dong W, Liu Y, Peng J, Chen L, Zou T, Xiao H, Liu Z, Li W, Bu Y, Qi Y. The IRAK-1-BCL10-MALT1-TRAF6-TAK1 cascade mediates signaling to NF-kappaB from Toll-like receptor 4. J Biol Chem. 2006;281:26029-26040. [PubMed] [DOI] |
| 15. | Thomas P, Hayashi H, Lazure D, Burke PA, Bajenova O, Ganguly A, Forse RA. Inhibition of lipopolysaccharide activation of Kupffer cells by transition metals. J Surg Res. 2008;148:116-120. [PubMed] [DOI] |
| 16. | Abrahám S, Szabó A, Kaszaki J, Varga R, Eder K, Duda E, Lázár G, Tiszlavicz L, Boros M, Lázár G Jr. Kupffer cell blockade improves the endotoxin-induced microcirculatory inflammatory response in obstructive jaundice. Shock. 2008;30:69-74. [PubMed] [DOI] |
| 17. | Gobejishvili L, Barve S, Joshi-Barve S, McClain C. Enhanced PDE4B expression augments LPS-inducible TNF expression in ethanol-primed monocytes: relevance to alcoholic liver disease. Am J Physiol Gastrointest Liver Physiol. 2008;295:G718-G724. [PubMed] [DOI] |
| 18. | Higuchi Y, Kawakami S, Yamashita F, Hashida M. The potential role of fucosylated cationic liposome/NFkappaB decoy complexes in the treatment of cytokine-related liver disease. Biomaterials. 2007;28:532-539. [PubMed] [DOI] |