修回日期: 2009-02-12
接受日期: 2009-02-16
在线出版日期: 2009-03-08
目的: 观察丹参酮ⅡA(Tan ⅡA)对低氧培养下人胃癌SGC7901细胞增殖、凋亡及HIF-1α表达的影响.
方法: 用氯化钴(CoCl2)创建低氧模型, 设常氧对照组、低氧对照组和低氧加不同浓度Tan ⅡA组. 分别取0.5、1.0、2.0、5.0、10.0 mg/L的Tan ⅡA干预低氧胃癌SGC7901细胞24、48、72 h后, MTT法检测细胞活力; 用上述同样浓度的Tan ⅡA干预低氧胃癌细胞48 h和72 h后, HOECHST染色法检测细胞凋亡. Tan ⅡA(0.5、2.0、10.0 mg/L)干预低氧胃癌细胞48 h后, 免疫细胞化学二步法检测HIF-1α蛋白表达的变化.
结果: MTT法证实, 低氧条件下, Tan ⅡA呈时间、剂量依赖性地抑制胃癌SGC-7901细胞增殖(P<0.01), 10.0 mg/L Tan ⅡA作用细胞72 h后, 其抑制率达71.2%. HOECHST染色法发现, 低氧条件下, 分别用0.5-10.0 mg/L浓度的Tan ⅡA作用胃癌细胞48、72 h, Tan ⅡA可呈时间、剂量依赖性地诱导胃癌SGC-7901细胞凋亡(F = 60354.00, 187922.10, 均P<0.05), 10.0 mg/L Tan ⅡA 作用细胞72 h后, 凋亡率达40.70%±1.55%. 免疫细胞化学法显示, Tan ⅡA呈剂量依赖性地抑制低氧诱导的HIF-1α蛋白表达(F = 712.326, P<0.01).
结论: 低氧条件下, Tan ⅡA抑制胃癌细胞增殖并诱导其凋亡, 这种作用可能与其抑制HIF-1α蛋白表达有关.
引文著录: 宗绪山, 冯玉光, 王鑫, 邢国辉, 吴美英, 朱芸. 丹参酮ⅡA对低氧培养下人胃癌SGC7901细胞增殖、凋亡及HIF-1α表达的影响. 世界华人消化杂志 2009; 17(7): 642-646
Revised: February 12, 2009
Accepted: February 16, 2009
Published online: March 8, 2009
AIM: To study the effects of Tan II A on the proliferation, apoptosis and expression of HIF-1α of human gastric cancer cell line SGC7901 under hypoxia.
METHODS: The model of hypoxia was established by CoCl2. There were four groups: normal control group, hypoxia control group, and hypoxia combined with different concentrations of Tan II A group. After Tan II A was added to the media with 0.5, 1.0, 2.0, 5.0 and 10.0 mg/L, respectively for 24, 48 and 72 h during hypoxia, and the cells' proliferative vitality was detected by MTT. After Tan II A was added to the media with 0.5, 1.0, 2.0, 5.0 and 10.0 mg/L respectively for 48 and 72 h during hypoxia, the apoptosis of SGC7901 human gastric cancer cells was detected by HOECHST staining . After Tan ⅡA was added to the media with 0.5, 2.0 and 10.0 mg/L respectively for 48 h during hypoxia, the expression of HIF-1α protein was detected by immunocytochemical staining.
RESULTS: MTT confirmed that the proliferation of SGC7901 cancer cells was obviously inhibited by Tan II A (P < 0.01) in a dose- and time-dependent manner under hypoxia, and the inhibition rate reached 71.2% after treatment with 10 mg/L Tan II A for 72 h. HOECHST staining found Tan II A induced apoptosis of gastric cancer cells in a dose- and time-dependent manner after treatment with 0.5-10.0 mg/L Tan II A for 48 h and 72 h respectively under hypoxia (F = 60354.00, 187922.10, both P < 0.05), and the apoptosis rate reached 40.70% ± 1.55% after treatment with 10.0 mg/L Tan II A for 72 h. Immunocytochemical staining revealed that the expression of HIF-1α protein was inhibited by Tan II A in a dose-dependent manner under hypoxia (F = 712.326, P < 0.01).
CONCLUSION: Tan II A inhibits the proliferation of SGC7901 human gastric cancer cells and induces the apoptosis of them under hypoxia, which may be related to the down regulation of HIF-1α protien expression by Tan II A.
- Citation: Zong XS, Feng YG, Wang X, Xing GH, Wu MY, Zhu Y. Effects of Tan II A on the proliferation, apoptosis and expression of HIF-1α of human gastric cancer cell line SGC7901 under hypoxia. Shijie Huaren Xiaohua Zazhi 2009; 17(7): 642-646
- URL: https://www.wjgnet.com/1009-3079/full/v17/i7/642.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i7.642
肿瘤低氧是多种实体瘤包括胃癌的特点, 而低氧环境下低氧诱导因子-1α(hypoxia inducible factor-1 alpha, HIF-1α)的表达是肿瘤发生发展、血管生成、放化疗抵抗、恶性演进、侵袭与转移的关键环节之一[1-4,10-11]. 特别是低氧导致克隆选择, 使恶性程度高、凋亡机制缺陷的肿瘤细胞群得以在低氧环境下逆境生存增殖并对各种化疗药物耐药, 使肿瘤不断演进[5-9]. 因此, 寻找低氧下对肿瘤有抑制作用或抑制HIF-1α表达或活性的小分子化合物是目前国际肿瘤界热点[12-17]. 而中医学理论认为, "瘀血在经络脏腑之间,结为症瘕(肿瘤)", 并以此为依据采用活血化瘀抗肿瘤的治则治疗肿瘤, 取得了良好的治疗效果, 但其分子机制尚待深入探索[18]. 我们推测, 肿瘤低氧现象和中医的"淤血"理论暗合. 丹参是著名的活血化瘀中药, 丹参酮ⅡA(Tan ⅡA)是其重要单体成分之一, 临床和基础研究表明, 丹参及Tan ⅡA具有抗肿瘤活性, 目前已发现其对多种肿瘤细胞具有生长抑制、诱导凋亡和诱导分化作用, 并调节多种肿瘤相关基因的表达[19]. 根据前述理论, 我们推测Tan ⅡA活血化瘀抗肿瘤的分子机制可能是通过抑制低氧微环境下肿瘤细胞HIF-1α的表达或活性发挥抗肿瘤作用. Tan ⅡA对低氧肿瘤的影响未见报道. 本课题研究了Tan ⅡA对经典低氧模拟剂氯化钴(CoCl2)[20]培养的胃癌SGC7901细胞增殖、凋亡和HIF-1α表达的影响, 以深化对丹参及其有效成分活血化瘀抗肿瘤作用和机制的认识, 为其抗肿瘤的临床应用提供理论依据.
人胃癌细胞株SGC7901购自山东省医学科学院, 接种于含100 mL/L胎牛血清、青霉素、链霉素各l×105 U/L的RPMI 1640培养液中, 置37℃, 50 mL/L CO2培养箱内常规传代培养. 丹参酮ⅡA (Tan ⅡA)为中国药品生物制品检定所的标准品, 用二甲亚砜(DMSO)溶解, 终浓度为0.2 g/L, 4℃冷藏备用. HOECHST32258荧光染色试剂盒及CoCl2购于美国Sigma公司. RPMI 1640培养基、MTT均购自美国Gibco公司. 胎牛血清(杭州四季青), HIF-1α mAb及PV-9000免疫组化试剂盒均为为北京中山金桥生物技术有限公司产品. 二氧化碳恒温培养箱(HREA Cell Germany); TE300倒置显微镜及BH-2型荧光显微镜(Olympus公司).
1.2.1 MTT法测定Tan ⅡA对低氧下培养的胃癌细胞生长的抑制率: 取对数生长期的人胃癌SGC7901细胞, 按照3×107/L的密度接种于96孔培养板, 每孔体积为100 μL, 设常氧对照组、低氧模拟剂(CoCl2, 150 μmol/L)对照组及CoCl2加Tan ⅡA组, 待细胞贴壁后分别加入CoCl2及Tan ⅡA(0.5、1.0、2.0、5.0、10.0 mg/L), 每个浓度组设6个复孔, 四周加入不含药物的细胞培养液为空白对照. 分别培养至24、48、72 h后, 每孔加入5 g/L的MTT溶液20 μL, 继续培养4 h, 轻轻吸尽上清液, 加入二甲基亚砜150 μL/每孔, 振荡10 min, 在酶标仪上以490 nm波长测每孔的吸光度A值, 并取6孔的平均值, 细胞生长抑制率 = (A常氧对照组-A低氧对照组或用药组)/A常氧对照组×100%.
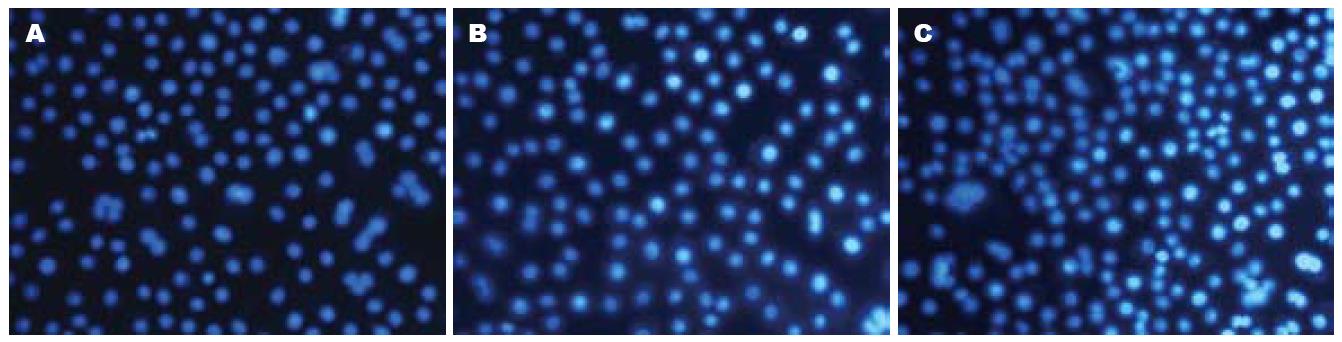
1.2.2 HOECHST染色法检测Tan ⅡA对低氧下培养的胃癌细胞凋亡的影响: 取对数生长期的SGC7901制成2×108/L的细胞悬液, 每孔0.5 mL, 加入放有盖玻片的24孔板内, 设常氧对照组、低氧模拟剂CoCl2(150 μmol/L)对照组及CoCl2加不同浓度Tan ⅡA组, 待细胞贴壁后分别加入CoCl2及Tan ⅡA(0.5、1.0、2.0、5.0、10.0 mg/L)作用48 h和72 h后分别取出细胞爬片, 甲醇/冰醋酸固定液固定5 min后, 加入荧光染液HOCHEST33258重悬细胞, 室温避光l h, PBS冲洗, 用抗荧光液封片. 判定标准: 正常细胞核为蓝色, 凋亡的细胞核为白色. 每片连续观察10个细胞分布均匀的200倍镜视野, 每视野计数50个细胞, 共500个细胞, 计算其阳性率百分数, 并取其均值. 凋亡率 = 凋亡细胞数/(正常细胞数+凋亡细胞数).
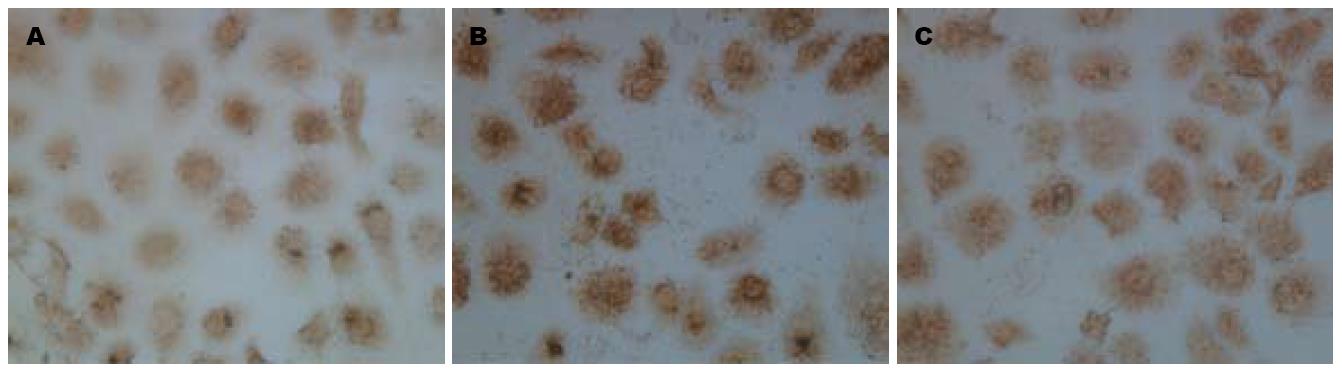
1.2.3 免疫细胞化学二步法观察Tan ⅡA对低氧下培养的胃癌细胞HIF-1α表达的影响: 取对数生长期的SGC7901制成2×108/L的细胞悬液, 每孔0.5 mL, 加入放有盖玻片的24孔板内, 设常氧对照组、低氧模拟剂CoCl2(150 μmol/L)对照组及CoCl2加不同浓度Tan ⅡA组, 待细胞贴壁后分别加入CoCl2及不同浓度的Tan ⅡA(0.5, 2.0, 10.0 mg/L), 48 h后取出细胞爬片, 冷丙酮固定5 min, PBS冲洗, 按PV-9000试剂盒步骤检测HIF-1α, DAB显色, 脱水, 透明, 中性树胶封片. 用已知阳性的乳腺癌切片作为阳性对照, 以PBS代替一抗作为阴性对照. 结果判定: HIF-1α阳性结果为细胞质或胞核内有棕黄色颗粒出现. 采用HPAIS-1000彩色病理图文分析系统, 检测HIF-1α阳性细胞的平均A值, 以间接反映HIF-1α蛋白的表达量, 并取其均值.
统计学处理 数据用mean±SD表示, 组间比较用t检验和方差分析, 用SPSS13.0统计软件分析.
低氧下胃癌细胞的增殖受抑制, 并呈时间依赖性; 而Tan ⅡA则可呈剂量和时间依赖性地进一步抑制低氧胃癌细胞的生长(24 h F值63.804, P<0.05; 48 h F值166.895, P<0.01; 72 h F值405.185, P<0.01), 10.0 mg/L Tan ⅡA作用细胞72 h后, 其抑制率达71.2%(表1).
| 24 h | 48 h | 72 h | ||||
| A值 | IR(%) | A值 | IR(%) | A值 | IR(%) | |
| 常氧组 | 0.496±0.042 | 0.722±0.028 | 0.834±0.030 | |||
| 低氧组 | 0.407±0.014 | 18.0 | 0.582±0.035 | 19.4 | 0.659±0.035 | 21.4 |
| 低氧加Tan ⅡA组(mg/L) | ||||||
| 0.5 | 0.395±0.024 | 22.0 | 0.516±0.019 | 27.8 | 0.602±0.020 | 28.6 |
| 1.0 | 0.370±0.026 | 26.0 | 0.438±0.031 | 38.9 | 0.506±0.020 | 39.3 |
| 2.0 | 0.329±0.017 | 34.0 | 0.365±0.048 | 48.6 | 0.432±0.037 | 48.8 |
| 5.0 | 0.294±0.113 | 40.0 | 0.295±0.026 | 59.7 | 0.331±0.016 | 60.7 |
| 10.0 | 0.251±0.028 | 50.0 | 0.220±0.034 | 69.4 | 0.290±0.013 | 71.2 |
常氧组细胞培养48、72 h, 只有少数细胞发生凋亡; 单纯低氧培养48、72 h, 细胞凋亡率分别为3.01±0.35、5.07±0.32, 提示低氧可诱导胃癌细胞凋亡(单纯低氧组与常氧对照组比较P = 0.001). 而0.5-10.0 mg/L浓度的Tan ⅡA低氧下作用胃癌细胞48、72 h, 凋亡率呈浓度和时间依赖性进一步升高(24 h F值60354.00, P<0.05; 48 h F值187922.10, P<0.01, 表2). 10.0 mg/L Tan ⅡA低氧培养72 h后细胞凋亡率达40.70±1.55(图1).
| 48 h | 72 h | |
| 常氧组 | 1.07±0.13 | 2.32±0.16 |
| 低氧组 | 3.01±0.35 | 5.07±0.32 |
| 低氧加Tan ⅡA组(mg/L) | ||
| 0.5 | 4.23±0.39 | 6.74±0.34 |
| 1.0 | 6.73±0.58 | 10.05±0.48 |
| 2.0 | 11.06±1.30 | 18.87±1.24 |
| 5.0 | 20.58±1.46 | 26.97±1.77 |
| 10.0 | 31.03±1.47 | 40.70±1.55 |
常氧对照组HIF-1α蛋白呈低水平表达, 单纯低氧培养细胞48 h后HIF-1α蛋白表达明显增高, 而低氧加Tan ⅡA组HIF-1α蛋白表达随Tan ⅡA浓度的增加而逐渐降低. 常氧组、单纯低氧组、低氧加Tan ⅡA 0.5、2.0、10.0 mg/L各组A值分别为0.177±0.019、0.670±0.044、0.552±0.035、0.438±0.031、0.379±0.034. 说明TanⅡA呈剂量依赖性的抑制低氧诱导的HIF-1α的表达(F = 712.326, P<0.01, 图2).
肿瘤低氧是多种实体瘤包括胃癌的特点, 其缺氧主要是由于实体瘤低分化, 恶性程度高, 生长迅速, 血管生长的相对滞后, 常常引起血供不足, 循环和淋巴系统紊乱. 而HIF-1α的表达, 是肿瘤发生发展、血管生成、放化疗抵抗、恶性演进、侵袭与转移的关键环节之一[1-11]. 低氧还导致肿瘤基因组和蛋白质组不稳定, 通过克隆选择, 使发生肿瘤相关基因突变的肿瘤细胞亚群在低氧逆境下生存增殖, 耐受放化疗打击, 进而浸润转移[5-9]. 因此, 探索低氧环境下有效的抗肿瘤药物已经成为国内外学者的共识[12-17]. 已经发现, 作为丹参的主要有效提取成分, Tan ⅡA在常氧下抑制人肺癌细胞、鼻咽癌细胞、肝癌细胞、胃癌细胞等多种实体瘤肿瘤细胞以及人早幼粒白血病细胞及其耐药细胞株的增殖, 诱导肿瘤细胞凋亡及分化[19], 然而低氧下Tan ⅡA对肿瘤细胞包括胃癌细胞的影响尚未见报道. 本研究通过细胞增殖抑制实验发现, 与常氧组比较, 低氧下胃癌细胞增殖减慢, 而Tan ⅡA对低氧下胃癌细胞的生长增殖具有进一步的抑制作用, 10.0 mg/L浓度时其抑制率达71.2%, 并呈剂量、时间依赖性. 有研究表明, 低氧对肿瘤细胞周期有明显影响, 低氧使肿瘤细胞停止于G1/S期, 而这种细胞群不易被放化疗手段杀伤, 成为放化疗抵抗的原因之一[20-22]. 而我们的结果表明, Tan ⅡA对低氧下的胃癌细胞增殖有明显抑制作用, 推测Tan ⅡA可能对处于G1/S期的低氧细胞群有杀伤或诱导凋亡作用. 我们应用HOECHST染色法进一步观察了Tan ⅡA对低氧下培养的胃癌细胞凋亡的影响. 结果表明, 低氧本身可一定程度的诱导胃癌细胞凋亡, 而Tan ⅡA则可呈剂量和时间依赖性的诱导胃癌细胞进一步凋亡, 结合MTT结果, 我们推测Tan ⅡA可能对处于细胞周期各期特别是G1/S期的细胞群均有诱导凋亡作用. 研究表明, 低氧环境下, 多种肿瘤细胞包括胃癌细胞存在凋亡异常, 一方面低氧使凋亡敏感细胞群发生凋亡, 另一方面低氧使凋亡耐受细胞群得以克隆增殖进而成为具有放化疗抵抗和高侵袭转移能力的优势细胞群, 这种细胞群的治疗是放化疗的难点[5-9]. 我们的结果提示, Tan ⅡA可能对这类细胞群具有诱导凋亡作用. HIF-1是低氧条件下由HIF-1α和HIF-1β两个亚单位聚合产生的一种异源二聚体转录因子, 是调控多种低氧反应靶基因表达的关键转录因子. 其中HIF-1α蛋白在低氧下稳定, 而常氧下则被泛素-蛋白酶系统迅速降解; 而HIF-1β则呈组成性表达, 不受氧分压的调控[3]. 研究发现HIF-1通过调控多种靶基因的表达以及与肿瘤相关基因的相互作用, 对肿瘤的发生发展、血管生成、放化疗抵抗、恶性演进、侵袭与转移、克隆选择与调亡抵抗等有重要影响[1-11]. 多数研究表明, HIF-1α表达升高使肿瘤细胞耐受凋亡, 放化疗抵抗, 这与肿瘤细胞的癌基因和抑癌基因的具体变化有关[23-26]. 我们应用免疫细胞化学法发现: 常氧下胃癌SGC7901细胞HIF-1α呈低水平表达, 低氧下HIF-1α表达明显增高, 而Tan ⅡA可呈剂量依赖性地抑制低氧下HIF-1α的表达. 因此, 我们推测Tan ⅡA诱导低氧胃癌细胞凋亡的作用可能与其抑制HIF-1α的表达相关. 总之, 我们的初步研究结果表明, Tan ⅡA在低氧下可抑制胃癌细胞的增殖, 并诱导其凋亡; 其机制至少部分可能是通过抑制HIF-1α的表达来实现的. 这一发现有助于揭示Tan ⅡA活血化瘀抗肿瘤的分子机制. 低氧下Tan ⅡA对胃癌细胞的上述作用的具体分子机制值得进一步深入探讨.
肿瘤微环境低氧是多种肿瘤的特点, 是导致肿瘤发生发展的重要原因. 寻找低氧下对肿瘤有抑制作用的小分子化合物是目前国际肿瘤界热点. 中医学理论认为, "瘀血在经络脏腑之间, 结为症瘕(肿瘤)", 并以此为依据采用活血化瘀抗肿瘤的治则治疗肿瘤. 本课题组推测中医所指的"淤血"在分子细胞水平很可能就是肿瘤的缺氧现象.
唐文富, 副教授, 四川大学华西医院中西医结合科
依据中医的"淤血"理论, 从活血化瘀中药中筛选在低氧环境下对肿瘤有抑制作用的小分子化合物具有广阔的前景, 同时有助于揭示活血化瘀药物抗肿瘤的分子机制, 具有重要的理论和临床价值.
本研究选择典型的活血化瘀中药丹参的主要有效单体成分丹参酮ⅡA, 从低氧角度阐明其活血化瘀抗肿瘤的微观机制, 达到中西医两种理论的内在统一.
本研究发现, 低氧条件下, 丹参酮ⅡA可抑制胃癌细胞增殖并诱导其凋亡, 这种作用可能与其抑制HIF-1α蛋白表达有关. 该研究结果表明, 丹参酮ⅡA可能是对低氧肿瘤有效的小分子单体化合物. 通过该研究, 初步揭示了丹参活血化瘀药物抗肿瘤的分子机制, 为其抗肿瘤的临床应用提供了初步理论依据.
本研究结合肿瘤低氧特点探索中药来源的单体成分丹参酮的作用机制, 具有一定的新意, 如能进一步进行中药或者复方研究, 则更有临床应用前景和价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Maxwell PH, Dachs GU, Gleadle JM, Nicholls LG, Harris AL, Stratford IJ, Hankinson O, Pugh CW, Ratcliffe PJ. Hypoxia- inducible factor-1 modulates gene expression in solid tumors and influences both angiogenesis and tumor growth. Proc Natl Acad Sci U S A. 1997;94:8104-8109. [PubMed] [DOI] |
| 2. | Zhong H, De Marzo AM, Laughner E, Lim M, Hilton DA, Zagzag D, Buechler P, Isaacs WB, Semenza GL, Simons JW. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 1999;59:5830-5835. [PubMed] |
| 3. | Höckel M, Vaupel P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects. J Natl Cancer Inst. 2001;93:266-276. [PubMed] [DOI] |
| 4. | Stoeltzing O, McCarty MF, Wey JS, Fan F, Liu W, Belcheva A, Bucana CD, Semenza GL, Ellis LM. Role of hypoxia- inducible factor 1alpha in gastric cancer cell growth, angiogenesis, and vessel maturation. J Natl Cancer Inst. 2004;96:946-956. [PubMed] |
| 5. | Semenza GL. Hypoxia, clonal selection, and the role of HIF-1 in tumor progression. Crit Rev Biochem Mol Biol. 2000;35:71-103. [PubMed] [DOI] |
| 6. | Bangoura G, Yang LY, Huang GW, Wang W. Expression of HIF-2alpha/EPAS1 in hepatocellular carcinoma. World J Gastroenterol. 2004;10:525-530. [PubMed] |
| 7. | Zhou J, Schmid T, Schnitzer S, Brüne B. Tumor hypoxia and cancer progression. Cancer Lett. 2006;237:10-21. [PubMed] [DOI] |
| 8. | Shannon AM, Bouchier-Hayes DJ, Condron CM, Toomey D. Tumour hypoxia, chemotherapeutic resistance and hypoxia- related therapies. Cancer Treat Rev. 2003;29:297-307. [PubMed] [DOI] |
| 9. | Graeber TG, Osmanian C, Jacks T, Housman DE, Koch CJ, Lowe SW, Giaccia AJ. Hypoxia-mediated selection of cells with diminished apoptotic potential in solid tumours. Nature. 1996;379:88-91. [PubMed] [DOI] |
| 12. | Melillo G. Inhibiting hypoxia-inducible factor 1 for cancer therapy. Mol Cancer Res. 2006;4:601-605. [PubMed] [DOI] |
| 13. | Rapisarda A, Uranchimeg B, Scudiero DA, Selby M, Sausville EA, Shoemaker RH, Melillo G. Identification of small molecule inhibitors of hypoxia-inducible factor 1 transcriptional activation pathway. Cancer Res. 2002;62:4316-4324. [PubMed] |
| 14. | Semenza GL. Targeting HIF-1 for cancer therapy. Nat Rev Cancer. 2003;3:721-732. [PubMed] [DOI] |
| 15. | Melillo G, Semenza GL. Meeting report: exploiting the tumor microenvironment for therapeutics. Cancer Res. 2006;66:4558-4560. [PubMed] [DOI] |
| 16. | Powis G, Kirkpatrick L. Hypoxia inducible factor-1alpha as a cancer drug target. Mol Cancer Ther. 2004;3:647-654. [PubMed] |
| 17. | Wouters A, Pauwels B, Lardon F, Vermorken JB. Review: implications of in vitro research on the effect of radiotherapy and chemotherapy under hypoxic conditions. Oncologist. 2007;12:690-712. [PubMed] [DOI] |
| 20. | Yuan Y, Hilliard G, Ferguson T, Millhorn DE. Cobalt inhibits the interaction between hypoxia-inducible factor-alpha and von Hippel-Lindau protein by direct binding to hypoxia-inducible factor-alpha. J Biol Chem. 2003;278:15911-15916. [PubMed] [DOI] |
| 21. | 李 建军, 李 宏宇, 辛 彦, 陈 延治, 李 光, 刘 意, 张 素敏, 吴 东瑛. 乏氧对胃癌细胞系MGC803细胞周期、乏氧相关基因 和蛋白表达的影响. 世界华人消化杂志. 2004;12:2539-2542. [DOI] |
| 22. | Gardner LB, Li Q, Park MS, Flanagan WM, Semenza GL, Dang CV. Hypoxia inhibits G1/S transition through regulation of p27 expression. J Biol Chem. 2001;276:7919-7926. [PubMed] [DOI] |
| 23. | Sullivan R, Paré GC, Frederiksen LJ, Semenza GL, Graham CH. Hypoxia-induced resistance to anticancer drugs is associated with decreased senescence and requires hypoxia-inducible factor-1 activity. Mol Cancer Ther. 2008;7:1961-1973. [PubMed] [DOI] |
| 24. | Liu L, Ning X, Sun L, Zhang H, Shi Y, Guo C, Han S, Liu J, Sun S, Han Z. Hypoxia-inducible factor-1 alpha contributes to hypoxia-induced chemoresistance in gastric cancer. Cancer Sci. 2008;99:121-128. [PubMed] |
| 25. | Greijer AE, van der Wall E. The role of hypoxia inducible factor 1 (HIF-1) in hypoxia induced apoptosis. J Clin Pathol. 2004;57:1009-1014. [PubMed] [DOI] |