修回日期: 2009-01-21
接受日期: 2009-02-09
在线出版日期: 2009-02-28
目的: 观察重症急性胰腺炎(SAP)时三磷酸肌醇(IP3)变化及其与钙代谢的关系, 以探讨SAP的发病机制.
方法: 20只SD大鼠随机分为2组: 重症急性胰腺炎模型组(SAP组)和对照组(C组), 每组10只. SAP组以30 g/L牛磺胆酸钠逆行胰胆管注射建立SAP模型, C组为假手术并注射生理盐水(NS). 两组术后立即、6 h行阴茎背静脉注射NS. 术后18 h处死动物. 观察各组胰腺细胞内IP3和钙(Ca2+)、血清肿瘤坏死因子α(TNF-α)、血清钙(血钙)和淀粉酶(AMY)及胰腺的病理改变.
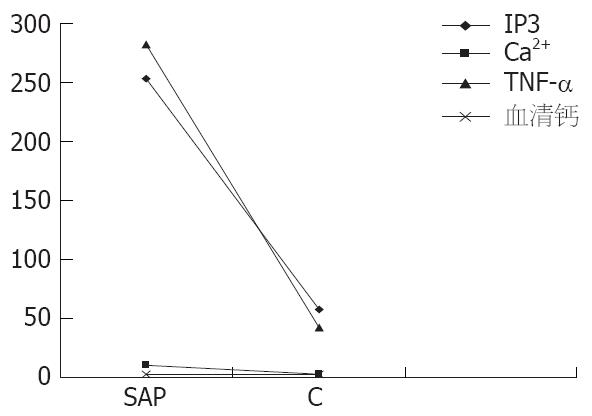
结果: SAP组胰腺细胞内IP3、Ca2+和TNF-α显著高于C组(252.99±35.72 μg/L vs 57.28±48.66 μg/L, 10.63±2.38 vs 2.50±1.04, 281.66±106.83 ng/L vs 42.27±16.75 ng/L, 均P<0.05), 而SAP组的血钙明显低于C组(2.51±0.11 mmol/L vs 3.04±0.15 mmol/L, P<0.05). 胰腺细胞内IP3与Ca2+和TNF-α间呈明显正相关(r = 0.987, 0.937, P<0.05), 上述三者与血钙呈明显负相关(r = -0.997, -0.980, -0.915, 均P<0.05). SAP组AMY和胰腺病理评分分别显著高于C组(5336.1±1937.83 U/L vs 783.5±200.07 U/L, 11.1±0.88 vs 6.4±1.07, 均P<0.05).
结论: SAP存在胰腺细胞内IP3明显升高, IP3是引起细胞内外钙和TNF-α变化的重要原因之一.
引文著录: 石承先, 王行. 大鼠重症急性胰腺炎三磷酸肌醇变化与钙代谢的关系. 世界华人消化杂志 2009; 17(6): 598-601
Revised: January 21, 2009
Accepted: February 9, 2009
Published online: February 28, 2009
AIM: To investigate the relation of inositol 1, 4, 5- trisphosphate (IP3) with calcium metabolism in rats with severe acute pancreatitis (SAP).
METHODS: Twenty Sprague-Dawley rats were randomly divided into 2 groups: severe acute pancreatitis group (SAP group, n = 10) and control group (group C, n = 10). The SAP model was induced by retrograde injection of 3% sodium taurocholate to the biliary-pancreas duct, while the group C underwent sham operation. After operation, normal sodium (NS) was injected by vena in both groups. Serum amylase (AMY), calcium and tumor necrosis factor α (TNF-α) were examined. Intracellular IP3 and intracellular calcium ion (Ca2+) and histological change of pancreas were measured.
RESULTS: The IP3 and Ca2+ of pancreas and serum TNF-α in group SAP were significantly higher than those in group C (252.99 ± 35.72 μg/L vs 57.28 ± 48.66 μg/L, 10.63 ± 2.38 vs 2.50 ± 1.04, 281.66 ± 106.83 ng/L vs 42.27 ± 16.75 ng/L, all P < 0.05). Serum calcium was significantly lower in SAP group than in group C (2.51 ± 0.11 mmol/L vs 3.04 ± 0.15 mmol/L, P < 0.05). The IP3 of pancreatic gland was positively correlated with Ca2+ and TNF-α (r = 0.987, 0.937, both P < 0.05). The IP3 and Ca2+ of pancreas and serum TNF-α were negatively correlated with the serum calcium in SAP group (r = -0.997, -0.980, -0.915, all P < 0.05). The AMY and pathological scores of pancreatic gland were significantly higher in SAP group than in group C (5336.1 ± 1937.83 U/L vs 783.5 ± 200.07 U/L, 11.1 ± 0.88 vs 6.4 ± 1.07, both P < 0.05).
CONCLUSION: Pancreatic intracellular IP3, which increases with Ca2+ and TNF-α, serves as a main factor for inducing calcium changes in severe acute pancreatitis.
- Citation: Shi CX, Wang H. Relation of inositol 1, 4, 5- trisphosphate with calcium metabolism in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 598-601
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/598.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.598
急性胰腺炎(acute pancreatitis, AP)是一种临床常见的急腹症. 约25%的AP会发展为重型急性胰腺炎(severe acute pancreatitis, SAP)[1]. SAP发展迅速, 并发症多, 死亡率高[2]. 在SAP的早期和感染期, 由SAP及其感染诱发的细胞因子瀑布样释放导致的重要器官损伤是SAP死亡的主要原因[2-3]. 观察发现, SAP时存在钙超载, 钙超载可激活核因子-κB及相关的炎症因子, 引起胰腺坏死[4-5]. 1, 4, 5三磷酸肌醇(inositol 1, 4, 5-trisphosphate, IP3)是细胞内的第二信使, 对细胞内钙调控起着重要的作用[6]. 然而在SAP时IP3有何变化及与钙代谢的关系, 尚不清楚. 本研究通过建立SAP模型, 观察SAP时胰腺细胞内IP3的变化及其与钙代谢的关系, 以探讨SAP的发病机制.
清洁级健康成年♂SD大鼠20只(购自中国人民解放军第三军医大学实验动物中心), 体质量为200-250 g, 以标准大鼠颗粒喂养, 室温22℃, 相对湿度85%左右. 牛磺胆酸钠购自美国Sigma公司. IP3 ELISA试剂盒购自北京尚柏生物有限公司. FLUO-3、AM Ester试剂盒购自北京博雷德生物有限公司. TNF-α ELISA试剂盒购自重庆晶美生物工程有限公司.
1.2.1 动物分组与处理: 20只大鼠随机分为2组: SAP模型组(SAP组)和对照组(C组), 每组10只. 各组动物于实验前12 h禁食, 自由饮水. 采用乙醚持续吸入麻醉, 按常规无菌方法作上腹正中切口入腹, 参照Aho et al方法并改进复制SAP大鼠模型[7-8]. SAP组在开腹后, 用无创伤血管夹夹闭肝门部胆管, 在相当于胰胆管开口处对侧肠壁无血管区, 用4.5号针穿刺肠壁, 通过肠腔后逆行穿刺入胰胆管内1 cm, 以拇、食指压迫封闭胰胆管远端并固定穿刺针, 推注30 g/L牛磺胆酸钠1 mL/kg, 推注速度为0.2 mL/min, 压力约20 cm H2O, 术中即可见胰腺从胰管周围开始充血、水肿. 保持压力并防止药液逆流10 min后退出穿刺针, 撤除肝门部血管夹, 以5-0丝线关闭穿刺孔. 复位肠管, 关腹. C组假手术并胰胆管内逆行推注生理盐水(NS)1 mL/kg. 术后两组于立刻、6 h行阴茎背静脉穿刺, 并推注NS 8 mL/kg. 术后所有动物禁食, 自由饮水. 两组动物于术后18 h乙醚麻醉后开腹, 自下腔静脉采血约4 mL, 3000 r/min离心15 min, 各取血清约0.5 mL装入2个EP管, 置于-80℃冰箱内保存待批量检测. 快速切取胰腺组织块, 最大不超过0.5 mm×0.5 mm×0.8 mm3, 其中胰腺组织去除筋膜、血管等结缔组织后, 分装入2个EP管置于-80℃冰箱内保存, 待测IP3等; 余胰腺组织块以10%甲醛溶液固定, 并放入4℃冰箱内保存待批量病理检查. 所有动物均麻醉后放血处死.
1.2.2 观察术后动物一般情况: 如精神状态、活动、反应、进食进饮, 腹腔内大体病理变化等.
1.2.3 检测胰腺组织IP3: 将胰腺组织用电子天平称质量后放入0.01 mol/L、pH7.2-7.4的PBS液(组织重量与PBS体积之比为1∶10), 在冰浴条件下用超声波分解器行超声匀浆, 匀浆液以3000 r/min离心15 min, 收集上清液并参照大鼠IP3 ELISA试剂盒使用说明书测定.
1.2.4 测定胰腺腺泡细胞内钙(Ca2+): 参照FLUO-3、AM Ester试剂盒说明书、邓丕兰 et al[9]的方法, 将FLUO-3、AM Ester加入90 mL DMSO, 均分装为12管(暂未使用的放-80℃冰箱内保存), 取一管加入无钙PBS液1.5 mL, 配制成5 mmol/L液备用. 加以少量无钙PBS液, 用机械法剪碎胰腺组织, 用孔径500 mm的尼龙滤膜过滤后, 以无钙PBS 1 mL清洗, 3000 r/min离心10 min, 收集沉积物再洗涤、离心1次, 再将第2次沉积物用适量无钙PBS液稀释调整为单个腺泡细胞数目109/L悬液(用台盼蓝染色检查成活细胞在95%以上), 与荧光剂反应后用流式细胞仪测定.
1.2.5 检测血清TNF-α: 参照大鼠TNF-α ELISA试剂盒使用说明书测定.
1.2.6 测定血清淀粉酶(AMY)和血清钙(血钙): 用全自动生化分析仪测定.
1.2.7 胰腺组织病理学检查: 取相同部位胰腺组织用100 g/L中性甲醛液固定, 石蜡包埋, 连续5 mm切片后行HE染色, 光镜下观察, 参照Kusske 标准[10]进行评分. 统计学处理 数据以mean±SD表示, 用SPSS15.0统计软件处理. 各组样本均数间比较采用t检验. 胰腺组织IP3与Ca2+、TNF-α及血钙水平之间进行直线相关分析. P<0.05表示有显著性差异.
C组动物复苏后一般情况良好, 活动, 反应敏捷, 可进饮, 无精神萎靡等现象. SAP组动物精神萎靡、蜷曲、不活动、不进饮.
SAP组的胰腺细胞内IP3、Ca2+和TNF-α显著高于C组(P<0.05, 表1).
SAP组血清的AMY显著高于C组(5336.1±1937.83 vs 783.5±200.07, P<0.05), 而血钙显著低于C组(2.51±0.11 vs 3.04±0.15, P<0.05).
胰腺细胞内IP3与Ca2+和血清TNF-α间、Ca2+与TNF-α间呈明显正相关(r = 0.987、0.937, 0.976, P<0.05); 而上述三者与血钙呈显著负相关(P<0.05), IP3与血钙间r为-0.997, Ca2+和血钙间r为-0.980; TNF-α与血钙间r为-0.915(图1).
C组大鼠的腹腔内无明显腹水, 胃肠无显著扩张, 胰腺及胰周围无明显改变. SAP组大鼠的腹腔内有大量血性腹水, 胃肠显著扩张, 胰腺大片出血、坏死, 大量中性粒细胞浸润和小叶出血, 胰腺表面、大网膜、肠系膜等可见大量皂化斑. 胰腺病理评分SAP组(11.1±0.88)显著高于C组(6.4±1.07, P<0.05).
研究表明, 乙酰胆硷、缩胆囊素等各种刺激因子与胰腺腺泡细胞膜上特异性受体结合, 可活化受体耦联的G蛋白(Gp), 激活磷脂酶C(PLC),进而特异性的催化细胞膜表面的磷脂酰肌醇4, 5-二磷酸(PIP2), 生成IP3. IP3生成后, 从膜上扩散至胞质中并与内质网上的受体(实际上是Ca2+通道)结合, 使IP3操纵的钙通道活化、大量开放, 大量Ca2+从钙库内迅速释放, 造成胞质内Ca2+浓度急剧升高[11]. 胞质内Ca2+又可作为细胞内第二信使, 激活钙库膜上的受体, 使钙库排钙, 出现"钙诱发的钙释放"(calcium induced calcium release, CICR)现象[12-13]. 即随着钙库钙的释放, 继而细胞膜上操纵Ca2+通道的开放, 引起充电式Ca2+内流, 促进细胞外Ca2+向细胞内转移[12,14-16]. 因此, IP3是细胞内钙信号相关的第2信使, 其与相应受体结合可以调控细胞内钙释放. AP时存在细胞内钙超载[4], 但是AP时胰腺细胞内IP3有何变化未见报道. 本研究发现, SAP时胰腺细胞内IP3明显高于对照组, 相应地细胞内钙亦显著高于对照组, 呈明显正相关(r = 0.987), 而血钙却明显降低, 表现为负相关(r = -0.997), 由此提示SAP时存在胰腺细胞内IP3的异常升高, 从而导致钙代谢异常, 即细胞内钙释放致细胞内钙上升, 细胞外钙向细胞内转移致细胞外钙下降; SAP时出现的钙超载其重要原因之一可能是细胞内IP3出现异常所致. 较多研究指出, AP发生后, 炎症早期单核巨噬细胞、中性粒细胞和炎症部位产生过量TNF-α, 一方面其可引起胰腺细胞坏死, 另一方面其迅速进入血液循环, 不仅自身激活, 而且促进其他细胞因子的产生, 引起细胞因子级联反应, 导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)[17-18]. AP时存在细胞内钙超载[4], 临床使用钙拮抗剂异搏定治疗AP, 可使血清TNF-α明显降低[19], 提示钙超载与TNF-α有关. 本研究结果显示, SAP组血清TNF-α水平显著高于对照组, 并与细胞内IP3和Ca2+水平呈正相关(r分别为0.937和0.976), 相应地SAP组的胰腺病理评分也明显高于对照组, 说明TNF-α增高的重要原因之一与细胞内IP3诱发的细胞内钙超载相关.
重型急性胰腺炎(SAP)发展迅速, 并发症多, 死亡率高. 目前研究发现, SAP死亡的主要时期是早期和感染期, 主要原因是由SAP及其感染诱发的细胞因子瀑布样释放导致的重要器官损伤以至衰竭. 观察发现, SAP时存在钙超载, 钙超载可激活核因子-κB及相关的炎症因子, 引起胰腺坏死, 同时血钙明显下降.
沈柏用, 副教授, 上海交通大学医学院附属瑞金医院肝胆胰外科中心
1, 4, 5三磷酸肌醇(IP3)是细胞内的第二信使, 对细胞内钙调控起着重要的作用. 但是在SAP时IP3有何变化、IP3与细胞内钙升高(钙超载)及细胞外钙下降的关系, 尚不清楚.
本研究通过建立SAP模型, 观察SAP时胰腺细胞内IP3的变化及其与钙代谢的关系, 从细胞信息通路方面探讨SAP的发病机制.
本研究选题符合该领域的研究热点, 设计科学、合理, 作者掌握了相关的实验基础理论和专门实验技术, 统计处理符合统计学方法, 结论可靠, 但讨论不够深入.
编辑: 李军亮 电编:何基才
| 1. | Winslet M, Hall C, London NJ, Neoptolemos JP. Relation of diagnostic serum amylase levels to aetiology and severity of acute pancreatitis. Gut. 1992;33:982-986. [PubMed] [DOI] |
| 4. | Kim JY, Kim KH, Lee JA, Namkung W, Sun AQ, Ananthanarayanan M, Suchy FJ, Shin DM, Muallem S, Lee MG. Transporter-mediated bile acid uptake causes Ca2+-dependent cell death in rat pancreatic acinar cells. Gastroenterology. 2002;122:1941-1953. [PubMed] [DOI] |
| 5. | Petersen OH, Sutton R. Ca2+ signalling and pancreatitis: effects of alcohol, bile and coffee. Trends Pharmacol Sci. 2006;27:113-120. [PubMed] [DOI] |
| 6. | 刘 景生. 细胞信息与调控. 第1版. 北京: 北京医科大学中国协和医科大学联合出版社 1999; 183-184. |
| 7. | Aho HJ, Nevalainen TJ. Experimental pancreatitis in the rat. Ultrastructure of sodium taurocholate-induced pancreatic lesions. Scand J Gastroenterol. 1980;15:417-424. [PubMed] |
| 10. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] [DOI] |
| 11. | 查 锡良. 医学分子生物学. 第1版. 北京: 人民卫生出版社 2003; 417-418. |
| 12. | Putney JW Jr, Broad LM, Braun FJ, Lievremont JP, Bird GS. Mechanisms of capacitative calcium entry. J Cell Sci. 2001;114:2223-2229. [PubMed] |
| 14. | Tribe RM, Moriarty P, Dalrymple A, Hassoni AA, Poston L. Interleukin-1beta induces calcium transients and enhances basal and store operated calcium entry in human myometrial smooth muscle. Biol Reprod. 2003;68:1842-1849. [PubMed] [DOI] |
| 15. | Terry CM, Clikeman JA, Hoidal JR, Callahan KS. TNF-alpha and IL-1alpha induce heme oxygenase-1 via protein kinase C, Ca2+, and phospholipase A2 in endothelial cells. Am J Physiol. 1999;276:H1493-H1501. [PubMed] |
| 16. | Spörri B, Müller KM, Wiesmann U, Bickel M. Soluble IL-6 receptor induces calcium flux and selectively modulates chemokine expression in human dermal fibroblasts. Int Immunol. 1999;11:1053-1058. [PubMed] [DOI] |
| 17. | Kingsnorth A. Role of cytokines and their inhibitors in acute pancreatitis. Gut. 1997;40:1-4. [PubMed] |
| 18. | Sakorafas GH, Tsiotou AG. Etiology and pathogenesis of acute pancreatitis: current concepts. J Clin Gastroenterol. 2000;30:343-356. [PubMed] [DOI] |
| 19. | 蒲 青凡, 严 律南, 孙 碎康, 郁 树康, 潘 继豹, 王 俊, 李 荣祥, 潘 万能. 改善胰腺缺血和钙拮抗剂在急性重症胰腺炎 治疗中的保护作用. 中国普外基础与临床杂志. 2001;8:384-386. |