修回日期: 2009-01-13
接受日期: 2009-01-19
在线出版日期: 2009-02-28
目的: 探讨羟基喜树碱(HCPT)对体外培养的大鼠肝星状细胞(HSC)增殖的影响, 并观察其对大鼠正常肝细胞的毒性作用, 确定HCPT对大鼠肝星状细胞增殖抑制的最佳浓度.
方法: 大鼠肝星状细胞株(HSC-T6)和大鼠正常肝细胞株(BRL-3A)分别在实验组(分别以含HCPT 浓度为0.008, 0.016, 0.031, 0.063, 0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32 mg/L的培养液作用)及对照组(单纯培养)中体外培养24, 48, 72 h. 应用四甲基偶氮唑盐法(MTT法)检测细胞增殖情况, 找出对HSC-T6细胞增殖抑制作用最大的HCPT最佳浓度; 光镜下观察对照组和实验组HSC-T6细胞的形态学变化.
结果: 24, 48, 72 h实验组HSC-T6细胞的增殖率均低于对照组, 差异具有显著性(t = 6.07-46.98, 10.98-63.97, 20.76-107.68, 均P<0.01); HCPT对HSC-T6细胞和BRL-3A细胞的增殖抑制率均随着药物作用浓度的升高及药物作用时间的延长而逐渐升高; 当HCPT浓度>0.5 mg/L时, 对BRL-3A细胞的毒性作用显著性增高(均P<0.05); 0.25, 0.5, 1 mg/L的HCPT作用HSC-T6细胞24 h, 光镜下均可见细胞数量减少、体积缩小、核浓缩等变化, 且随着作用浓度的增加变化更加明显.
结论: HCPT在体外可以明显的抑制HSC-T6细胞的增殖, 作用强度呈剂量-时间依赖性; 0.5 mg/L为对HSC-T6细胞增殖抑制作用最大的HCPT最佳浓度.
引文著录: 邓群, 张一, 胡国信, 袁铿, 袁芳, 黄艳琴. 羟基喜树碱对大鼠肝星状细胞增殖抑制的最佳浓度. 世界华人消化杂志 2009; 17(6): 554-559
Revised: January 13, 2009
Accepted: January 19, 2009
Published online: February 28, 2009
AIM: To evaluate the effects of hydrocamptothecin (HCPT) on proliferation of rat hepatic stellate cells (HSC) in vitro, and meanwhile, to investigate the cytotoxicity of HCPT on rat hepatocytes, then to determine the optimum concentration of HCPT for inhibiting proliferation of rat HSC.
METHODS: Rat HSC line (HSC-T6) and rat hepatocyte line (BRL-3A) were incubated with different concentrations of HCPT (0.008, 0.016, 0.031, 0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32 mg/L respectively) or without HCPT for 24, 48, 72 hours, respectively. The proliferation rates of the HSC-T6 and BRL-3A were determined by MTT assay. The optimum concentration of HCPT with highest inhibitory action on proliferation of HSC-T6 was examined. The morphological changes of the HSC-T6 were observed with light microscopy.
RESULTS: MTT assay indicated that the proliferation rates of HSC-T6 induced with different concentrations of HCPT were significantly reduced compared with the control group incubated in vitro for 24, 48, 72 h (t = 6.07-46.98, 10.98-63.97, 20.76-107.68, all P < 0.01). HCPT significantly inhibited the proliferation of HSC-T6 in a dose-dependent and time-dependent manner. On the other hand, HCPT also inhibited the proliferation of BRL-3A in a dose-dependent and time-dependent manner. When the concentration was higher than 0.5 mg/L, the cytotoxicity of HCPT on the BRL-3A had a significant raise (all P < 0.05). After stimulation of HSC-T6 by HCPT with the concentrations of 0.25, 0.5, 1 mg/L for 24 hours, light microscopy showed the morphological changes of HSC-T6, including cells shrinkage, karyorrhexis and karyopycnosis, and the changes were more significant as the concentration increased.
CONCLUSION: HCPT could significantly inhibit the proliferation of HSC-T6 in a dose-dependent and time-dependent manner; 0.5 mg/L is the optimum concentration of HCPT for inhibiting the proliferation of HSC-T6.
- Citation: Deng Q, Zhang Y, Hu GX, Yuan K, Yuan F, Huang YQ. Optimum concentration of hydrocamptothecin for inhibiting proliferation of rat hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 554-559
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/554.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.554
喜树碱(camptothecin, CPT)是从我国特有的珙桐科植物喜树中提取的一种五环生物碱. CPT及其衍生物是目前临床上广泛使用的拓扑异构酶Ⅰ(TopoⅠ)抑制剂[1-3], 不仅具有抗癌作用[4-8], 而且对于许多造成相应组织器官纤维化的细胞, 如表皮细胞、成纤维细胞、角质细胞、内皮细胞等具有抑制增殖、诱导凋亡作用[9-15]. 但目前尚未见CPT对肝纤维化肝星状细胞影响的报道. 本实验通过观察CPT的一种衍生物-HCPT对体外培养的大鼠肝星状细胞株(HSC-T6)增殖的影响, 同时对照其对大鼠正常肝细胞株(BRL-3A)的毒性作用, 找出HCPT抑制大鼠肝星状细胞增殖的最佳浓度, 为临床肝纤维化的防治提供新方法, 为拓宽喜树碱的临床应用范围提供理论基础和实验依据.
肝星状细胞HSC-T6由上海中医药大学徐列明教授提供, 系SV40转染的大鼠HSC, 具有活化HSC的表型[16]. 正常肝细胞BRL-3A购自中科院上海细胞生物研究所. 羟基喜树碱购自深圳万乐药业有限公司; 高糖DMEM培养基购自美国Gibco公司; 胎牛血清购自杭州四季青公司; 四甲基偶氮唑盐(MTT)及二甲基亚砜均购自北京Solavbia公司. 二氧化碳培养箱(FORMA SCIENTIFIC, USA), XSD-D2倒置显微镜(重庆光学仪器厂), 652-酶标仪(Labststems, 芬兰).
1.2.1 羟基喜树碱贮存液的配制: 用生理盐水溶解羟基喜树碱晶体并稀释其浓度为1 g/L的贮存液, 分装, -20℃保存, 使用时用含100 mL/L胎牛血清的高糖DMEM培养液稀释至所需浓度.
1.2.2 细胞培养: 采用含有100 mL/L胎牛血清的高糖DMEM培养液, 在37℃, 50 mL/L CO2培养箱中培养.
1.2.3 分组: 对照组为单纯HSC-T6及BRL-3A细胞培养, 实验组为分别以含HCPT浓度为0.008, 0.016, 0.031, 0.063, 0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32 mg/L的培养液作用的HSC-T6及BRL-3A细胞.
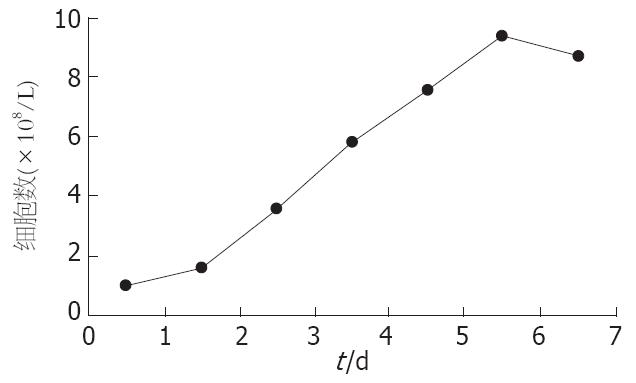
1.2.4 绘制HSC-T6细胞生长曲线: 用含100 mL/L胎牛血清的高糖DMEM培养液稀释HSC-T6细胞悬液至1×108/L, 接种细胞于24孔培养板中, 每孔1 mL, 放入培养箱中孵育, 24 h后取3孔进行计数, 在48 h和72 h重复上述操作, 72 h后换液, 每日观察计数, 连续观察5-7 d. 以时间(d)为横坐标, 细胞数(×108/L)为纵坐标绘制生长曲线.
1.2.5 细胞毒性实验(MTT法): 取对数生长期细胞, 调整细胞密度为5×107/L, 接种细胞于96孔培养板中, 细胞同步化后孵育24、48、72 h, 分别加MTT, 再孵育4 h, 加入二甲基亚砜, 酶标仪492 nm波长处检测各孔的吸光度(A值), 每种浓度3个复孔, 实验重复4次. 结果以mean±SD表示, 并计算出生长抑制率. 生长抑制率 = [(对照组A值-实验组A值)/对照组A值]×100%. 找出HCPT的最佳作用浓度.
1.2.6 形态学观察: 将HSC-T6细胞接种至6孔板内, 待细胞贴壁后吸弃原培养液, 再分别加入0.25, 0.5, 1 mg/L浓度的HCPT培养液, 对照组加入新鲜培养液, 继续培养24 h后, 光镜下观察细胞形态.
统计学处理 对所得数据用SPSS13.0软件进行相关分析, 计量资料数据以mean±SD表示; 多个样本的比较采用单因素方差分析, 两样本均数比较采用t检验, P<0.05为差异有显著性.
在接种的第1个24 h, 细胞经历一个适应期, 为生长潜伏期, 24 h后细胞进入对数生长期, 细胞数量迅速增加, 持续约5 d, 此后细胞进入平台期, 细胞数量开始下降(图1).
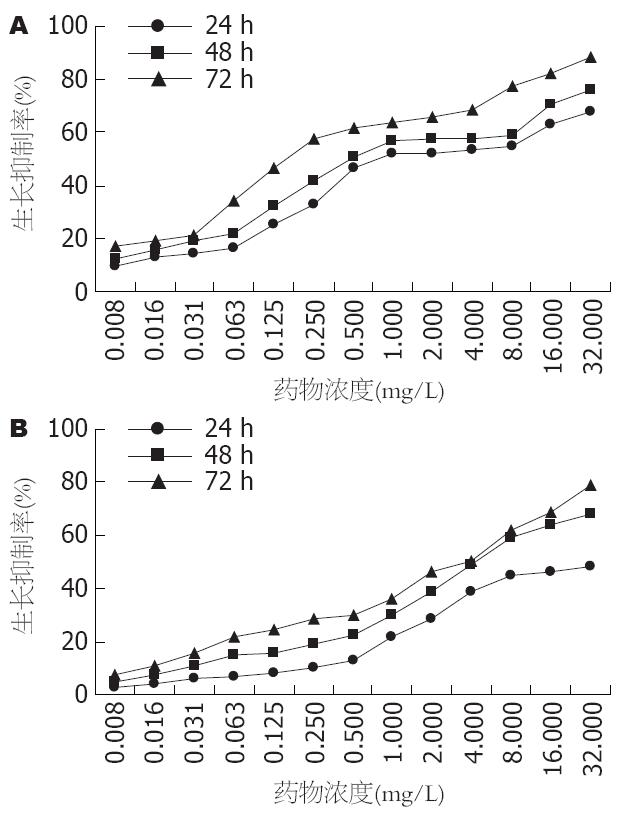
2.2.1 HCPT对HSC-T6细胞增殖的影响: 各浓度的HCPT作用HSC-T6细胞, 实验组HSC-T6细胞的增殖率均低于对照组, 差异具有显著性(24 h, 48 h, 72 h的t值分别为6.07-46.98 vs 10.98-63.97 vs 20.76-107.68, 均P<0.01, 表1, 图2A). 随着药物浓度的升高, HCPT对HSC-T6细胞的增殖抑制率逐渐升高; 随着药物作用时间的延长, 各浓度的HCPT对HSC-T6细胞的增殖抑制率逐渐增加. 当HCPT作用24 h及48 h时, 随着药物浓度的增加(0.125-1 mg/L), 细胞增殖抑制率显著性增高(F = 153.38, P<0.01 vs F = 171.37, P<0.01); 当药物浓度达到2-8 mg/L时, 抑制率不再显著性增加(F = 1.80, P = 0.244 vs F = 1.02, P = 0.414); 而当药物浓度≥16 mg/L时, 与8 mg/L组比较, 抑制率又显著增高(均P<0.05); 当HCPT作用72 h时, 仅在药物浓度为1-2 mg/L时, 出现抑制率不再显著性增加的平台期(P>0.05). HCPT分别作用HSC-T6细胞24 h, 48 h, 72 h时的IC50约为: 0.791, 0.461, 0.153 mg/L.
| HCPT(mg/L) | 24 h | 48 h | 72 h |
| 对照组 | 0.702±0.014 | 0.894±0.013 | 1.285±0.012 |
| 0.008 | 0.635±0.013b | 0.786±0.011b | 1.064±0.014b |
| 0.016 | 0.613±0.016b | 0.754±0.014b | 1.037±0.011b |
| 0.031 | 0.601±0.015b | 0.725±0.013b | 1.012±0.014b |
| 0.063 | 0.586±0.010b | 0.696±0.013b | 0.847±0.012b |
| 0.125 | 0.526±0.012b | 0.609±0.011b | 0.683±0.013b |
| 0.25 | 0.469±0.012b | 0.520±0.013b | 0.549±0.014b |
| 0.5 | 0.338±0.012b | 0.439±0.014b | 0.489±0.014b |
| 1 | 0.345±0.010b | 0.388±0.016b | 0.465±0.012b |
| 2 | 0.336±0.007b | 0.381±0.012b | 0.444±0.014b |
| 4 | 0.327±0.013b | 0.377±0.013b | 0.404±0.011b |
| 8 | 0.319±0.012b | 0.367±0.012b | 0.294±0.012b |
| 16 | 0.264±0.014b | 0.266±0.012b | 0.230±0.012b |
| 32 | 0.219±0.011b | 0.215±0.013b | 0.154±0.014b |
2.2.2 HCPT对BRL-3A细胞的毒性作用: 各浓度的HCPT对BRL-3A细胞亦有一定的增殖抑制作用, 且随着药物作用浓度的升高及作用时间的延长, 增殖抑制率逐渐升高(图2B). 低浓度的HCPT(浓度≤0.5 mg/L)作用时毒性作用较低(24 h, 48 h, 72 h的增殖抑制率均<30%). 当HCPT浓度>0.5 mg/L时, 对BRL-3A细胞的增殖抑制作用显著性增高. 取与0.5 mg/L浓度组相邻的两个浓度组进行观察比较(表2), 结果显示0.5 mg/L浓度组与1 mg/L浓度组比较差异有显著性(P<0.05), 而与0.25 mg/L浓度组比较差异无显著性.
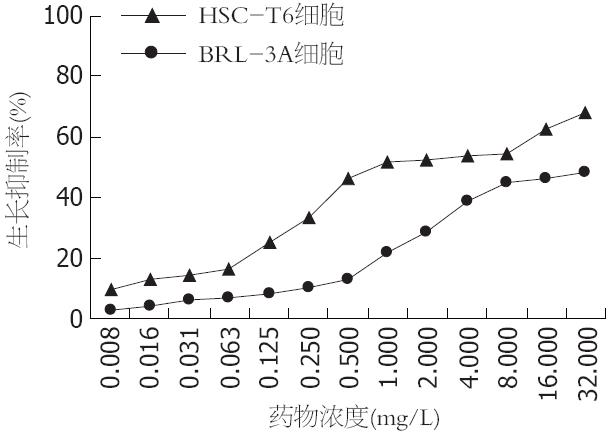
2.2.3 HCPT的最佳作用浓度: 通过参照HCPT对BRL-3A细胞的影响, 0.5 mg/L为对HSC-T6细胞增殖抑制作用最大的HCPT最佳浓度(图3).
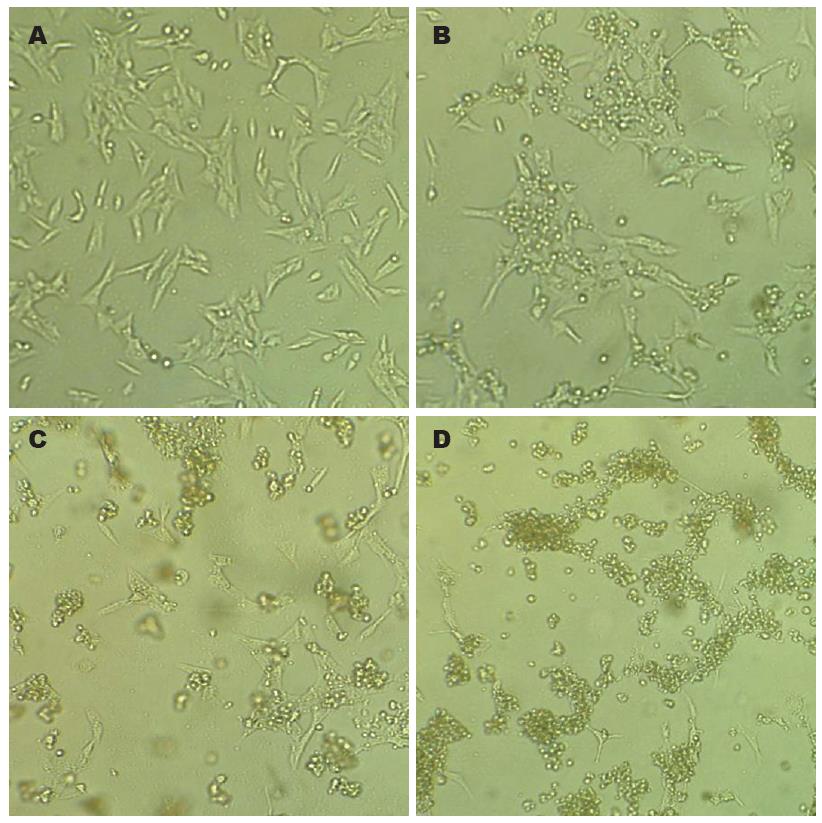
对照组HSC-T6细胞散在分布, 细胞均贴壁生长, 呈星形或梭形, 细胞质均匀而透明, 胞体近中央处可见圆形或椭圆形的胞核(图4A); 0.25 mg/L浓度组HSC-T6细胞数量较对照组有所减少, 部分细胞聚集成团, 细胞缩小、变圆(图4B); 0.5 mg/L浓度组HSC-T6细胞数量较对照组明显减少, 细胞核浓缩, 多数细胞呈卵圆形或圆形, 但仍有部分贴壁生长的成纤维样细胞, 并可见漂浮的细胞碎片(图4C); 1 mg/L浓度组HSC-T6细胞数量与0.5 mg/L浓度组相似, 大部分细胞为卵圆形或圆形, 并聚集成团, 漂浮的细胞碎片进一步增多(图4D).
肝纤维化是肝脏对各种原因所致肝损伤的"创伤愈合"反应, 也是肝硬化发生的前奏和必经的中间环节, 其主要病理改变是细胞外基质的过度合成和异常沉积[17-21]. HSC是肝脏中兼有肌细胞、成纤维细胞及脂肪细胞性质的一种间质细胞, 是肝纤维化时细胞外基质的主要来源细胞[18-19], HSC的活化、增殖在肝纤维化的发生发展中起核心作用[22-24]. 近年来, 随着"肝纤维化可逆转"理论得到公认, 以HSC为靶点来研发抗肝纤维化药物成为目前肝病治疗领域的热点. 喜树碱类药物作为TopoⅠ抑制剂, 主要通过诱导细胞凋亡、影响细胞内信号通路和细胞周期等机制发挥抗肿瘤、抑制细胞增殖的作用[27-30]. HCPT是CPT的众多衍生物中的一种, 是CPT的A环第10位上-H被-OH取代而成, 具有水溶性好, 毒副作用较小等优点.
本实验结果显示各浓度的HCPT均可抑制HSC-T6细胞的增殖, 且作用强度呈剂量-时间依赖性, 与国内刘晓明、廖立新 et al采用相同浓度的CPT、HCPT抑制人永生化表皮细胞(HaCaT)、人脐静脉内皮细胞(ECV304)及病理性瘢痕成纤维细胞等细胞增殖的实验结果相似[9-11]. 值得注意的是, 单纯培养的HSC-T6细胞生长曲线中, 细胞增殖呈S形曲线, 24 h始至72 h均为其生长旺盛时期, 直至细胞生长至第6-7天时才出现细胞数量下降, 表明细胞逐渐进入平台期至衰亡期, 推测其原因可能是由于培养板提供的细胞生长空间有限, 细胞不能在培养孔内无限增殖, 导致细胞增殖受到抑制所致. 而在HCPT分别作用24 h, 48 h, 72 h时, 均出现一段抑制率无显著性增加的平台期, 可能由于药物对HSC-T6细胞的增殖抑制作用与HSC-T6自身的生长增殖达到一个平衡, 使平台期提前出现所致. 当HCPT浓度超过一定范围(≥16 mg/L)时, 对HSC-T6细胞的抑制作用显著性增加, 主要为非特异性细胞毒性作用.
HCPT作为临床上广泛使用的抗肿瘤药物, 在抑制肿瘤细胞及成纤维细胞增殖的同时, 也可能对正常组织器官尤其是对肝脏产生一定的毒性作用. 因此, 用HCPT干预HSC-T6细胞的同时, 也必须考虑到其可能存在的肝细胞毒性, 但纵观国内外有关中草药治疗肝纤维化、作用于肝星状细胞的文献, 尚未检索到通过体外实验直接比较相同条件下药物对两种细胞(肝星状细胞和正常肝细胞)的毒性作用, 从而确定药物最佳浓度(对肝星状细胞增殖抑制作用最大, 同时对正常肝细胞毒性作用最小的浓度)的报道. 本实验选取相同条件下HCPT对体外培养的大鼠正常肝细胞株BRL-3A细胞的毒性作用作为参照, 结果显示, 当HCPT作用24 h, 浓度为0.5 mg/L时, 对HSC-T6细胞的增殖抑制率约为50%, 而对BRL-3A细胞的增殖抑制率<15%; 当HCPT浓度>0.5 mg/L时, BRL-3A细胞的抑制率曲线陡峭上升, 提示抑制率显著性升高, 而HSC-T6细胞的抑制率曲线较平缓, 提示增殖抑制率无显著性升高. 综合HCPT对两种细胞的作用, 确定0.5 mg/L为对HSC-T6细胞增殖抑制作用最大的HCPT最佳浓度. 同时, 通过光镜下观察HSC-T6细胞的形态学变化, 实验组细胞出现细胞数量明显减少, 细胞体积缩小、核浓缩等变化, 且随着作用浓度的增加, 上述改变愈加显著. 因此我们推测HCPT抑制HSC-T6细胞增殖的同时, 可能诱导了其凋亡, 但需要进一步的研究.
总之, 本实验确定HCPT对HSC-T6细胞增殖抑制的最佳浓度, 为下一步研究HCPT对大鼠肝星状细胞生物学特性的调控奠定了实验基础.
肝纤维化是各种慢性肝病发展至肝硬化的必经阶段, 但目前仍缺乏有效的治疗手段. 积极研究开发新的抗肝纤维化药物, 以阻断和逆转肝纤维化的发生和发展, 对慢性肝病的治疗具有十分重要的意义. 喜树碱是从我国特有的珙桐科植物喜树中提取的一种五环生物碱, 喜树碱类药物对于许多造成组织器官纤维化的细胞, 如表皮细胞、成纤维细胞、角质细胞等均具有抑制其增殖、诱导凋亡作用, 但目前国内外尚未见喜树碱对肝纤维化肝星状细胞作用的文献报道.
于聪慧, 教授, 中国人民解放军北京军区总医院肝胆外科
肝星状细胞的活化、增殖在肝纤维化的发生发展中起核心作用, 以肝星状细胞为靶点来研发抗肝纤维化药物成为目前肝病治疗领域的热点. 中医中药是我国原创的优势学科, 应用中医药进行抗肝纤维化的研究具有很大的发展前景和优势.
林熙然 et al先后用喜树碱作用于人类角朊细胞、人永生化表皮细胞, 结果显示一定浓度的喜树碱能抑制上述细胞的增殖、诱导分化及凋亡. 毕燕龙 et al在研究喜树碱对兔结膜成纤维细胞(FB)的影响时发现, 无论是体内还是体外实验, 喜树碱均具有抑制FB增殖、诱导凋亡的作用.
本文在国内外首次观察了羟基喜树碱对体外培养的大鼠肝星状细胞和大鼠正常肝细胞的抑制作用及毒性反应, 探讨了羟基喜树碱对大鼠肝星状细胞增殖抑制的最佳浓度.
羟基喜树碱在体外可以明显的抑制大鼠肝星状细胞的增殖, 0.5mg/L为羟基喜树碱对大鼠肝星状细胞增殖抑制的最佳浓度, 为下一步研究羟基喜树碱对大鼠肝星状细胞生物学特性的调控奠定了实验基础.
本研究通过羟基喜树碱对体外培养的大鼠肝星状细胞增殖的影响找出HCPT抑制大鼠肝星状细胞增殖的最佳浓度和毒性作用, 为喜树碱的临床应用范围提供理论基础和实验依据.
编辑: 史景红 电编:何基才
| 1. | Hsiang YH, Hertzberg R, Hecht S, Liu LF. Camptothecin induces protein-linked DNA breaks via mammalian DNA to poisomerase I. J Biol Chem. 1985;260:14873-14878. [PubMed] |
| 2. | Hsiang YH, Liu LF. Identification of mammalian DNA topoisomerase I as an intracellular target of the anticancer drug camptothecin. Cancer Res. 1988;48:1722-1726. [PubMed] |
| 3. | Dexheimer TS, Pommier Y. DNA cleavage assay for the identification of topoisomerase I inhibitors. Nat Protoc. 2008;3:1736-1750. [PubMed] [DOI] |
| 4. | Seo MD, Lee KW, Lim JH, Yi HG, Kim DY, Oh DY, Kim JH, Im SA, Kim TY, Lee JS. Irinotecan combined with 5-fluorouracil and leucovorin as second-line chemotherapy for metastatic or relapsed gastric cancer. Jpn J Clin Oncol. 2008;38:589-595. [PubMed] [DOI] |
| 5. | Yao Y, Zhao H, Sun Y, Lin F, Tang L, Chen P. Combined chemotherapy of hydroxycampothecin with oxaliplatin as an adjuvant treatment for human colorectal cancer. Tohoku J Exp Med. 2008;215:267-278. [PubMed] [DOI] |
| 6. | Yu ZJ, Yu JW, Cai W, Yuan HX, Li XY, Yuan Y, Chen JP, Wu XY, Yao DF. Evaluation of HCPTd1, d14-double passaged intervening chemotherapy protocol for hepatocellular carcinoma. World J Gastroenterol. 2005;11:5221-5225. [PubMed] |
| 7. | O'Brien M, Eckardt J, Ramlau R. Recent advances with topotecan in the treatment of lung cancer. Oncologist. 2007;12:1194-1204. [PubMed] [DOI] |
| 8. | Ayhan A, Taskiran C, Yigit-Celik N, Gultekin M, Tuncer S, Guler N, Yuce K. Topotecan as a second-line therapy in patients with ovarian and primary peritoneal cancer: initial response and long-term follow-up. Eur J Gynaecol Oncol. 2006;27:603-606. [PubMed] |
| 16. | Vogel S, Piantedosi R, Frank J, Lalazar A, Rockey DC, Friedman SL, Blaner WS. An immortalized rat liver stellate cell line (HSC-T6): a new cell model for the study of retinoid metabolism in vitro. J Lipid Res. 2000;41:882-893. [PubMed] |
| 20. | Nie QH, Zhang YF, Xie YM, Luo XD, Shao B, Li J, Zhou YX. Correlation between TIMP-1 expression and liver fibrosis in two rat liver fibrosis models. World J Gastroenterol. 2006;12:3044-3049. [PubMed] |
| 21. | Das SK, Vasudevan DM. Genesis of hepatic fibrosis and its biochemical markers. Scand J Clin Lab Invest. 2008;68:260-269. [PubMed] [DOI] |
| 22. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] |
| 23. | Gutiérrez-Ruiz MC, Gómez-Quiroz LE. Liver fibrosis: searching for cell model answers. Liver Int. 2007;27:434-439. [PubMed] [DOI] |
| 24. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Cao YZ. Inhibiting effect of antisense oligonucleotides phosphorthioate on gene expression of TIMP-1 in rat liver fibrosis. World J Gastroenterol. 2001;7:363-369. [PubMed] |
| 25. | Okazaki I, Watanabe T, Hozawa S, Niioka M, Arai M, Maruyama K. Reversibility of hepatic fibrosis: from the first report of collagenase in the liver to the possibility of gene therapy for recovery. Keio J Med. 2001;50:58-65. [PubMed] |
| 26. | Safadi R, Friedman SL. Hepatic fibrosis--role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 27. | Shao RG, Cao CX, Nieves-Neira W, Dimanche-Boitrel MT, Solary E, Pommier Y. Activation of the Fas pathway independently of Fas ligand during apoptosis induced by camptothecin in p53 mutant human colon carcinoma cells. Oncogene. 2001;20:1852-1859. [PubMed] [DOI] |