修回日期: 2009-01-20
接受日期: 2009-02-09
在线出版日期: 2009-02-28
目的: 探讨一氧化氮(NO)、诱导型一氧化氮合酶(iNOS)及PAF受体拮抗剂在内毒素(LPS)腹腔注射诱导的幼年大鼠急性胃黏膜损伤中的作用.
方法: Wistar大鼠, 随机分为对照组、LPS组、PAF受体拮抗剂预防组和治疗组. 用内毒素(O55:B5脂多糖)5 mg/kg ip制备幼年大鼠内毒素血症模型. 预防组和治疗组分别于内毒素ip前及ip后0.5 h, 应用血小板活化因子(PAF)受体拮抗剂BN52021(GinkgolideB)5 mg/kg ip, 同等量生理盐水ip为对照组. 于LPS注射后1.5, 3, 6, 24, 48, 72 h处死动物, 大体及光学显微镜下观察胃黏膜损伤情况, 采用硝酸还原酶的化学比色法测定胃黏膜NO含量; 免疫组织化学S-P方法测定胃黏膜iNOS蛋白的表达, 半定量RT-PCR法测定胃黏膜iNOS mRNA的表达.
结果: LPS组6 h胃黏膜损伤最重, 黏膜内有出血, 核碎裂、固缩, 凋亡小体出现; 预防组和治疗组改变轻微. LPS组腹腔注射内毒素后6 h胃黏膜NO含量最高, 此时LPS组较对照组NO含量明显增高(84.37±5.44 vs 37.37±1.90, P<0.01), 预防组和治疗组(40.07±3.42, 48.63±3.24)较LPS组明显降低(P<0.01); 预防组与治疗组较对照组明显增高(P<0.05). 对照组胃黏膜组织未见iNOS蛋白及mRNA的表达; LPS组腹腔注射内毒素后1.5 h胃黏膜组织胞质iNOS蛋白表达, 6 h明显增高, 24 h最高, 48 h下降, 72 h仍未恢复正常; 预防组和治疗组3 h iNOS蛋白表达, 6 h明显增高, 48 h下降, 72 h同对照组. iNOS mRNA水平的表达变化与iNOS 蛋白表达变化趋势相同.
结论: PAF受体拮抗剂可下调iNOS mRNA表达水平, 减少iNOS蛋白表达, 使NO含量下降. 从而使NO和iNOS对胃黏膜发挥保护作用.
引文著录: 刘春英, 李薇, 唐英, 王丽杰, 孙梅. PAF受体拮抗剂对内毒素血症幼年大鼠胃黏膜NO含量及iNOS表达的影响. 世界华人消化杂志 2009; 17(6): 544-548
Revised: January 20, 2009
Accepted: February 9, 2009
Published online: February 28, 2009
AIM: To investigate the protective effect of NO, iNOS and PAF antagonist in endotoxin-induced acute gastric mucosal injury in young rats.
METHODS: Eighteen-day old Wistar rats were randomly divided into normal control, model group, platelet activating factor (PAF) antagonist prevention group and treatment group. The model of endotoxemia of young rats was established by intraperitoneal injection of endotoxin (5 mg/kg of O55:B5 lipopolysaccharide, LPS ). The rats in PAF prevention and treatment groups were administered with PAF antagonist BN52021 (GinkgolideB 5 mg/kg) 0.5 h before and after modeling. The rats in control group received intraperitoneal injection saline (1 mL/kg). The animals were killed 1.5, 3, 6, 24, 48, and 72 h after intraperitoneal injection of endotoxin. The pathologic changes of gastric mucosal were observed by hematoxylin-eosin (HE) staining. The content of NO was measured by chemical colorimetry using nitric acid reductase, the expressions of iNOS were measured by immunohistochemistry SP method and the expressions of iNOS mRNA were measured by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: The pathologic changes of gastric mucosal were significant at 6 h after intraperitoneal injection of endotoxin in LPS group. Erosion, bleeding and necrosis of gastric mucosal were observed. Swollen epithelial cells and developed degeneration were also observed. However, all the above changes were significantly alleviated in prevention group and treatment group. The NO content of gastric mucosa was highest at 6 h after injecting endotoxin in LPS group and the difference was significant between LPS group and control group (84.37 ± 5.44 vs 37.37 ± 1.90, P < 0.01), the difference was significant among PAF antagonist prevention group, treatment group (40.07 ± 3.42, 48.63 ± 3.24) and LPS group (P < 0.01), and the difference was significant among PAF antagonist prevention group, treatment group and control group (P < 0.05). No expression of iNOS protein or mRNA was seen in gastric mucosal tissues of control group. Cytoplasm iNOS protein of gastric mucosal tissue was expressed 1.5 h after injection of endotoxin in LPS group. iNOS protein expression was significantly increased at 6 h, reached the highest at 24 h, and began to decrease at 48 h and didn't restore to normal at 72 h. iNOS protein was expressed at 3 h in PAF antagonist prevention group and treatment group, which was obviously increased at 6 h, decreased at 48 h and didn't restore to normal at 72 h.
CONCLUSION: PAF antagonist can decrease the expression level of iNOS, decrease NO content and alleviate acute gastric mucosal injury and help the healing of gastric mucosal injury.
- Citation: Liu CY, Li W, Tang Y, Wang LJ, Sun M. Effect of PAF antagonist on NO content and expression of iNOS in gastric mucosal during endotoxemia in young rats. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 544-548
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/544.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.544
重症感染是急性胃黏膜损伤的常见原因之一[1]. 急性胃黏膜损伤发生机制是由于胃黏膜保护机制削弱, 损伤因素相对增强所致[2]. 近年研究发现一氧化氮(NO)、诱导型一氧化氮合酶(iNOS)在胃黏膜损伤和修复方面发挥重要作用[3]. 我们通过给幼年大鼠ip内毒素(lipopolysaccharide, LPS), 在内毒素血症时观察幼年大鼠急性胃黏膜损伤, 探讨在急性胃黏膜损伤和修复过程中, 以及应用血小板活化因子(platelet activating factor, PAF)受体拮抗剂后胃黏膜NO含量、iNOS表达变化, 研究NO、iNOS在胃黏膜损伤和修复方面的作用.
健康18日龄Wistar大鼠, 平均体质量32.37±6.32 g, 与母鼠共同饲养(由中国医科大学第二临床学院实验动物中心提供). 内毒素O55:B5脂多糖为美国Sigma公司产品, PAF受体拮抗剂BN52021GinkgolideB为美国Sigma公司产品. NO试剂盒购于南京建成生物工程研究所. iNOS免疫组化试剂盒由北京中山生物工程有限公司提供. 总RNA提取系统试剂由河南华美生物工程公司提供. iNOS、内参照β-actin引物由上海生工生物工程技术公司合成, TaKaRa试剂盒由大连宝生物工程有限公司提供.
1.2.1 分组及给药: 随机分为对照组、LPS组、PAF受体拮抗剂预防组和治疗组四组, 每组每一时相点(1.5, 3, 6, 24, 48, 72 h)各8只. 对照组仅生理盐水1 mL/kg ip; LPS组内毒素(O55:B5脂多糖)5 mg/kg ip, 配比浓度5 g/L, 用生理盐水溶解. PAF受体拮抗剂预防组于内毒素ip前0.5 h、治疗组于内毒素ip后0.5 h给予PAF受体拮抗剂BN52021(GinkgolideB)5 mg/kg ip, 配比浓度5 g/L. 用药后各组均放回鼠笼, 继续哺乳. 分别于内毒素ip后1.5, 3, 6, 24, 48, 72 h处死动物, 迅速开腹取胃, 沿胃大弯剪开, 大体观察胃黏膜损伤情况, 在腺胃区胃大弯处取0.5 cm×0.5 cm胃组织置入40 g/L甲醛溶液中固定, 其余部分用生理盐水冲洗3次, 置入去RNA酶试管中, 深低温冰箱-70℃保存.
1.2.2 胃黏膜NO含量检测: 取低温保存腺胃区黏膜100 mg, 制成100 g/L匀浆, 离心, 取上清液, 采用硝酸还原酶的化学比色法测定胃黏膜NO含量, 按试剂盒说明进行操作.
1.2.3 免疫组织化学技术检测胃黏膜iNOS蛋白的表达: 胃组织于40 g/L甲醛溶液中固定, 包埋, 石蜡切片. 免疫组化应用SP法测定iNOS, 按常规SP法操作步骤进行. 抗体的工作浓度为: 兔抗鼠-iNOS IgG抗体稀释比例为1∶200. 光镜下细胞质中有棕褐色颗粒者为iNOS阳性表达, 以PBS代替一抗作为阴性对照. 每个时间点选取染色清晰的切片5-6张, 于光镜下(×40)随机选取2-3个视野, 应用Olympus-BX41图像采集系统, Meta Morph/Dp10/BX41软件分析系统测定平均光密度值(optical density average).
1.2.4 RT-PCR检测胃黏膜iNOS mRNA的表达: TRIzol裂解待测的胃黏膜组织, 用酚-氯仿抽提总RNA, 逆转录合成cDNA后进行PCR扩增, 反应总体积25 µL, PCR扩增引物由本实验室参照美国国立图书馆PubMed基因库中电脑软件Primer 5.0版自行设计. iNOS引物序列为: 上游: 5'-CTACCTACCTGGGGAACACCTGGGG-3', 下游: 5'-GGAGGAGCTGATGGAGTAGTAGCGG-3'. β-actin引物序列为: 上游: 5'-CACCCTGTGCTGCTCACCGAGGCC-3', 下游: 5'-CCACACAGATGACTTGCGCTCAGG-3'. iNOS反应条件: 94℃变性5 min, 然后进行PCR反应共35次循环: 94℃变性30 s, 59℃退火30 s, 72℃延伸30 s, 最后72℃延伸5 min终止反应, 产物418 bp. β-actin反应条件: 94℃变性3 min, 55℃退火30 s, 72℃延伸30 s, 扩增35个循环, 最后60℃延伸10 min终止反应, 产物690 bp. PCR扩增后, 取PCR反应产物10 µL加入2 g/L琼脂糖凝胶中电泳, 应用计算机凝胶成像分析系统处理软件, 进行扩增产物的半定量分析. 以β-actin为内对照, iNOS的mRNA表达相对水平采用iNOS的PCR电泳结果扫描值与β-actin的PCR电泳结果扫描值的比值来确定.
统计学处理 数据以mean±SD表示, 使用SPSS10.0软件系统对实验结果进行统计学分析, 组间比较采用方差分析, P<0.05认为有统计学意义.
大体观察见LPS组1.5 h胃黏膜轻度水肿, 3 h可见充血、水肿, 6 h黏膜表面可见大片糜烂、出血、条索状坏死, 与胃纵轴平行, 损伤主要见于腺胃区, 窦部少见, 前胃部无损伤, 24 h黏膜糜烂、出血、坏死灶陈旧、缩小, 48 h黏膜轻度萎缩, 72 h胃黏膜基本恢复正常; 光镜下1.5 h黏膜上皮细胞水肿, 3 h组织充血、水肿, 6 h胃黏膜损伤最重, 黏膜表面上皮广泛脱落, 黏膜内有出血, 炎性细胞浸润, 核碎裂、固缩, 凋亡小体出现, 腺体受损, 24 h上皮脱落、中性粒细胞浸润, 48 h黏膜层变薄、腺体少, 72 h未见明显异常. PAF受体拮抗剂预防组和治疗组6 h仅见胃黏膜充血水肿, 镜下见黏膜上皮细胞肿胀、充血. 对照组胃黏膜表面上皮隐窝细胞形态学正常, 腺体结构完整.
LPS组腹腔注射内毒素后3 h胃黏膜NO含量开始增高, 6 h最高, 此时LPS组较对照组NO含量明显增高(P<0.01), PAF受体拮抗剂预防组、治疗组较LPS组明显降低(P<0.01), PAF受体拮抗剂预防组、治疗组较对照组明显增高(P<0.05); PAF受体拮抗剂预防组与治疗组间无明显差异(P>0.05); 24 h开始下降, 72 h同对照组(表1).
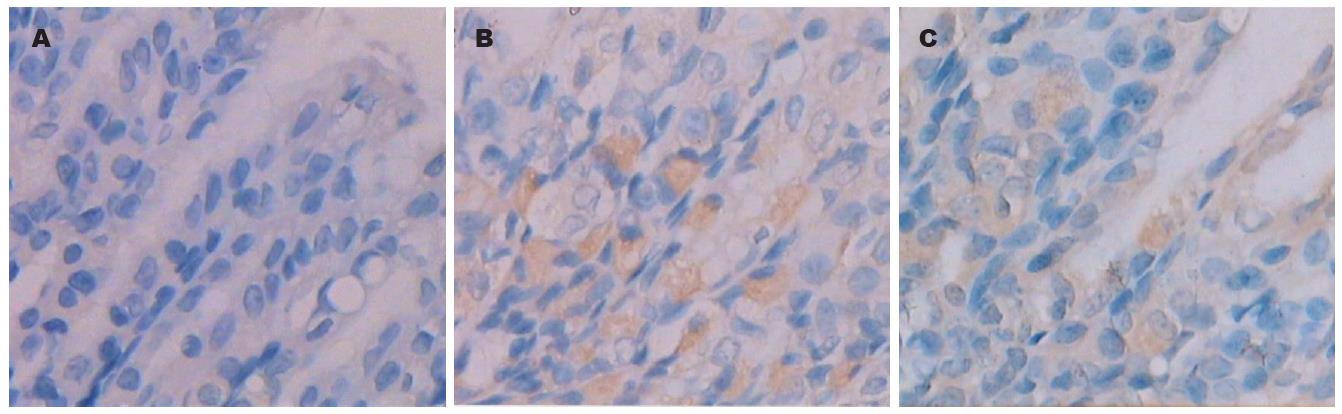
对照组胃黏膜组织未见iNOS蛋白及mRNA的表达. LPS组内毒素腹腔注射后1.5 h胃黏膜组织胞质iNOS蛋白表达, 6 h明显增高, 24 h最高, 48 h下降, 72 h仍未恢复正常; 其mRNA水平亦上调及下调. PAF受体拮抗剂预防组和治疗组3 h iNOS蛋白表达, 6 h明显增高, 48 h下降, 72 h同对照组; 其mRNA 水平亦上调及下调(图1,2 和 表2,3).
| 分组 | 1.5 h | 3 h | 6 h | 24 h | 48 h | 72 h |
| 对照组 | 0.191±0.013 | 0.190±0.022 | 0.204±0.017 | 0.203±0.021 | 0.197±0.017 | 0.205±0.016 |
| LPS组 | 0.237±0.032a | 0.257±0.029b | 0.289±0.038b | 0.283±0.022b | 0.261±0.014b | 0.244±0.029b |
| 预防组 | 0.203±0.020c | 0.260±0.034b | 0.280±0.015b | 0.293±0.024b | 0.257±0.028b | 0.212±0.022c |
| 治疗组 | 0.197±0.035d | 0.259±0.027b | 0.297±0.030b | 0.304±0.037b | 0.259±0.026b | 0.204±0.024c |
NO是由血管内皮细胞产生的血管舒张因子, 1980年Furchgott et al[4]发现血管内皮细胞可产生并释放一种舒血管物质-内皮衍生舒张因子. 1987年Palmer et al[5]证实这种舒血管物质就是NO. NO的主要生理功能是在细胞间传递信息, 他是一种特殊的神经递质. 近年有报道NO对胃黏膜损伤有保护作用, 提出NO与前列腺素一样, 在胃黏膜防护中可能起重要作用, 对胃黏膜具有细胞保护作用, 被认为是胃肠黏膜防护的一重要因子. 他能调节黏膜血流、促进黏液释放、加快黏膜损伤的修复; 还能抑制中性粒细胞的附着及激活以及肥大细胞脱颗粒; 尚有清除氧自由基的功能[6]. 研究显示, 大鼠安静时胃组织内即有一定量的NO, 可能对维持胃黏膜的正常生理功能, 维持胃黏膜血流量具有重要作用[7]. 本实验发现, 对照组胃黏膜NO含量稳定; LPS组ip内毒素后, 3 h胃黏膜NO含量开始增高, 6 h胃黏膜NO含量最高, 此时胃黏膜损伤最重; 24 h已经下降. 其可能机制是: 在正常情况下, 胃合成的低量NO对胃功能的维持起着必不可少的作用, 是实现神经调节、维持胃内正常的血流量、维持胃黏膜屏障结构、调节上皮细胞黏液和碳酸氢盐分泌的重要物质, 具有细胞保护作用. 内毒素血症时, 由于机体处于一种强烈的应激状态和紧急情况, 体内的糖皮质激素及儿茶酚胺类物质增加, 导致全身血液循环加快、血液重新分配、体内代谢加强、血流加速对血管壁的切应力增大, 使内皮细胞/血管平滑肌细胞的iNOS被诱导, 导致iNOS的总活性加强, 产生NO增加. NO的增加可扩张胃内血管保证胃内有一定的血流量, 抑制血小板聚集, 降低血黏度, 防止血栓形成; 同时NO介导胃黏膜产生PGE2, 后者可防止或减轻各种损伤因素引起的胃黏膜损伤并具有强烈的胃酸分泌抑制作用, 因此具有明显的细胞保护功能; NO还可通过加强溃疡周边的黏膜保护, 促进溃疡边缘血管增生, 防止进一步损伤以加速溃疡愈合. 但NO的过度产生可作为一种自由基攻击胃黏膜细胞的膜性结构, 破坏细胞间的相互连接, 导致胃黏膜屏障作用的破坏, 同时影响了胃黏膜上皮细胞的整复或重构, 降低了胃黏膜的防御机能; NO的大量释放可在胃内血管中产生细胞毒作用, 引起淤血, 以致局部黏膜出血性损伤, 从而导致急性胃黏膜损伤的发生. 文献报道[8]小量NO对细胞有保护作用, 且能加速创伤愈合; 大量高浓度NO可导致组织损伤.
一氧化氮合酶(NOS)催化L-精氨酸-NO(L-Arg-NO)生成NO, NOS包括内皮性NOS(eNOS)、神经性NOS(nNOS)和巨噬细胞性NOS(mNOS), 一般认为eNOS和nNOS是原生型, 而mNOS是诱生型(iNOS)[9]. iNOS在静息状态下不表达, 在病理状态下大量产生, 继而产生大量NO. 许多致炎因子, 如内毒素(LPS)和多种细胞因子如白介素-1α(IL-1α), 肿瘤坏死因子-β(TNF-β)和γ干扰素(IFNγ), 可诱导巨噬细胞和平滑肌细胞等产生iNOS, iNOS一旦被激活, 酶活力持续时间很长, iNOS被激活4-6 h, 可生成大量的NO, 不需钙离子和钙调节蛋白参与. iNOS并非仅存在于巨噬细胞和平滑肌细胞中, 实际上iNOS可能在所有组织中都产生. 本实验结果提示: 内毒素腹腔注射后1.5 h iNOS 蛋白即有表达, 6 h明显增高, 48 h下降, 72 h仍有表达, 高峰在6 h到24 h; 其mRNA水平亦上调及下调. 由此得出幼年大鼠内毒素血症时iNOS被激活, 胃黏膜iNOS蛋白表达增强, iNOS mRNA表达上调, 生成大量的NO, NO 的过度产生, 降低了胃黏膜的防御机能; 同时在胃内血管中产生细胞毒作用, 致局部黏膜出血性损伤, 从而导致急性胃黏膜损伤的发生.
PAF是迄今发现的内源性溃疡形成介子中最强的一个, 作为炎性细胞因子放大网络中心放大器, 对其他炎性细胞因子的作用起增强作用[10]. PAF受体拮抗剂能显著改变内毒素或PAF引起的血流动力学改变及组织器官的损伤, 还可抑制花生四烯酸类介质的释放和氧自由基的产生[11-12]. 本实验中预先及腹腔注射内毒素后给予PAF受体拮抗剂, 胃黏膜损伤减轻, 胃黏膜 iNOS mRNA水平下调, 其蛋白表达减弱, NO生成减少. 小量NO对细胞有保护作用, 可防止或减轻各种损伤因素引起的胃黏膜损伤, 加快黏膜损伤的修复, 对胃黏膜产生的保护作用.
本实验结果提示, 幼年大鼠内毒素血症时iNOS被激活, 胃黏膜iNOS mRNA表达上调, iNOS蛋白表达增强, 生成大量的NO, 对胃黏膜产生损伤作用. PAF受体拮抗剂可使胃黏膜损伤减轻, 通过胃黏膜iNOS mRNA表达水平下调, iNOS蛋白表达减弱, NO生成减少对胃黏膜发挥保护作用.
急性胃黏膜损伤发生机制是由于胃黏膜保护机制削弱, 损伤因素相对增强所致. 近年研究发现一氧化氮(NO)、诱导型一氧化氮合酶(iNOS)在胃黏膜损伤和修复方面发挥重要作用.
高英堂, 研究员, 天津市第三中心医院 天津市肝胆疾病研究所分子细胞室
小量NO对细胞有保护作用, 且能加速创伤愈合; 大量高浓度NO可导致组织损伤.
PAF受体拮抗剂可使胃黏膜损伤减轻, 通过胃黏膜iNOS mRNA表达水平下调, iNOS蛋白表达减弱, NO生成减少对胃黏膜发挥保护作用.
本研究设计较为合理, 实验方法也较全, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 2. | 夏 敏, 陶 嘉泳, 俞 蔼谣. 急性胃粘膜损伤的机制研究. 上海第二医科大学学报. 2001;21:517-519. |
| 3. | West SD, Suliburk JW, Helmer KS, Mercer DW. Cyclooxygenase-1 suppresses lipopolysaccharide-induced changes in rat gastric inducible nitric oxide synthase. Crit Care Med. 2008;36:572-579. [PubMed] |
| 4. | Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 1980;288:373-376. [PubMed] [DOI] |
| 5. | Palmer RM, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 1987;327:524-526. [PubMed] [DOI] |
| 6. | Brzozowski T, Konturek PC, Moran AP, Kwiecien S, Pajdo R, Konturek SJ, Drozdowicz D, Ptak A, Pawlik W, Hahn EG. Enhanced resistance of gastric mucosa to damaging agents in the rat stomach adapted to Helicobacter pylori lipopolysaccharide. Digestion. 2003;67:195-208. [PubMed] [DOI] |
| 7. | Ishii M, Shimizu S, Nawata S, Kiuchi Y, Yamamoto T. Involvement of reactive oxygen species and nitric oxide in gastric ischemia-reperfusion injury in rats: protective effect of tetrahydrobiopterin. Dig Dis Sci. 2000;45:93-98. [PubMed] [DOI] |
| 8. | Yamasaki K, Edington HD, McClosky C, Tzeng E, Lizonova A, Kovesdi I, Steed DL, Billiar TR. Reversal of impaired wound repair in iNOS-deficient mice by topical adenoviral-mediated iNOS gene transfer. J Clin Invest. 1998;101:967-971. [PubMed] [DOI] |
| 10. | 文 卓夫, 曹 之宪, 黎 锦泉, 林 兆鑫. 一氧化氮-氟比洛芬的胃肠毒性及其对胃粘膜前列腺素E2的影响. 胃肠病学与肝病学杂志. 2001;10:42-43. |
| 11. | 姚 新生. 血小板活化因子的生理、病理作用及机制. 国外医学·生理、病理科学与临床分册. 2002;22:374-376. |
| 12. | Cowan DB, Poutias DN, Del Nido PJ, McGowan FX Jr. CD14-independent activation of cardiomyocyte signal transduction by bacterial endotoxin. Am J Physiol Heart Circ Physiol. 2000;279:H619-H629. [PubMed] |