修回日期: 2009-01-07
接受日期: 2009-01-12
在线出版日期: 2009-02-08
目的: 探讨Caveolin-2基因启动子区域5'CpG岛甲基化与胃癌发生发展的关系.
方法: 运用甲基化特异性PCR(MSP)技术检测33例胃癌组织及5例距肿瘤5 cm以上的癌旁正常胃组织中Caveolin-2基因启动子区域5'CpG岛甲基化状态.
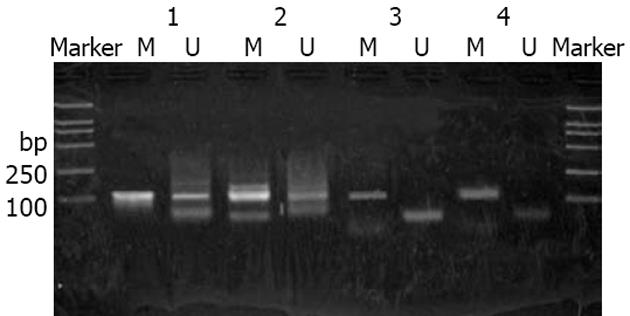
结果: 5例正常胃组织Caveolin-2基因启动子区域5'CpG岛均为甲基化阴性. 33例胃癌组织中 29例甲基化阳性, 甲基化率为87.9%(29/33), 其中20 例癌组织(60.6%)表现为完全甲基化, 9例癌组织(27.3%)表现为部分甲基化. 4例癌组织(12.1%)表现为甲基化阴性. 统计学结果显示癌组织中Caveolin-2基因启动子区域5'CpG岛甲基化率显著高于正常组织.
结论: 胃癌组织中存在较高的Caveolin-2基因启动子区域5'CpG岛甲基化率, 甲基化可能与胃癌的发生有关.
引文著录: 何欣, 刘斌, 邢传平, 哈小琴, 董亮, 钱震, 刘茗露, 苏勤军. Caveolin-2基因甲基化状态在胃癌组织中的检测. 世界华人消化杂志 2009; 17(4): 417-420
Revised: January 7, 2009
Accepted: January 12, 2009
Published online: February 8, 2009
AIM: To investigate the relationship between methylation of 5'CpG island in the promoter region of Caveolin-2 gene and development of gastric carcinoma.
METHODS: Using methylation-specific PCR technique, the methylation status of the 5'CpG island in the promoter region of Caveolin-2 gene was measured in 33 tissue samples of gastric carcinoma and 5 normal gastric tissue samples >5 cm apart from tumor.
RESULTS: Methylation of the 5'CpG island in the promoter region of Caveolin-2 gene in all 5 samples of normal gastric tissues was negative. In 33 gastric cancerous tissue samples, the methylation positive rate of promoter region of Caveolin-2 gene was 87.9% (29/33), among which 20 cases (60.6%) complete methylation, 9 cases (27.3%) were partial methylation, and 4 samples were negative. Statistics showed the methylation rate of the promoter region of Caveolin-2 gene was obviously higher in gastric carcinoma than in normal gastric tissues.
CONCLUSION: The methylation positive rate of the 5'CpG island in the promoter region of Caveolin-2 gene in gastric carcinoma is high, indicating that its methylation may be related to genesis of gastric carcinoma.
- Citation: He X, Liu B, Xing CP, Ha XQ, Dong L, Qian Z, Liu ML, Su QJ. Detection of methylation status of Caveolin-2 gene in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(4): 417-420
- URL: https://www.wjgnet.com/1009-3079/full/v17/i4/417.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i4.417
Caveolae是细胞膜上特定的直径约50-100 nm的微区域, 由胆固醇、鞘脂及蛋白质组成. Caveolin是Caveolae的标记蛋白, 参与胞吞和胞内运输作用、胆固醇运输、信号传导、血管生成等过程,与病原体感染、阿尔茨海默病、糖尿病、肌肉病变、肿瘤、心肺疾病等密切相关[1-2]. Caveolin-2是Caveolins家族的一员. 本实验室先前采用免疫组织化学染色方法、原位杂交和甲基化特异性PCR(MSP)技术对Caveolin-1基因和Dnmt1的mRNA和蛋白在胃癌组织中的表达状况及Caveolin-1基因外显子1和2的启动子区域的CpG岛甲基化状况进行了初步研究, 实验结果表明: 在胃癌组织中Caveolin-1蛋白阳性表达率仅为28.2%[3-4], Dnmt1蛋白阳性表达率为70%[5], Spearman等级相关分析显示Dnmt1蛋白与Caveolin-1蛋白表达呈负相关, 而Caveolin-1基因外显子1和2的启动子区域的CpG岛甲基化发生率为73.33%和90%, 并推测Caveolin-1蛋白表达降低与其发生甲基化有关. 为了进一步研究Caveolin基因甲基化在胃癌发生发展中的作用, 我们采用甲基化特异性PCR(MSP)技术进一步检测了胃癌组织中Caveolin-2基因启动子区域甲基化状态, 以探讨Caveolin-2基因启动子区域甲基化与胃癌发生的关系.
33例胃癌组织及5例距肿瘤5 cm以上的癌旁正常胃组织同时取自中国人民解放军兰州军区兰州总医院2007-06/2008-04胃癌术后切除的胃组织标本, 标本取后于-40℃保存. 33例胃癌组织均为腺癌, 其中高中分化16例, 低分化17例. 患者男28例, 女5例, 年龄32-83(平均61.36)岁. 所有标本均为新鲜标本, 并经病理学检查确诊. 患者术前均未进行放疗和化疗. 基因组DNA修饰试剂盒(CpGenome DNA Modification Kit)购于美国Chemicon公司. Taq酶(DR100A), dNTP, DNA Marker, 均购于宝生物工程(大连)有限公司(TaKaRa). 琼脂糖粉(Agarose Regular)购于上海生工生物工程有限公司.
1.2.1 基因组DNA提取: 采用传统的酚-氯仿抽提法提取DNA[6].
1.2.2 基因组DNA的亚硫酸氢盐修饰: 基因组DNA的修饰使用甲基化修饰试剂盒, 操作步骤按试剂盒说明进行.
1.2.3 引物设计: 从GenBank中检索出Caveolin-2基因DNA序列(基因序列号: AJ242718, promoter位于1-1132 bp), 依据该基因序列运用Primer Premier5.0引物设计软件针对启动子区域设计Caveolin-2基因的甲基化(M)及非甲基化(U)引物. 引物设计原理为: DNA经NaOH变性后成为单链, 其胞嘧啶(C)可被亚硫酸氢盐脱氨基转变为尿嘧啶(U), 继而以胸腺嘧啶(T)的形式被扩增; 而甲基化的胞嘧啶(C)即5-甲基胞嘧啶(5-mC)则不能被修饰, 仍保持为5-mC. 根据5-mC 和非甲基化的C修饰后的不同, 而设计引物, 发生甲基化与未发生甲基化DNA的上游引物之间的差别为C变为T, 下游引物的差别为鸟嘌呤(G) 变为腺嘌呤(A). 引物序列及产物长度见表1. 引物由上海生工生物工程有限公司合成.
| 引物 | 引物序列 | 产物长度(bp) |
| 甲基化(M) | 5-CTGTGACTCGTGGGGACGGTTC-3 | 119 |
| 5-TTCCCGCTGTGGGCTCCAG-3 | ||
| 非甲基化(U) | 5-TTGTGATTTGTGGGGATGGTTT-3 | 119 |
| 5-TTCCCACTATAAACTCCAA-3 |
1.2.4 PCR: PCR采用25 µL反应体系. 每份经亚硫酸氢盐修饰后的标本都分别用甲基化与非甲基化引物扩增, 由于DNA双链中总是存在非甲基化的胞嘧啶, 使得修饰后的DNA双链不再完全配对, 容易形成二级结构, PCR扩增时不易解链. 因而我们采用热启动法进行PCR扩增: 预变性之前, 不加入Taq酶, 在预变性之后再加入酶(温度保持在95.5℃). PCR反应体系均为: 模板12.5 µL, 10×PCR缓冲液(Mg2+ Plus)2.5 µL, dNTP混合物(各2.5 µmol/L)2.5 µL, TaKaRa Taq(5 U/µL)非甲基化引物扩增为0.5 µL, 甲基化引物扩增为0.3 µL,上游引物(10 µmol/L)1.5 µL, 下游引物(10 µmol/L)1.5 µL,灭菌去离子水甲基化引物扩增为4.2 µL, 非甲基化引物扩增为4.0 µL. 扩增参数为: 95.5℃预变性5 min后开始30个循环: 95.5℃变性30 s, 甲基化引物60℃退火45 s, 非甲基化引物50℃退火45 s, 72℃延伸45 s, 最后于72℃延伸7 min, 4℃保存. 由于一次扩增后电泳条带不清, 可能是修饰过程中使一部分DNA丢失, 扩增产量较低的缘故, 故取一次扩增产物8 µL, 用相同的条件进行二次扩增.
1.2.5 结果判定: 取PCR扩增产物5 µL用20 g/L琼脂糖凝胶电泳, 紫外灯下观察结果. 甲基化与非甲基化引物阳性目的条带均119 bp. 如果甲基化引物扩增后出现大小为119 bp特异性条带, 则认为启动子区域存在甲基化, 若非甲基化引物扩增后出现大小为119 bp特异性条带, 则认为启动子区域存在非甲基化, 甲基化与非甲基化引物扩增后均出现大小为119 bp特异性条带为部分甲基化, 也认为启动子区域存在甲基化. 若两对引物均未扩增出特异性条带, 则认为实验失败, 需重复实验.
统计学处理 根据数据类型选择Fisher确切概率法, 使用SPSS10.0统计软件包进行统计学处理, 显著性水准为α = 0.05.
5例正常胃组织Caveolin-2基因启动子区域均为甲基化阴性. 33例胃癌组织中29例甲基化阳性, 甲基化率为87.9%(29/33),其中20例癌组织(60.6%)表现为完全甲基化, 9例癌组织(27.3%)表现为部分甲基化, 4例癌组织(12.1%)表现为甲基化阴性. 胃癌组织中Caveolin-2基因启动子区域甲基化率显著高于正常组织(P<0.05,图1).
经Fisher确切概率法检验, 胃癌组织中Caveolin-2基因启动子区域甲基化状态与胃癌组织分化程度、患者年龄、性别、肿瘤大小、浸润深度、有无淋巴结转移及有无脉管侵犯等临床病理特征无关(P>0.05), 差异无统计学意义(表2).
| 临床病理指标 | n | 甲基化 | P | |
| 阳性 | 阴性 | |||
| 分化程度 | 0.601 | |||
| 高中分化 | 16 | 15 | 1 | |
| 低分化 | 17 | 14 | 3 | |
| 年龄(岁) | 0.500 | |||
| <50 | 5 | 4 | 1 | |
| ≥50 | 28 | 25 | 3 | |
| 性别 | 0.500 | |||
| 男 | 28 | 25 | 3 | |
| 女 | 5 | 4 | 1 | |
| 肿瘤大小(cm) | 1.000 | |||
| <4 | 5 | 5 | 0 | |
| ≥4 | 28 | 24 | 4 | |
| 浸润深度 | 0.420 | |||
| 肌层 | 4 | 3 | 1 | |
| 浆膜外 | 29 | 26 | 3 | |
| 淋巴结转移 | 0.241 | |||
| 有 | 25 | 23 | 2 | |
| 无 | 8 | 6 | 2 | |
| 脉管侵犯 | 0.420 | |||
| 有 | 4 | 3 | 1 | |
| 无 | 29 | 26 | 3 |
胃癌的发生发展是机体(内因)与环境(外因)相互作用的结果, 其发生发展的各阶段都有遗传学改变. 在高等真核生物, DNA甲基化仅存在于位于5'端CpG岛的胞嘧啶, 这种修饰对基因的表达调控发挥重要的作用, 尤其是对于许多基因启动子区域的CpG岛. 正常未甲基化的CpG岛发生异常甲基化被证明在永生细胞和变异细胞是一个相对频繁的事件, 并且与人类癌症中已确定的抑癌基因的转录失活有关[7]. 目前已在胃癌中检测出多个抑癌基因CpG岛存在异常甲基化, 如p16, RUNX3、E-cadherin、PTEN、及TSLC1等[8]. Leal et al[9]运用MSP方法检测了胃腺癌中CDH1, FHIT,MTAP 和 PLAGL1基因启动子区域的甲基化状态, 研究结果显示, 其甲基化率分别为98.7%, 53.9%, 23.1%和29.5%, 他们认为高甲基化与胃癌的发生有关.
Caveolae是细胞膜上的特殊囊泡状结构,是细胞膜生物功能多样性的重要结构基础. Caveolin家族包括Caveolin-1、Caveolin-2和Caveolin-3. Caveolin-1是分子质量为21-24 kDa 的膜蛋白, 也是Caveolae的标志性蛋白, 其编码基因定位于7q31.1, 有3个外显子. Caveolin-2和Caveolin-3是近期发现的Caveo-lin家族成员, 其中Caveolin-2长162 aa, 其编码基因也定位于7q31.1, 有3个外显子, 其分布与Caveolin-1相似,并与Caveolin-1形成异寡聚复合物, 细胞内转运Caveolin-1需Caveolin-2参与, 因而Caveolin-2可能是Caveolin-1的辅助蛋白[10-11].
本次实验结果显示: 5例正常胃组织Caveolin-2基因启动子区域均为甲基化阴性. 33例胃癌组织中29例甲基化阳性, 甲基化率为87.9%(29/33), 其中20例癌组织(60.6%)表现为完全甲基化, 9例癌组织(27.3%)表现为部分甲基化, 4例癌组织(12.1%)表现为甲基化阴性. 统计学结果显示癌组织中Caveolin-2基因启动子区域甲基化率显著高于正常组织(P<0.05). 提示Caveolin-2基因启动子区域甲基化对人的胃癌的发生、发展可能有一定的促进作用.
我们研究还发现, 胃癌组织中Caveolin-2基因启动子区域甲基化状态与胃癌组织分化程度、患者年龄、性别、肿瘤大小、浸润深度、有无淋巴结转移及有无脉管侵犯等临床病理特征均无明显的相关关系(P>0.05).
目前, 对于Caveolin-2基因在胃癌组织中的具体作用机制还有待于进一步研究. 我们通过对Caveolin-1第1、2外显子及Caveolin-2启动子区域CpG岛甲基化状态的检测, 发现Caveolin-1第1、2外显子及Caveolin-2启动子区域CpG岛均存在较高的甲基化率, 基因启动子区域的高甲基化可能会导致基因功能的失活或下降, 因而对人的胃癌的发生、发展可能有一定的促进作用.
胃癌是常见的消化系恶性肿瘤, 其发生发展是机体(内因)与环境(外因)相互作用的结果, 在其发生发展的各阶段都有遗传学改变. 目前相关基因的异常甲基化已成为研究热点.
于颖彦, 教授, 上海交通大学医学院附属瑞金医院消化外科研究所与器官移植中心
目前已在胃癌中检测出多个抑癌基因CpG岛存在异常甲基化, 如p16, RUNX3、E-cadherin、PTEN、及TSLC1等.
本研究运用MSP方法对胃癌及距肿瘤5 cm以上的癌旁正常胃组织中Caveolin-2基因甲基化状况进行了研究, 提示Caveolin-2基因甲基化对人的胃癌的发生、发展可能有一定的促进作用.
有可能通过检测Caveolin-2基因甲基化率对胃癌进行早期诊断. 同时, 可以考虑运用去甲基化药物对胃癌进行临床基因治疗
本文内容新颖, 结果可信, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Williams TM, Lisanti MP. The caveolin proteins. Genome Biol. 2004;5:214. [PubMed] [DOI] |
| 3. | 刘 斌, 杨 育生, 邢 传平, 高 自芳, 顾 立萍, 钱 震, 董 亮, 苏 勤军. Caveolin-1基因mRNA和蛋白在胃癌组织的表达. 第四军医大学学报. 2007;28:1868-1871. |
| 4. | 杨 育生, 刘 斌, 邢 传平, 高 自芳, 顾 立萍, 钱 震, 董 亮, 苏 勤军. 胃癌组织中Caveolin-1、nm23及MMP-2的表达及其意义. 世界华人消化杂志. 2007;15:1725-1730. [DOI] |
| 7. | Herman JG, Graff JR, Myohanen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 9. | Leal MF, Lima EM, Silva PN, Assumpção PP, Calcagno DQ, Payão SL, Burbano RR, Smith MA. Promoter hypermethylation of CDH1, FHIT, MTAP and PLAGL1 in gastric adenocarcinoma in individuals from Northern Brazil. World J Gastroenterol. 2007;13:2568-2574. [PubMed] |
| 11. | Scherer PE, Lewis RY, Volonte D, Engelman JA, Galbiati F, Couet J, Kohtz DS, van Donselaar E, Peters P, Lisanti MP. Cell-type and tissue-specific expression of caveolin-2. Caveolins 1 and 2 co-localize and form a stable hetero-oligomeric complex in vivo. J Biol Chem. 1997;272:29337-29346. [PubMed] [DOI] |