修回日期: 2008-12-17
接受日期: 2008-12-22
在线出版日期: 2009-02-08
目的: 探讨胰腺癌组织(pancreatic carcinoma, PC)中P53和Bcl-2家族(Bcl-2, Bax, Bcl-xL, Bcl-xS)蛋白表达及与细胞凋亡的关系.
方法: 免疫组化法检测35例PC中P53蛋白表达, 将PC分为P53阴性表达组(第1组, n = 18)和P53阳性表达组(第2组, n = 17); Western blot检测两组PC中P53, Bcl-2, Bax, Bcl-xL和Bcl-xS蛋白表达, TUNEL法检测第1组中凋亡指数(AI).
结果: Bcl-2蛋白在P53阳性PC表达上调, 而在P53阴性PC表达下调(P = 0.047); Bax和Bcl-xL蛋白在两组PC中表达都明显上调(P = 0.274, 0.334); Bcl-xS在P53阳性表达PC明显下调, 在P53阴性表达组明显上调(P = 0.01); 在P53阴性和阳性表达PC, AI分别为12.1±2.47和9.1±1.48(P = 0.023); Bcl-2家族各成员表达与AI无相关性, 而Bcl-2/Bax比率与AI有明显的相关性(P<0.01).
结论: Bcl-2是依赖P53调节的抗凋亡蛋白, Bcl-xS是依赖P53调节的促凋亡蛋白, 而P53主要通过调节Bcl-2/Bax比率发挥凋亡调节作用.
引文著录: 吴幸, 崔海宁, 明松林, 王正文, 欧树安, 陈兴超, 余壮明. P53和Bcl-2家族蛋白在胰腺癌中的表达. 世界华人消化杂志 2009; 17(4): 368-372
Revised: December 17, 2008
Accepted: December 22, 2008
Published online: February 8, 2009
AIM: To investigate the relationships between P53 and Bcl-2 family (Bcl-2, Bax, Bcl-xL, Bcl-xS) expression and apoptosis in human pancreatic carcinoma (PC).
METHODS: The immunohistochemical method was used to detect the expression of P53 protein in a total of 35 patients with PC. The patients were divided into two groups, group 1 with immunonegative P53 (18 cases) and group 2 with immunopositive (17 cases). The expressions of P53, Bcl-2, Bax, Bcl-xL, and Bcl-xS in both groups were detected by Western blot. The apoptosis index (AI) of group 1 was determined by terminal deoxynucleotidyltransferase-mediated UTP end-labeling (TUNEL).
RESULTS: Bcl-2 was remarkably up-regulated in group 2 but down-regulated in group 1 (P = 0.047). Expressions of both Bax and Bcl-xL proteins were up-regulated in those two groups (P = 0.274, 0.334). Bcl-xS was remarkably down-regulated in group 2 but up-regulated in group1 (P = 0.01). The AI of both groups were 12.1 ± 2.47 and 9.1 ± 1.48, respectively (P = 0.023), no correlations were found between AI and expression of Bcl-2 family members, but marked correlations were noted between AI and the Bcl-2/bax ratios (P < 0.01).
CONCLUSION: Bcl-2 family is a group of anti-apoptotic proteins, and Bcl-xS is a pro-apoptotic protein. Both of them are dependent on the regulation of P53 which modulates apoptosis mainly through modifying Bcl-2/Bax ratios.
- Citation: Wu X, Cui HN, Ming SL, Wang ZW, Ou SA, Chen XC, Yu ZM. Expression of apoptosis-related Bcl-2-family and P53 in human adenocarcinoma of the pancreas. Shijie Huaren Xiaohua Zazhi 2009; 17(4): 368-372
- URL: https://www.wjgnet.com/1009-3079/full/v17/i4/368.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i4.368
胰腺癌是预后最差的消化系恶性肿瘤, 5年生存率不足1%-5%[1]. 凋亡受阻是胰腺肿瘤(pancreatic carcinoma, PC)发生发展的重要因素, 而组成Bcl-2家族相关蛋白在PC的凋亡调节过程中占主要地位[2-4]. Bcl-2家族包括凋亡抑制因子(Bcl-2, Bcl-xL, Bcl-w, Bfl-1, Brag-1, Mcl-1, A1)和凋亡促进因子(Bax, Bak, Bcl-xS, Bad, Bid, Bik, Hrk), 两者的比率决定细胞是否能接受凋亡信号[5]. 在一定程度上, 细胞凋亡或是凋亡抑制是通过两方面基因的调节实现的[6-7]. P53是调节Bcl-2家族的主要蛋白, 而且P53对Bcl-2家族不同蛋白有着不同的调节方式, 由此影响着胰腺癌的生物学行为[6,8-9]. 如, 野生型p53能激活Bcl-2家族的bax促凋亡基因, 抑制bcl-2抑凋亡基因. 但是, p53和bcl-2家族基因的关系目前还不清楚. 本试验旨在系统定量的研究Bcl-2家族成员蛋白表达与P53的关系.
收集1998-05/2007-05海南医学院普外科手术切除的PC组织35例(临床资料完整), 切除组织分为两部分: 一部分进行常规病理和免疫组织化学检测, 另一部分立即放入-70℃液氮中保存备用. 所有患者均为第1次手术, 术前未经任何放、化疗.
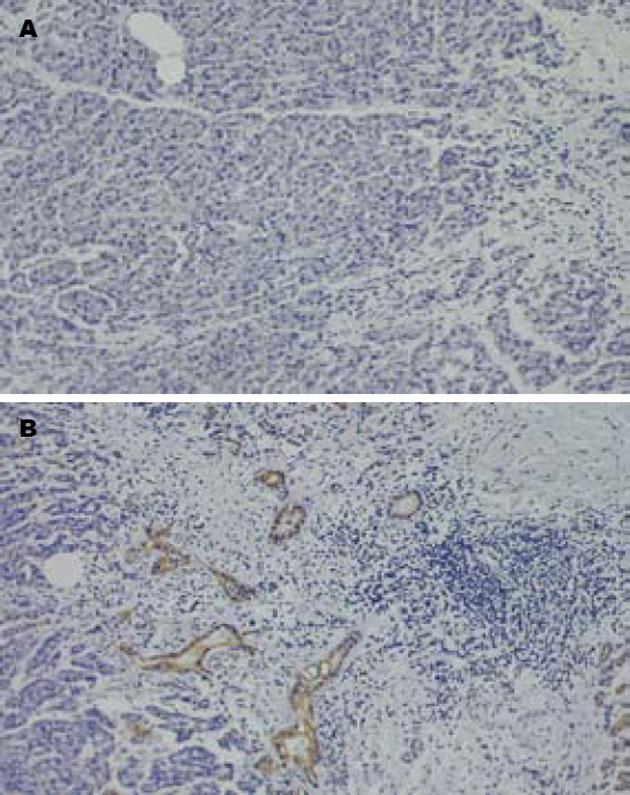
1.2.1 P53免疫组化检测: 4 μm石蜡切片贴在涂有切片黏合剂的载玻片上, 58℃烤24 h, 常规脱蜡至水, 二甲苯Ⅰ, Ⅱ, Ⅲ, 无水乙醇, 950、850、750 mL/L乙醇, 各2 min, 水洗2 min; 30 g/L H2O2作用20 min以消除内源性过氧化物酶的活性. 蒸馏水洗涤, 将切片置于10 mmol/L pH6.0柠檬酸缓冲液中, 120℃微波抗原修复10 min, 室温自然冷却20 min, BPS洗涤3次, 加入阻断血清在正常血清室温下封闭30 min(阻断非特意性结合位点), 擦干组织周围多余水分, 加适当稀释一抗P53(1∶100即用型), 4℃过夜; 加入2抗, 室温30 min, PBS洗3 min×3, DBA染色8 min, 自来水洗3 min, 复染(苏木素衬染30 s, 水洗, 盐酸乙醇蓝化2S, 水洗, 微波蓝化), 常规树脂封片; 用已知阳性标本作阳性对照, 用PBS代替一抗, 结果应为阴性, 阳性为细胞核染色棕黄色或棕褐色, 并呈颗粒状, 背景呈紫蓝色. 阳性反应的强度分为阴性(≤20%), 阳性(>20%)[10].
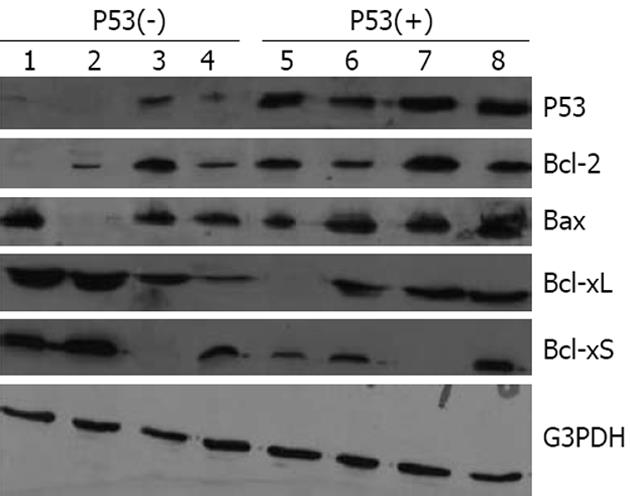
1.2.2 Western blot检测P53, Bcl-2, Bax, Bcl-xL和Bcl-xS蛋白表达: 将组织切块切成小片, 加入冰冷的裂解液200 μL, 细胞裂解30 min后, 14 000 r/min 4℃离心20 min, BCA进行蛋白定量. 每孔加入30 μg蛋白, 120 g/L SDS-聚丙烯酰胺凝胶电泳, 电转至硝酸纤维素膜, 4℃下脱脂奶封闭后过夜. 将膜在4℃. TBST中晃洗中振洗5 min, 2次, 分别加入不同的一抗和G3PDH, 密封, 温室2 h, 4℃ 3 h, 温室2 h. 含3 mL/L Tween-20的BPS洗涤3次, 加入二抗, 密封, 室温1.5 h, 用PBST液将PVDF膜洗3次, 每次5 min. 在暗室内压胶片曝光, 观察结果并照相. 用Bio-Rad/GS 700凝胶图像处理系统进行分析. 肿瘤组织不同蛋白表达水平用目的条带灰度与内参G3PDH条带的灰度比值定量表示.
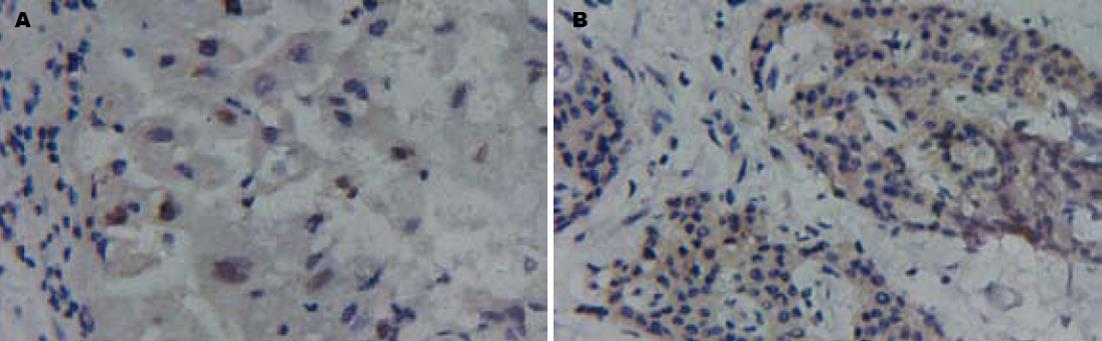
1.2.3 细胞凋亡检测: 切片脱蜡脱水后加入20 mg/L蛋白激酶K室温孵育15 min, 37℃消化5 min, PBS洗涤1次. 双蒸水洗涤3次, 每次5 min. 加30 g/L H2O2 50 μL/片, 室温下浸泡5 min. 双蒸水洗片3次, 每次5 min. 加上Permeabilisation 50 μL/片, 室温3 min. 双蒸水洗片3次, 每次5 min. 切片加入TdT(0.6 μL)和dUTP(1.4 μL), 37℃湿盒中标记60 min. PBS洗片3次, 每次3 min. 加 Blocking Reagent 50 μL/片, 37℃, 30 min, 甩片. 加Avidin-HRP工作液50 μL/片, 37℃湿盒中标记60 min. PBS洗片3次, 每次3 min. DAB(现配)显色液50 μL/片, 显微镜下控制显色. PBS洗片终止显色. 苏木素复染, 常规封片. 显微镜下计数500个细胞, 以细胞内出现棕色颗粒着为凋亡阳性细胞, 计算计算凋亡指数(AI). AI = 凋亡细胞/总数细胞×100%[10].
统计学处理 统计学数据采用mean±SD表示, 资料采用χ2检验和t检验和Pearson相关性, P<0.05有统计学意义.
35例PC患者中, P53阴性表达18例(第1组), 阳性表达17例(第2组)(图1). Bcl-2蛋白在第2组中表达上调, 而在第1组中表达下调(P = 0.047), Bax蛋白在两组中表达都明显上调(P = 0.274); Bcl-2/Bax比率在第2组(14/17)明显高于第1组(4/18)(P = 0.018). Bcl-xL蛋白在两组中表达也明显上调(分别15/17和14/18)(P>0.05), 而Bcl-xS在第1组表达上调(13/18), 在第2组表达下调(3/17)(P<0.05). Bcl-xL/Bcl-xS在两组都表达上调(P>0.05)(图2, 表1).
| 分组 | Ratio≥1 | Ratio<1 | P值 |
| Bcl-2 | 0.047 | ||
| 第1组 | 5 | 12 | |
| 第2组 | 15 | 3 | |
| Bax | 0.274 | ||
| 第1组 | 15 | 3 | |
| 第2组 | 15 | 2 | |
| Bcl-2/Bax | 0.012 | ||
| 第1组 | 4 | 14 | |
| 第2组 | 14 | 3 | |
| Bcl-xL | 0.334 | ||
| 第1组 | 15 | 3 | |
| 第2组 | 14 | 3 | |
| Bcl-xS | 0.021 | ||
| 第1组 | 13 | 5 | |
| 第2组 | 3 | 14 | |
| Bcl-xL/Bcl-xS | 0.215 | ||
| 第1组 | 14 | 4 | |
| 第2组 | 12 | 5 |
在P53阴性和阳性表达组的PC中, AI分别为12.1±2.47和9.1±1.48, 差异有显著性(P = 0.023); 在Bcl-2, Bax, Bcl-xL和Bcl-xS高表达组(≥1), AI分别为10.36±2.26, 11.39±3.82, 11.18±3.21, 12.83±2.66, 在Bcl-2, Bax, Bcl-xL和Bcl-xS低表达组(<1), AI分别为11.54±2.54, 10.45±2.06, 10.45±1.36, 10.00±2.43, 差异分别无统计学意义(P>0.05); 而在Bcl-2/Bax比率≥1组, AI为9.19±1.87, Bcl-2/Bax比率<1组, AI为13.02±3.45, 差异有统计学意义(P = 0.012); Bcl-xL/Bcl-xS比率与AI无相关性(P>0.05, 图3, 表2).
| 分组 | n | AI | P值 |
| Bcl-2/G3PDH | 0.056 | ||
| Ratio≥1 | 20 | 10.36±2.26 | |
| Ratio<1 | 15 | 11.54±2.54 | |
| Bax/G3PDH | 0.364 | ||
| Ratio≥1 | 30 | 11.39±3.82 | |
| Ratio<1 | 5 | 10.45±2.06 | |
| Bcl-xL/G3PDH | 0.173 | ||
| Ratio≥1 | 29 | 11.18±3.21 | |
| Ratio<1 | 6 | 10.45±1.36 | |
| Bcl-xS/G3PDH | 0.069 | ||
| Ratio≥1 | 16 | 12.83±2.66 | |
| Ratio<1 | 19 | 10.00±2.43 | |
| Bcl-2/Bax | 0.012 | ||
| Ratio≥1 | 18 | 9.19±1.87 | |
| Ratio<1 | 17 | 13.02±3.45 | |
| Bcl-xL/Bcl-xS | 0.082 | ||
| Ratio≥1 | 26 | 11.72±2.58 | |
| Ratio<1 | 9 | 12.51±3.19 |
野生型p53(Wt-p53)是转录调节因子, 其在细胞DNA合成、DNA修复和凋亡调节过程中起重要作用[11]. 由于Wt-P53蛋白的半衰期短并且含量低微, 因此, 通过免疫染色方法难以检测得到[7]. 当p53突变后, 突变p53可与细胞中的某些蛋白结合而积聚在细胞中, 在这种情况下可通过免疫组化方法检测到高水平的突变p53表达[7].
细胞凋亡是由基因调控的主动而有序的自我消亡过程, 大多数情况下, 细胞生死是通过p53依赖或非依赖两条途径进行调节的, 而高效的细胞凋亡必须通过p53途径[12-13]. 在本实验中, PC组织中P53阳性表达率为48.6%, AI在P53阴性组明显高于P53阳性组, 说明PC中细胞凋亡是P53依赖性, 这与文献的研究结果相一致[14-16].
P53的凋亡调节作用是通过上调Bax和下调Bcl-2或Bcl-xL等实现的, 通过他们的相互作用调节着细胞线粒体的通透性, 从而影响着下游的促凋亡基因的功能[6-7,17-20].
我们的研究结果表明, Bcl-2在P53阳性表达的PC中过度表达, 而在P53阴性表达的PC中明显低表达, 说明Bcl-2是P53依赖性调节, 即P53高表达者对Bcl-2的抑制作用减弱或消失, 而P53丧失者对Bcl-2的抑制作用加强. Bax在P53阴性和阳性组都表达上调, 但差别无统计学意义, 说明Bax是不依赖P53进行调节的. Bcl-xL在P53阳性和阴性表达的肿瘤组织中也都存在明显上调(P>0.05), 而Bcl-xS在P53阳性表达的肿瘤组织中下调, 在P53阴性表达肿瘤组织中明显上调(P<0.05), 提示Bcl-xS是P53依赖性调节. 研究Bcl-xL/Bcl-xS和Bcl-2/Bax比率发现, 后者在P53阳性和阴性表达组的差异有显著性(P<0.05), 说明Bcl-2/Bax比率是依赖P53进行调节的. 但凋亡检测表明: Bax和Bcl-xL表达与AI无相关性, 尽管Bcl-2低表达组和Bcl-xS高表达组的AI高于Bcl-2高表达组和Bcl-xS低表达组, 差异无显著性. Bcl-xL/Bcl-xS比率在不同AI之间的差异也无统计学意义, 但AI在Bcl-2/Bax高比率组明显低于低比率组(P<0.01), 所以Bcl-2/Bax两蛋白之间的比例是决定对细胞凋亡抑制作用强弱的关键因素[21-27]. 因此, 细胞凋亡不是由单一的凋亡相关蛋白决定的, 而是由许多蛋白共同作用的结果[28-29].
总之, Bcl-2和Bcl-xS是受P53依赖性调节的抑凋亡蛋白和促凋亡蛋白, P53主要通过调节Bcl-2/Bax比率发挥凋亡调节作用的.
Bcl-2家族相关蛋白的抗凋亡和促凋亡成员协同作用, 在胰腺癌的凋亡调控中起着举足轻重的作用; P53是调节Bcl-2家族的主要蛋白, 但p53和bcl-2家族基因的关系目前还不清楚.
李国威, 教授, 西安交通大学医学院第二附属医院普通外科
凋亡受阻是胰腺癌发病的重要因素, 而P53及Bcl-2家族蛋白在胰腺癌凋亡过程中的相关性有待深入研究.
大多数作者研究了Bcl-2家族某些蛋白与胰腺癌之间的关系, 但系统定量的研究Bcl-2家族成员蛋白表达与P53的关系少见.
本文探讨了P53和Bcl-2家族成员蛋白之间表达的关系以及与细胞凋亡的关系, 为以凋亡为靶点的基因治疗提供理论依据.
本研究目的明确, 设计技术路线合理, 新颖性较好, 研究结构有一定理论参考价值.
编辑: 李军亮 电编:何基才
| 1. | Parker SL, Tong T, Bolden S, Wingo PA. Cancer statistics, 1997. CA Cancer J Clin. 1997;47:5-27. [PubMed] [DOI] |
| 3. | Lutz RJ. Role of the BH3 (Bcl-2 homology 3) domain in the regulation of apoptosis and Bcl-2-related proteins. Biochem Soc Trans. 2000;28:51-56. [PubMed] [DOI] |
| 5. | Krajewski S, Krajewska M, Shabaik A, Miyashita T, Wang HG, Reed JC. Immunohistochemical determination of in vivo distribution of Bax, a dominant inhibitor of Bcl-2. Am J Pathol. 1994;145:1323-1336. [PubMed] |
| 6. | Miyashita T, Krajewski S, Krajewska M, Wang HG, Lin HK, Liebermann DA, Hoffman B, Reed JC. Tumor suppressor p53 is a regulator of bcl-2 and bax gene expression in vitro and in vivo. Oncogene. 1994;9:1799-1805. [PubMed] |
| 7. | Selvakumaran M, Lin HK, Miyashita T, Wang HG, Krajewski S, Reed JC, Hoffman B, Liebermann D. Immediate early up-regulation of bax expression by p53 but not TGF beta 1: a paradigm for distinct apoptotic pathways. Oncogene. 1994;9:1791-1798. [PubMed] |
| 8. | Ogura E, Senzaki H, Yamamoto D, Yoshida R, Takada H, Hioki K, Tsubura A. Prognostic significance of Bcl-2, Bcl-xL/S, Bax and Bak expressions in colorectal carcinomas. Oncol Rep. 1999;6:365-369. [PubMed] |
| 12. | Clarke AR, Purdie CA, Harrison DJ, Morris RG, Bird CC, Hooper ML, Wyllie AH. Thymocyte apoptosis induced by p53-dependent and independent pathways. Nature. 1993;362:849-852. [PubMed] [DOI] |
| 13. | Oltvai ZN, Milliman CL, Korsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell. 1993;74:609-619. [PubMed] [DOI] |
| 14. | Sato Y, Nio Y, Song MM, Sumi S, Hirahara N, Minari Y, Tamura K. p53 protein expression as prognostic factor in human pancreatic cancer. Anticancer Res. 1997;17:2779-2788. [PubMed] |
| 15. | Dergham ST, Dugan MC, Joshi US, Chen YC, Du W, Smith DW, Arlauskas P, Crissman JD, Vaitkevicius VK, Sarkar FH. The clinical significance of p21(WAF1/CIP-1) and p53 expression in pancreatic adenocarcinoma. Cancer. 1997;80:372-381. [PubMed] [DOI] |
| 16. | Mäkinen K, Loimas S, Hakala T, Eskelinen M. Tumour suppressor protein (p53), apoptosis inhibiting protein (Bcl-2) and proliferating cell nuclear antigen (PCNA) expressions in a rat pancreatic tumour model. Anticancer Res. 2007;27:23-26. [PubMed] |
| 17. | Lee TL, Yeh J, Friedman J, Yan B, Yang X, Yeh NT, Van Waes C, Chen Z. A signal network involving coactivated NF-kappaB and STAT3 and altered p53 modulates BAX/BCL-XL expression and promotes cell survival of head and neck squamous cell carcinomas. Int J Cancer. 2008;122:1987-1998. [PubMed] [DOI] |
| 18. | Wincewicz A, Sulkowska M, Koda M, Sulkowski S. Cumulative expression of HIF-1-alpha, Bax, Bcl-xL and P53 in human colorectal cancer. Pathology. 2007;39:334-338. [PubMed] [DOI] |
| 19. | Baltaziak M, Duraj E, Koda M, Wincewicz A, Musiatowicz M, Kanczuga-Koda L, Szymanska M, Lesniewicz T, Musiatowicz B. Expression of Bcl-xL, Bax, and p53 in primary tumors and lymph node metastases in oral squamous cell carcinoma. Ann N Y Acad Sci. 2006;1090:18-25. [PubMed] [DOI] |
| 20. | Han HS, Park YM, Hwang TS. Differential expression of Bcl-2, Bcl-XL and p53 in colorectal cancer. J Gastroenterol Hepatol. 2006;21:1108-1114. [PubMed] [DOI] |
| 21. | Shinoura N, Yoshida Y, Asai A, Kirino T, Hamada H. Relative level of expression of Bax and Bcl-XL determines the cellular fate of apoptosis/necrosis induced by the overexpression of Bax. Oncogene. 1999;18:5703-5713. [PubMed] [DOI] |
| 22. | Shinoura N, Hamada H. Gene therapy using an adenovirus vector for apoptosis-related genes is a highly effective therapeutic modality for killing glioma cells. Curr Gene Ther. 2003;3:147-153. [PubMed] [DOI] |
| 23. | Rezende AC, Vieira AS, Rogério F, Rezende LF, Boschero AC, Negro A, Langone F. Effects of systemic administration of ciliary neurotrophic factor on Bax and Bcl-2 proteins in the lumbar spinal cord of neonatal rats after sciatic nerve transection. Braz J Med Biol Res. 2008;41:1024-1028. [PubMed] |
| 24. | Gillardon F, Klimaschewski L, Wickert H, Krajewski S, Reed JC, Zimmermann M. Expression pattern of candidate cell death effector proteins Bax, Bcl-2, Bcl-X, and c-Jun in sensory and motor neurons following sciatic nerve transection in the rat. Brain Res. 1996;739:244-250. [PubMed] [DOI] |
| 25. | Morissette MC, Vachon-Beaudoin G, Parent J, Chakir J, Milot J. Increased p53 level, Bax/Bcl-x(L) ratio, and TRAIL receptor expression in human emphysema. Am J Respir Crit Care Med. 2008;178:240-247. [PubMed] [DOI] |
| 26. | Lee TL, Yeh J, Friedman J, Yan B, Yang X, Yeh NT, Van Waes C, Chen Z. A signal network involving coactivated NF-kappaB and STAT3 and altered p53 modulates BAX/BCL-XL expression and promotes cell survival of head and neck squamous cell carcinomas. Int J Cancer. 2008;122:1987-1998. [PubMed] [DOI] |
| 27. | Sirzén F, Zhivotovsky B, Nilsson A, Bergh J, Lewensohn R. Higher spontaneous apoptotic index in small cell compared with non-small cell lung carcinoma cell lines; lack of correlation with Bcl-2/Bax. Lung Cancer. 1998;22:1-13. [PubMed] [DOI] |
| 28. | Tang ZY, Wu YL, Gao SL, Shen HW. Effects of the proteasome inhibitor bortezomib on gene expression profiles of pancreatic cancer cells. J Surg Res. 2008;145:111-123. [PubMed] [DOI] |
| 29. | Cao D, Ashfaq R, Goggins MG, Hruban RH, Kern SE, Iacobuzio-Donahue CA. Differential Expression of Multiple Genes in Association with MADH4/DPC4/SMAD4 Inactivation in Pancreatic Cancer. Int J Clin Exp Pathol. 2008;1:510-517. [PubMed] |