修回日期: 2009-01-06
接受日期: 2009-01-12
在线出版日期: 2009-02-08
目的: 探讨氯膦酸二钠脂质体(liposomal clodronate, LC)的制备及对大鼠腹腔巨噬细胞(peritoneal macrophages, PM)功能的影响.
方法: 利用薄膜法制备LC; 分离培养大鼠PM, 用不同浓度的LC(50, 100, 150 µmol/L)分别作用于大鼠PM, 然后采用MTT比色法, 中性红比色法, 检测NO, O2-和H2O2的含量来评估巨噬细胞功能.
结果: 在三种不同浓度LC的干预下, MTT结果显示巨噬细胞的生长受到明显抑制(P<0.01);巨噬细胞吞噬中性红结果表明其吞噬功能受到明显抑制, 抑制率分别为17.4%, 25.8%和38.0%; 巨噬细胞分泌NO、O2-的能力也受到明显抑制, 与对照组相比差异具有显著性(48.398±0.667, 27.664±0.566, 25.626±0.184 vs 91.714±1.726; 0.289±0.017, 0.256±0.013, 0.216±0.003 vs 0.342±0.022, 均P<0.05); 巨噬细胞产生H2O2的能力仅在100 µmol/L与150 µmol/L时受到明显抑制(0.261±0.002, 0.213±0.015 vs 0.277±0.003, 均P<0.05).
结论: LC对大鼠PM功能具有抑制作用.
引文著录: 张建新, 尹江涛, 党胜春, 崔磊. 氯膦酸二钠脂质体对大鼠腹腔巨噬细胞功能的影响. 世界华人消化杂志 2009; 17(4): 347-351
Revised: January 6, 2009
Accepted: January 12, 2009
Published online: February 8, 2009
AIM: To explore the way of preparing liposomal clodronate and to investigate its influence of liposomal clodronate, upon peritoneal macrophages in rats.
METHODS: Liposomal clodronate was prepared by means of thin film; the peritoneal macrophages were obtained from rats. After exposure to different concentrations of LC (50, 100, 150 µmol/L), contents of NO, O2- and H2O2 were determined by MTT and neutral red colorimetry to evaluate the function of peritoneal macrophages.
RESULTS: MTT colorimetry showed that the growth of peritoneal macrophages were markedly depressed with different concentrations of liposomal clodronate (P < 0.01), neutral red colorimetry indicated the function of phagocytosis was manifestly restrained, and the inhibition ratio were 17.4%, 25.8% and 38.0%, respectively. The ability of secreting NO and O2- by peritoneal macrophages was significantly inhibited (48.398 ± 0.667, 27.664 ± 0.566, 25.626 ± 0.184 vs 91.714 ± 1.726; 0.289 ± 0.017, 0.256 ± 0.013, 0.216 ± 0.003 vs 0.342 ± 0.022, all P < 0.05). The ability of secreting H2O2 by peritoneal macrophages was inhibited obviously at 100 µmol/L and 150 µmol/L (0.261 ± 0.002, 0.213 ± 0.015 vs 0.277 ± 0.003, all P < 0.05).
CONCLUSION: Liposomal clodronate could inhibit the function of peritoneal macrophages in rats.
- Citation: Zhang JX, Yin JT, Dang SC, Cui L. Influence of liposomal clodronate upon peritoneal macrophages in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(4): 347-351
- URL: https://www.wjgnet.com/1009-3079/full/v17/i4/347.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i4.347
腹腔中(胰腺周围, 大网膜, 腹膜)常驻巨噬细胞约占全身单核/巨噬细胞总数的8%, 对腹腔炎症反应和免疫防御功能有重要作用. 氯膦酸二钠(clodronate disodium)是一种人工合成的双膦酸酯, 多用于治疗骨质疏松等引起的骨质改变, 其机制之一是形成具有毒性作用的ATP类似物, 从而导致细胞内能量代谢障碍, 引起破骨细胞凋亡, 进而减轻破骨细胞对骨质的吸收[1]. 自20世纪60年代开始, 脂质体就作为药物载体开始应用, 近年来随着生物技术的发展, 脂质体作为药物载体的研究越来越受到人们的重视[2]. 由于脂质体具有类似细胞膜的结构, 进入人体以后主要被内皮网状系统吞噬而激活机体的自身免疫功能, 并改变被包封药物的体内分布, 使药物主要在肝、脾、肺、骨骼等组织器官中蓄积[3-4]. 因此, 我们利用脂质体的该作用介导氯膦酸二钠进入大鼠体内PM中, 观测其对PM功能的影响, 为临床相关疾病治疗提供新的技术方法和试验理论依据.
Sprague-Dawley大鼠, 体质量200-250 g, 由江苏大学医学院实验动物中心提供. 氯膦酸二钠购自上海伟进生物科技有限公司; 胎牛血清购自Gibgo公司; 辣根过氧化物酶、细胞色素C、噻唑蓝购自Sigma公司; 酵母聚糖购自BBI公司.
1.2.1 LC的制备使用: 采用van Rooijen et al的方法[5]制备大直径多层脂质体并加以改进: 事先准备膦脂酰胆碱(phosphatidylcholine)的氯仿溶液, 浓度为100 g/L, -20℃避光保存备用. 使用500 mL的梨形烧瓶, 将8 mg胆固醇(cholesterin)溶解在10 mL氯仿中. 加入0.86 mL储备的膦脂酰胆碱溶液(含有膦脂酰胆碱86 mg 37℃低真空(逐渐从200 mbar减少到150 mbar)旋转(150 r/min)蒸馏除去氯仿. 最后在梨形瓶内壁形成稀薄均匀的乳白色膦脂膜. 随后用0.6 mol/L(2.5 g氯膦酸二钠溶解在10 mL膦酸缓冲液中)的氯膦酸二钠膦酸缓冲盐(PBS)溶液洗脱、扩散膦脂膜, 形成乳白色悬液. 乳白色悬液在室温下通氮气保存2 h(防止膦脂膜的氧化), 在水浴声波震荡器中震荡3 min后再在室温下保存2 h, 使脂质体膨胀. 使用无菌的PBS清洗脂质体2-3次, 除去未被包裹的氯膦酸二钠. 最后沉淀的脂质体小块在4 mL的PBS中再次悬浮, 形成乳白色的胶体溶液, 这时候可供使用的LC就制成了. 这种方法能使氯膦酸二钠溶液中大约1%的氯膦酸二钠被包裹到了脂质体中, 最后获得的LC悬液(4 mL)大约含有20 mg的氯膦酸二钠.
1.2.2 大鼠PM的分离和培养: 取大鼠, 消毒腹腔并注射5 mL无菌的液体石蜡. 3 d后收集腹腔细胞. 引颈处死大鼠, 将其浸入700 mL/L乙醇中5 min, 固定四肢, 剪开腹部皮肤, 沿腹中线注入50 mL冰中预冷的无菌PBS-H(含10 kU/L肝素和100 mL/L小牛血清的PBS). 轻轻按摩腹部5 min. 剪开腹壁, 用吸管吸出渗出液, 再用同样容量的预冷PBS-H冲洗腹腔3次. 合并渗出液于离心管中, 4℃ 2500 r/min离心10 min, 去上清液. 用预冷的RPMI 1640培养液洗涤细胞3次, 每次4℃ 2500 r/min离心10 min, 去上清液. 用预冷的适量RPMI 1640培养液悬浮细胞. 调整细胞浓度为5×108个/L, 接种至无菌6孔细胞培养板上, 在37℃、50 mL/L CO2孵箱孵育2 h, RPMI 1640培养液洗涤3次, 去非贴壁细胞, 经瑞氏染色法鉴定巨噬细胞纯度>90%; 台盼蓝染色, 细胞存活率>95%.
1.2.3 MTT比色法: 参照文献[6]接种细胞: 用含100 mL/L胎牛血清的培养液配成单个PM悬液, 以每孔1×104个细胞接种至96孔板, 每孔体积200 μL; 培养细胞: 在37℃、50 mL/L CO2孵箱孵育2 h; 加药: 随后加入不同浓度的LC; 呈色: 分别培养12、24和36 h后, 每孔加MTT溶液(5 g/L, 用PBS配制, pH7.4)20 μL, 继续孵育4 h, 终止培养, 小心吸弃孔内培养上清液, 然后每孔加150 μL DMSO, 振荡10 min, 使结晶物充分融解; 比色: 选择490 nm波长, 在酶联免疫监测仪上测定各孔光吸收值, 记录结果. 本实验重复3次.
1.2.4 吞噬功能测定: 取1 mL 2×109/L PM加入24孔板内, 置37℃、50 mL/L CO2条件下贴壁2 h, 加入不同浓度LC, 培养一定时间后取出弃上清, 漂洗, 再加入0.1%中性红盐水液1 mL, 置37℃、50 mL/L CO2条件下培养20 min, 取出, 弃上清, 漂洗, 加入1 mL细胞溶解液(乙醇∶乙酸 = 1∶1), 充分溶解后于540 nm波长处比色. 本实验重复3次.
1.2.5 NO的诱生及测定: 取1 mL 2×109/L PM加入24孔板内, 置37℃、50 mL/L CO2条件下贴壁2 h, 加入不同浓度LC, 培养一定时间后取出弃上清, 漂洗后再每孔加入1 mL RPMI 1640培养液, 同时加入LPS, 使其终浓度为5 mg/L. 置37℃、50 mL/L CO2条件下培养24 h, 取出上清至试管内, 向试管内加入1 mL Greiss液(0.1% N-a-萘基乙二胺, 1%磺胺, 3% H3PO4, 显色10 min, 于540 nm波长处比色.
1.2.6 H2O2的测定: 取0.7 mL 1×109/L大鼠PM置于24孔板内, 置37℃、50 mL/L CO2条件下贴壁2 h, 加入不同浓度LC, 培养一定时间后取出, 加入0.15 mL(1 g/L)辣根过氧化物酶, 0.15 mL(1 g/L)酚红液, 0.1 mL(10 g/mL)经血清调理后的酵母聚糖, 于37℃水浴2 h, 取出置于冰浴中, 经2000 r/min离心10 min, 取上清加入PBS 2 mL, 再加入4 mol/L NaOH 40 µL, 于570 nm波长处比色.
1.2.7 O2-的测定: 取1 mL 1×109/L PM加入24孔板内, 加入不同浓度LC, 于37℃保温5 min, 加入0.1 mL(10 g/L)经血清调理后的酵母聚糖, 再加入细胞色素C(终浓度为60 µmol/L). 于37℃水浴2 h, 取出, 置于冰浴中, 经 2000 r/min离心10 min, 取上清加入PBS 1 mL, 于550 nm波长处比色.
统计学处理 采用SPSS11.5统计软件进行数据分析, 所有数据均用mean±SD表示, 采用ANOVA程序进行单因素方差分析、Univariate程序进行多因素方差分析, P<0.05表示差异具有显著性.
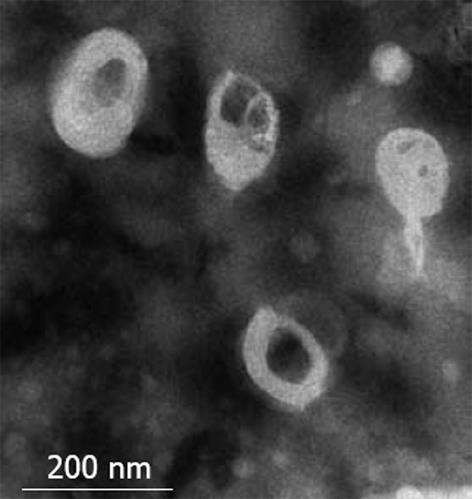
所制备的脂质体平均直径约200 nm, 包裹率为5.8%, 透射电镜检查见其大小均匀(图1).
在各时间段三种不同浓度的LC对PM的生长都具有明显的抑制作用(P<0.01), 36 h组的各浓度抑制率均高于12 h与24 h组(表1); 同时, LC在同一浓度的不同时间段上对PM的生长亦具有明显的抑制作用, 150 µmol/L组的各时点抑制率均高于50 µmol/L与100 µmol/L组(表1). 该实验中, LC对大鼠PM的抑制作用随作用时间的延长而增高, 亦随LC浓度的升高而增高. 本实验重复3次, 所有数值均以mean±SD表示(P<0.01, 表1).
不同浓度的LC对巨噬细胞的吞噬功能有不同程度的抑制, 且随浓度增加, 抑制率也逐渐增高, 在LC浓度为150 µmol/L时, 大鼠PM的吞噬功能受到最大程度的抑制, 为38.0%. 本实验重复3次, 所有数值均以mean±SD表示(表2).
3种浓度的LC对巨噬细胞生成NO、O2-的能力都产生抑制, 在LC浓度为150 µmol/L时, PM产生NO和O2-的能力最低, 与对照组相比差异均有显著性; 100 µmol/L和150 µmol/L的LC对巨噬细胞产生的H2O2出现明显抑制, 在LC浓度为150 µmol/L时, PM产生H2O2的能力达到最低, 与对照组相比差异有显著性, 而50 µmol/L的LC组未见明显抑制, 但随着LC浓度的增高, H2O2产生的量逐渐减少(表3).
腹腔巨噬细胞参与机体内的多种病理生理反应, 对腹腔炎症反应和免疫防御功能有重要作用. Ma et al[7]研究发现, 使用白藜芦醇(resveratrol)后可以减少体外培养的PM的NF-kappa与iNOS的表达, 减少培养基与血清TNF-α, IL-1与NO的水平, 从而减轻炎症反应. 活体实验也证实, 干预巨噬细胞可以减轻胰腺炎的严重程度. PM可以通过分泌大量的TNF-α和IL-1β等细胞因子影响炎症的严重程度[8].
近年来脂质体作为药物载体被广泛应用, 利用脂质体的天然靶向性将药物导人单核内皮网状系统, 借助脂质体缓释作用可以延长药物的作用时间和提高体内药物的浓度, 从而提高疗效[9-10]. 近年来越来越多的脂质体药物已上市, 并在临床取得了明显的疗效, 如阿霉素脂质体、紫杉醇脂质体等[11-12]. Van Rooijen et al[13]报道, 静脉内注射LC可以选择性的清除体内巨噬细胞, 巨噬细胞通过吞噬作用摄取脂质体, 其膦脂酶破坏脂质体的膦脂双分子层, 药物在细胞内释放从而诱导了巨噬细胞的凋亡, 游离的氯膦酸二钠本来是用于治疗骨质疏松等骨疾病的药物, 没有明显的细胞毒性, 而用于包埋的脂质体成分是卵膦脂和胆固醇, 也没有毒性, 有望成为临床治疗某些疾病的手段. 目前, LC被广泛应用于巨噬细胞功能的研究[14-15]和治疗某些免疫性疾病的实验研究[16].
MTT是一种有机盐染料, 与细胞内具有活性的琥珀酸脱氢酶起反应, 生成紫色(或蓝色)甲瓒颗粒, 因琥珀酸脱氢酶只存在于活细胞线粒体内, 故有较好的特异性, 本实验发现, 三种不同浓度的LC均对大鼠PM的生长具有明显的抑制作用, LC被巨噬细胞选择性的摄取后, 溶酶体释放的膦脂酶分解脂质体使其被释放出来, 导致巨噬细胞凋亡, 从而减弱其非特异性防御能力.
中性红比色法主要是通过细胞的胞吞作用来检测细胞增殖功能和毒性作用, 中性红属于一种弱阳离子染料, 正常生长的细胞具有摄取中性红的能力, 并且中性红可以稽留溶酶体内而不被细胞洗涤液洗脱, 在一定条件下, 活细胞摄入中性红的水平与活细胞的数量成正比. 本实验中, 我们发现在三种不同浓度的LC干预下, 巨噬细胞吞噬中性红的能力受到明显抑制, 巨噬细胞的吞噬在其非特异性免疫、抗原递呈等过程中起着重要作用, 因此, LC对PM的非特异性免疫作用产生抑制, 削弱了腹腔的抗菌能力, 使腹腔防御能力下降.
在免疫系统中, 巨噬细胞起着调节体内稳定的作用, 是感染、肿瘤生长和创伤的效应细胞. 巨噬细胞内NO是通过NOS途径合成, 其合成能力与抗炎作用密切相关. 研究中观察到, LC在三种浓度下均对大鼠PM生成NO的能力产生抑制, 而巨噬细胞产生的NO作为一种非特异效应因子, 可杀灭或抑制多种病原微生物的生长, 尤其是杀灭细胞内病原体[17]. 我们还发现, 在LC浓度为100 µmol/L和150 µmol/L时, 巨噬细胞产生H2O2的能力受到明显的抑制, H2O2在巨噬细胞杀灭入侵病原微生物方面起着重要作用[18], 其机制有二, 其一是激活Ced23等死亡基因, 从而使细胞死亡; 另一种是先激活Ced23等死亡基因, 从而使细胞内H2O2水平升高, 由于H2O2的损伤作用而使细胞死亡. 本实验中, 在LC作用下, 大鼠PM产生O2-的能力亦受到抑制, O2-在机体内具有多种作用: O2-可攻击生物膜中多聚不饱和脂肪酸, 尤其是其中对自由基特别敏感的双键, 激发连锁反应, 导致自由基的扩增和膜脂质过氧化加深, 致使细胞凋亡, 可以直接进攻蛋白质中的氨基酸残基如甲硫氨酸和半胱氨酸等残基, 使蛋白质构象改变, 影响其活性[19]. O2-及其过氧化产物可直接或间接地攻击DNA, 引起碱基修饰、单或双链断裂、DNA链间以及DNA与蛋白质间的交叉连接和姐妹染色体交换等, 而以碱基修饰和链的断裂最为常见. O2-通过对mtDNA的损伤可降低ATP酶活性, 抑制线粒体的氧化膦酸化, 使能量物质的生成减少, 加速高能膦酸化合物的消耗, 致细胞死亡[20-21].
总之, LC具有抑制大鼠PM功能的作用, 对临床某些疾病的治疗具有一定的指导意义, 如胰腺炎, 脓毒血症等.
重症急性胰腺炎、脓毒血症等是临床上比较常见的疾病, 其发病机制复杂, 病情严重、进展较快、死亡率高. 主要死亡原因为全身炎症反应综合征及多器官功能障碍综合征. 目前尚缺乏有效的治疗手段, 巨噬细胞在其中发挥着重要作用, 其分泌多种细胞因子从而加速炎症反应的进程. 本文利用脂质体包裹特异性巨噬细胞清除剂clodronate抑制巨噬细胞功能, 为临床治疗重症急性胰腺炎等提供理论依据.
唐霓, 副研究员, 重庆医科大学病毒性肝炎研究所国家级重点实验室
目前国内外治疗重症急性胰腺炎、脓毒血症等大都是抗炎、抑制胰腺分泌等. 本研究利用脂质体包裹特异性巨噬细胞清除剂clodronate进入巨噬细胞内发挥作用, 在国内外均不多见. 随着脂质体药物的面世越来越多, 该领域的研究将被更大程度的关注.
Van Rooijen et al报道, 静脉内注射氯膦酸二钠脂质体可以选择性的清除体内巨噬细胞, 巨噬细胞通过吞噬作用摄取脂质体, 其膦脂酶破坏脂质体的膦脂双分子层, 药物在细胞内释放从而诱导了巨噬细胞的凋亡.
本研究通过脂质体包裹特异性巨噬细胞清除剂clodronate来抑制巨噬细胞功能, 从细胞生长、吞噬功能及巨噬细胞分泌自由基等方面入手研究, 以期为临床治疗重症急性胰腺炎等寻找新的途径并提供理论依据.
国外目前已有多种脂质体药物面世, 应用价值之高, 得到了业内人士较好的评价, 如紫杉醇脂质体等. 本研究从一个新的方面着手治疗重症急性胰腺炎、脓毒血症等, 值得期待.
本文拟探讨氯膦酸二钠脂质体的制备及对大鼠腹腔巨噬细胞功能的影响, 创新性较强, 总体实验设计合理, 数据详实可靠.
编辑: 李军亮 电编:何基才
| 1. | Frith JC, Mönkkönen J, Blackburn GM, Russell RG, Rogers MJ. Clodronate and liposome-encapsulated clodronate are metabolized to a toxic ATP analog, adenosine 5'-(beta, gamma-dichloromethylene) triphosphate, by mammalian cells in vitro. J Bone Miner Res. 1997;12:1358-1367. [PubMed] [DOI] |
| 2. | Batist G, Ramakrishnan G, Rao CS, Chandrasekharan A, Gutheil J, Guthrie T, Shah P, Khojasteh A, Nair MK, Hoelzer K. Reduced cardiotoxicity and preserved antitumor efficacy of liposome-encapsulated doxorubicin and cyclophosphamide compared with conventional doxorubicin and cyclophosphamide in a randomized, multicenter trial of metastatic breast cancer. J Clin Oncol. 2001;19:1444-1454. [PubMed] |
| 3. | Yamamoto T, Naito M, Moriyama H, Umezu H, Matsuo H, Kiwada H, Arakawa M. Repopulation of murine Kupffer cells after intravenous administration of liposome-encapsulated dichloromethylene diphosphonate. Am J Pathol. 1996;149:1271-1286. [PubMed] |
| 5. | van Rooijen N, van Kesteren-Hendrikx E. "In vivo" depletion of macrophages by liposome-mediated "suicide". Methods Enzymol. 2003;373:3-16. [PubMed] [DOI] |
| 6. | 麦 玉洁, 邱 录贵, 李 增军, 李 新, 于 珍, 李 长虹, 王 亚非, 李 茜. β-catenin特异的RNA干扰对Jurkat和K562细胞的作用. 中国医学科学院学报. 2008;30:290-295. |
| 7. | Ma ZH, Ma QY, Wang LC, Sha HC, Wu SL, Zhang M. Effect of resveratrol on peritoneal macrophages in rats with severe acute pancreatitis. Inflamm Res. 2005;54:522-527. [PubMed] [DOI] |
| 8. | 马 振华, 马 清涌, 沙 焕臣, 王 连才, 张 梅. 腹腔巨噬细胞在大鼠重症急性胰腺炎发病机制中的作用. 西安交通大学学报(医学版). 2006;27:590-592, 601. |
| 9. | Huwyler J, Drewe J, Krähenbuhl S. Tumor targeting using liposomal antineoplastic drugs. Int J Nanomedicine. 2008;3:21-29. [PubMed] [DOI] |
| 10. | Schnyder A, Huwyler J. Drug transport to brain with targeted liposomes. NeuroRx. 2005;2:99-107. [PubMed] [DOI] |
| 11. | Straubinger RM, Arnold RD, Zhou R, Mazurchuk R, Slack JE. Antivascular and antitumor activities of liposome-associated drugs. Anticancer Res. 2004;24:397-404. [PubMed] |
| 12. | Park JW. Liposome-based drug delivery in breast cancer treatment. Breast Cancer Res. 2002;4:95-99. [PubMed] [DOI] |
| 13. | van Rooijen N, Sanders A, van den Berg TK. Apoptosis of macrophages induced by liposome-mediated intracellular delivery of clodronate and propamidine. J Immunol Methods. 1996;193:93-99. [PubMed] [DOI] |
| 14. | Romberg B, Oussoren C, Snel CJ, Hennink WE, Storm G. Effect of liposome characteristics and dose on the pharmacokinetics of liposomes coated with poly(amino acid)s. Pharm Res. 2007;24:2394-2401. [PubMed] [DOI] |
| 15. | Immordino ML, Dosio F, Cattel L. Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential. Int J Nanomedicine. 2006;1:297-315. [PubMed] [DOI] |
| 16. | Mathes M, Jordan M, Dow S. Evaluation of liposomal clodronate in experimental spontaneous autoimmune hemolytic anemia in dogs. Exp Hematol. 2006;34:1393-1402. [PubMed] [DOI] |
| 18. | 赖 桂华, 邱 小忠, 余 磊, 焦 培峰, 陆 云涛, 欧阳 钧. 氧化应激对C2C12成肌细胞增殖与凋亡的影响. 中国组织工程研究与临床康复. 2007;11:278-281. |
| 19. | 黄 波, 邹 国林, 金 德龙, 李 海成. 阿霉素及其铁配合物介导牛血清白蛋白氧化损伤. 生物化学与生物物理学报. 2003;35:301-305. |
| 20. | Sharp JS, Tomer KB. Analysis of the oxidative damage-induced conformational changes of apo- and holocalmodulin by dose-dependent protein oxidative surface mapping. Biophys J. 2007;92:1682-1692. [PubMed] [DOI] |
| 21. | Vladimirova O, O'Connor J, Cahill A, Alder H, Butunoi C, Kalman B. Oxidative damage to DNA in plaques of MS brains. Mult Scler. 1998;4:413-418. [PubMed] |