修回日期: 2009-11-20
接受日期: 2009-11-30
在线出版日期: 2009-12-28
目的: 探讨转录辅抑制因子CtBP1在结肠腺癌中的表达状况及对其靶基因E-cadherin表达的影响.
方法: 采用免疫组织化学染色方法检测结肠癌及癌旁组织中CtBP1及E-cadherin的表达.
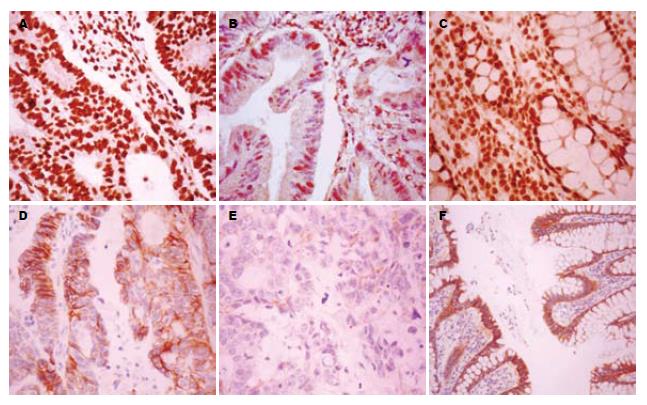
结果: CtBP1在结肠癌组织及癌旁组织中表达阳性率分别为96.25%(77/80)和100%(80/80); E-cadherin在结肠癌组织及癌旁组织中表达率分别为32.50%(26/80)和100%(80/80), 且与肿瘤浸润深度相关; CtBP1在结肠癌中表达与E-cadherin不相关.
结论: CtBP1对其靶基因E-cadherin表达的抑制并不是由CtBP1的异常表达介导的.
引文著录: 肖胜军, 张小玲, 容明智, 方宇, 曾思恩. 转录辅抑制因子CtBP1与其靶基因E-cadherin在结肠腺癌中的表达. 世界华人消化杂志 2009; 17(36): 3756-3759
Revised: November 20, 2009
Accepted: November 30, 2009
Published online: December 28, 2009
AIM: To investigate the expression of transcriptional corepressor C-terminal-binding protein 1 (CtBP1) and its target gene E-cadherin in colon adenocarcinoma.
METHODS: The expression of CtBP1 and E-cadherin proteins in colon adenocarcinoma and paired non-neoplastic tissue was assessed by immunohistochemistry.
RESULTS: The positive rates of CtBP1 expression in colon adenocarcinoma and paired non-neoplastic tissue were 96.25% (77/80) and 100% (80/80), respectively. The positive rates of E-cadherin expression in colon adenocarcinoma and paired non-neoplastic tissue were 32.50% (26/80) and 100% (80/80), respectively. The expression of E-cadherin was associated with tumor invasion depth in colon adenocarcinoma. The expression of CtBP1 was not associated with E-cadherin expression in colon adenocarcinoma.
CONCLUSION: The transcriptional repression function of CtBP1 does not mediate the dysregulated expression of E-cadherin in colon adenocarcinoma.
- Citation: Xiao SJ, Zhang XL, Rong MZ, Fang Y, Zeng SE. Expression of transcriptional corepressor CtBP1 and its target gene E-cadherin in colon adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(36): 3756-3759
- URL: https://www.wjgnet.com/1009-3079/full/v17/i36/3756.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i36.3756
羧基末端结合蛋白(C-terminal-binding proteins, CtBPs)是进化上保守的转录辅抑制因子. 有研究表明CtBPs与肿瘤发生和进展相关[1], CtBPs能促进上皮-间质转化(epithelial-mesenchymal transition, EMT)并作为凋亡拮抗剂, 参与对多个肿瘤抑制基因的抑制[1]. 上皮型钙黏蛋白(E-cadherin)表达缺失是多种上皮性肿瘤EMT的特征性分子事件, CtBP介导的E-cadherin抑制显示其在促进肿瘤EMT中的重要作用. EMT是导致肿瘤细胞恶性特征的一个步骤: 失去肿瘤的细胞黏附分子、获得迁移和侵蚀表型、凋亡抗性等. 在模式细胞研究中发现, 人结肠癌中高水平的Zeb1和CtBP1表达与低水平的E-cadherin相关, 并认为他是结肠癌治疗的潜在靶点[2]. 本研究旨在调查CtBP1在结肠癌组织中原位表达状况及其对E-cadherin表达的影响.
收集2006-2009桂林医学院附属医院手术切除结肠癌标本80例, 其中男49例, 女31例, 伴淋巴结转移者33例, 淋巴结无转移者47例. 患者年龄25-88(平均60.8)岁. 病理诊断均为腺癌. 其中高分化腺癌24例, 中分化腺癌42例, 低分化腺癌14例. 患者术前均未作过放化疗. 鼠抗人CtBP1单克隆抗体(浓缩型, 1:100稀释, Santa Cruz公司, sc-17805); E-cadherin(浓缩型, 1:50稀释, Santa Cruz公司, sc-52328); 二抗(小鼠超敏二步法免疫组化检测试剂盒, 北京中杉金桥生物技术有限公司, PV-9005).
1.2.1 组织芯片制备: 根据HE切片在供体组织蜡块上选取肿瘤组织区域和癌旁正常组织区域并标记; 其中每个肿瘤组织标本重复取2个点, 癌旁正常组织取1个点, 每个孔芯的直径1.5 mm, 将相应组织由供体蜡块转移至受体蜡块的阵列孔中, 制作芯片蜡块2个, 每个蜡块含有121个点(1个为标志点).
1.2.2 免疫组织化学染色及结果评价: 组织芯片蜡块4 μm连续切片, 60 ℃烤片1 h, 二甲苯脱蜡, 梯度酒精脱后水化, 高压热修复(柠檬酸pH6.0, 3 min), 其他步骤按试剂说明书进行, DAB显色镜下控制, 苏木素复染. 以PBS代替一抗作阴性对照. CtBP1: 大于75%细胞核棕黄色为阳性, 细胞核阳性小于75%和/或不着色为阴性. E-cadherin: 大于25%的细胞细胞膜完整着色为阳性. 经3位临床病理医生阅片后计分.
统计学处理 采用SPSS11.5对相关数据进行处理, 组间各指标比较采用Pearson卡方检验, P<0.05表示存在统计学意义.
CtBP1在细胞核中表达, 结肠腺癌组织及癌旁组织中表达率分别为96.25%(77/80)和100%(80/80); E-cadherin在细胞膜和细胞质中表达, 癌组织及癌旁组织中表达率分别为32.50%(26/80)和100%(80/80). CtBP1、E-cadherin在癌组织和癌旁组织中的表达见图1.
结肠癌组织中E-cadherin表达与年龄、性别、肿瘤分级、淋巴结转移没有相关性, 而与浸润深度相关, E-cadherin表达阴性浸润深度较深(P = 0.033, 表1).
| 临床病理特征 | n | E-cadherin表达(n) | χ2值 | P值 | |
| 阳性 | 阴性 | ||||
| 年龄(岁) | |||||
| <60 | 37 | 14 | 23 | 0.894 | 0.240 |
| ≥60 | 43 | 12 | 31 | ||
| 性别 | |||||
| 男 | 49 | 19 | 30 | 2.270 | 0.103 |
| 女 | 31 | 7 | 24 | ||
| 分级 | |||||
| 高中分化 | 66 | 21 | 45 | 0.080 | 0.503 |
| 低分化 | 14 | 5 | 9 | ||
| 淋巴结转移 | |||||
| 有转移 | 47 | 15 | 32 | 1.675 | 0.151 |
| 无转移 | 33 | 11 | 22 | ||
| 浸润深度 | |||||
| 肌层及以上 | 39 | 17 | 22 | 4.266 | 0.033 |
| 浆膜及浆膜外 | 41 | 9 | 32 | ||
E-cadherin是一类介导细胞之间相互黏附的钙依赖性跨膜蛋白, 参与形成和维护正常细胞间的连接. 由于E-cadherin是上皮细胞中的黏附分子, 故对维持正常上皮细胞形态和结构完整性起着重要作用, 阳性表达有抑制肿瘤转移的功能[3], 当E-cadherin表达下降或缺失, 细胞间的相互黏附力下降, 造成上皮细胞获得间质细胞的表型: 容易分散而向外周浸润性生长, 一旦获得转移的必要条件, 就可脱离原发灶而发生侵袭和转移[4]. E-cadherin还能抑制肿瘤细胞和宿主细胞产生基质金属蛋白酶(matrix metalloproteinases, MMPs), 阻止肿瘤细胞周围基质和基底膜中的各种蛋白成分的降解, 从而抑制肿瘤细胞突破基质和基底膜屏障[5]. 近年来通过在乳腺癌、甲状腺乳头状癌、食管癌、前列腺癌、大肠癌及鼻咽癌等肿瘤的研究中证实, E-cad表达降低与癌的分化、侵袭和转移有显著的相关性[6-8].
我们的结果显示, E-cadherin在结肠癌中表达缺失, 增加了上皮-间质转化, 使得肿瘤细胞增强了浸润深部组织的能力, 因而与肿瘤的浸润深度相关. E-cadherin阳性和阴性的肿瘤淋巴结转移有一定差异, 但不具有显著意义(P = 0.151); 可能由于肿瘤的淋巴结转移过程除了包括细胞黏附能力下降外, 还有一系列的其他分子事件, 黏附能力的下降只是肿瘤淋巴结转移的首要环节, 因此统计学上并没有意义.
CtBPs与肿瘤发生和进展相关: CtBPs能促进EMT, 并作为凋亡拮抗剂; 参与对多个肿瘤抑制基因的抑制, 并认为CtBPs是肿瘤治疗的一个潜在靶点[1]. 有研究发现, 转录辅抑制因子CtBP能与多种转录因子如Zeb1、Zeb2结合形成转录抑制复合体, Snail等转录因子通过与Zeb1结合后再结合于CtBP从而抑制肿瘤E-cadherin的表达. 在模式细胞研究中, 通过RT-PCR和Western blot检测发现, 人结肠癌细胞中高水平的Zeb1和CtBP1表达与低水平的E-cadherin相关[2]. 我们通过免疫组织化学原位检测发现, 结肠癌组织中CtBP1表达异常率较低3.75%(3/88), 且与E-cadherin表达不相关; 该结果显示, 在结肠癌组织中, CtBP1参与的转录抑制复合物并不是E-cadherin表达缺失的主要异常因素, 而可能是抑制复合物中的其他成分.
总之, 我们的结果显示, E-cadherin表达缺失能增加肿瘤的侵袭能力, 转录辅抑制因子CtBP1并不是结肠腺癌中E-cadherin表达缺失的主要因素.
羧基末端结合蛋白(CtBPs)是进化上保守的转录辅抑制因子, 其参与对多个肿瘤抑制基因的抑制. 而E-cadherin是一类介导细胞之间相互黏附的钙依赖性跨膜蛋白, 参与形成和维护正常细胞间的连接, 其表达缺失是多种上皮性肿瘤EMT的特征性分子事件, CtBP介导的E-cadherin抑制显示其在促进肿瘤EMT中的重要作用.
梅林, 教授, 北京大学医学部生理学与病理生理学系神经调节和消化内分泌研究室
近年来通过在乳腺癌、甲状腺乳头状癌、食管癌、前列腺癌、大肠癌及鼻咽癌等肿瘤的研究中证实, E-cad表达降低与癌的分化、侵袭和转移有显著的相关性.
本研究显示, E-cadherin表达缺失能增加肿瘤的侵袭能力, 转录辅抑制因子CtBP1并不是结肠腺癌中E-cadherin表达缺失的主要因素, 为结肠腺癌的基因治疗提供参考.
本研究内容有一定重要性、科学性和可读性, 但新颖性稍显欠缺.
编辑: 李军亮 电编:何基才
| 1. | Chinnadurai G. The transcriptional corepressor CtBP: a foe of multiple tumor suppressors. Cancer Res. 2009;69:731-734. [PubMed] [DOI] |
| 2. | Grooteclaes ML, Frisch SM. Evidence for a function of CtBP in epithelial gene regulation and anoikis. Oncogene. 2000;19:3823-3828. [PubMed] [DOI] |
| 4. | Gloushankova NA. Changes in regulation of cell-cell adhesion during tumor transformation. Biochemistry (Mosc). 2008;73:742-750. [PubMed] [DOI] |
| 6. | Yap AS, Crampton MS, Hardin J. Making and breaking contacts: the cellular biology of cadherin regulation. Curr Opin Cell Biol. 2007;19:508-514. [PubMed] [DOI] |