修回日期: 2009-11-23
接受日期: 2009-11-30
在线出版日期: 2009-12-28
目的: 探讨P-gp、GST-π和P53的表达与胆囊癌临床病理因素及预后的相关性.
方法: 应用免疫组织化学SP法对术前未经化疗的49例胆囊癌术后标本P-gp、GST-π和P53的表达进行检测, 分析P-gp、GST-π和P53的表达与胆囊癌临床病理因素及预后的相关性.
结果: P-gp、GST-π和P53在胆囊癌组织中的阳性表达率分别为75.5%(37/49)、65.3%(32/49)和69.4%(34/49). P-gp、P53的表达与淋巴结转移情况呈正相关(P<0.05). 临床分期S4、S5期和有淋巴结转移的胆囊癌P53表达率显著高于S1-S3期和淋巴结未转移者(80.0% vs 52.6%, P<0.05). 中低分化胆囊癌的GST-π表达率显著高于高分化及乳头状腺癌(均P<0.05). P-gp和P53的表达之间具有正相关性(r = 0.343, P<0.05). P-gp和GST-π表达阳性者累积生存率显著低于阴性者.
结论: P-gp, GST-π和P53是反映胆囊癌生物学行为的重要指标. 联合检测P-gp和GST-π的表达对胆囊癌预后的判定具有重要的参考价值.
引文著录: 智迎辉, 宋茂民, 龙锦, 郭仁宣. P-gp、GST-π和P53在胆囊癌中的表达及意义. 世界华人消化杂志 2009; 17(36): 3752-3755
Revised: November 23, 2009
Accepted: November 30, 2009
Published online: December 28, 2009
AIM: To investigate the correlations of the expression of P-glycoprotein (P-gp), Glutathione-S-transferase-π (GST-π) and P53 with the clinicopathological features and prognosis of gallbladder carcinoma.
METHODS: Forty-nine patients with gallbladder carcinoma who did not undergo chemotherapy before surgery were included in the study. The expression of P-gp, GST-π and P53 in gallbladder carcinoma was detected by immunohistochemistry. The correlations of P-gp, GST-π and P53 expression with the clinicopathological features and prognosis of gallbladder carcinoma were analyzed.
RESULTS: The positive rates of P-gp, GST-π and P53 expression in gallbladder carcinoma were 75.5% (37/49), 65.3% (32/49), and 69.4% (34/49), respectively. There were positive correlations between P-gp and P53 expression and lymph node metastasis (both P < 0.05). The positive rate of GST-π expression in moderately or poorly differentiated carcinoma was higher than that in well-differentiated carcinoma (P < 0.05). The positive rate of P53 expression was significantly higher in carcinoma at Nevin stage S4-S5 (80.0%) than in that at Nevin stage S-S3 (80.0% vs 52.6%, P < 0.05). A significant correlation was also noted between the expression of P53 and P-gp in gallbladder carcinoma (r = 0.343, P < 0.05). Patients with positive P-gp and GST-π expression had much lower survival rate than those with negative expression.
CONCLUSION: Detection of P-gp, GST-π and P53 expression is of great significance for analyzing clinicopathological features and predicting prognosis of gallbladder carcinoma.
- Citation: Zhi YH, Song MM, Long J, Guo RX. Prognostic significance of P-gp, GST-π and P53 expression in gallbladder carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(36): 3752-3755
- URL: https://www.wjgnet.com/1009-3079/full/v17/i36/3752.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i36.3752
胆囊癌的发生和发展是个体基因表达质变和量变的多基因变化过程, 其确切的机制尚不清楚[1]. P-糖蛋白(P-glycoproteins, P-gp)是多药耐药基因(multidrug resistance-1, MDR-1)过表达产生的一种膜相关糖蛋白, 他能够利用ATP形成疏水通道将抗肿瘤药物泵至细胞外. 胎盘型谷胱甘肽-S-转移酶-π(glutathione-S-transferase-π, GST-π)参与机体解毒作用, 提高肿瘤细胞对化疗药物的抗毒性. 基因水平的研究发现, 突变型P53通过抑制凋亡、促进MDR-1扩增等作用使肿瘤细胞耐药[2]. 胆囊癌恶性程度较高, 化疗效果不佳. 国内外关于胆囊癌中多药耐药相关蛋白变化及多药耐药形成机制方面的研究尚少. 本研究探讨P-gp、GST-π和P53的表达与胆囊癌临床病理因素及预后的相关性.
收集原发性胆囊癌石蜡固定标本49例, 男24例, 女25例, 年龄34-78岁, 男性平均年龄62.0±9.8岁, 女性平均年龄54.5±9.3岁. 病理组织学类型均为腺癌: 高分化16例(32.7%), 中分化17例(34.7%), 低分化10例(20.4%), 另外乳头状腺癌6例, 占12.2%; 依据Nevin分期标准, 临床分期: S1、S2、S3期共19例(38.8%), S4、S5期共30例(61.2%), 有淋巴结转移者27例(55.1%), 无淋巴结转移者22例(44.9%). 所有病例术前均未经放化疗及免疫治疗. 完整随访40例, 随访率为82%(40/49), 随访时间为6-49 mo. 鼠抗人P-gp、GST-π和P53单克隆抗体, SP免疫组织化学试剂盒、DAB显色试剂盒均为福州迈新生物技术开发公司(Maxim Biotechnology, Inc.)产品.
1.2.1 免疫组织化学SP法: 切片脱蜡, 0.3% H2O2甲醇液作用10 min, 抗原热修复, 10%羊血清作用20 min, 滴加一抗过夜, 滴加二抗, 加入辣根标记链霉卵白素液, DAB染色, 苏木精复染, 二甲苯透明, 封片. 以PBS置换一抗作为阴性对照, 以已知阳性切片作为阳性对照.
1.2.2 结果判定: 采用双盲法. 光镜下观察GST-π免疫组织化学染色以肿瘤细胞胞质中出现棕黄色颗粒为阳性细胞, P-gp以肿瘤细胞胞质中或胞膜上出现棕黄色颗粒为阳性细胞, P53为细胞核阳性. 每张切片在400倍光镜下至少观察10个高倍视野, 每个视野记数100个细胞, 按阳性细胞占肿瘤细胞的百分率分级. P-gp和GST-π结果判定分为4个等级: <5%为阴性, 5%-30%为+, 30%-75%为++, >75%为+++. P53结果判定以<10%为阴性, 10%-25%为+, 26%-50%为++, >50%为+++.
统计学处理 应用SPSS10.0软件进行统计学分析, 采用χ2检验, 相关性分析采用Spearman等级相关检验. 术后累积生存率分析采用Kaplan-Meier法, 两组生存期比较采用Logrank检验.
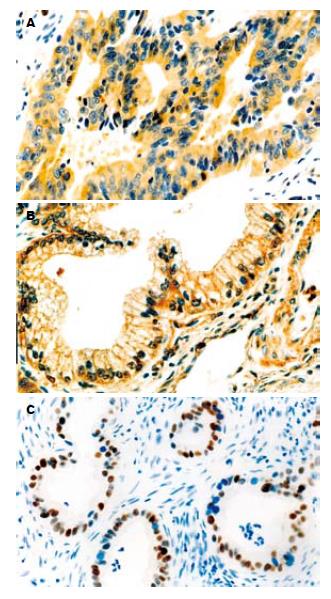
GST-π行免疫组织化学染色后, 阳性产物主要定位于肿瘤细胞胞质中, 呈棕黄色颗粒, 一些内皮细胞也有着色, 其分布呈异质性(图1A). P-gp以肿瘤细胞胞质中或胞膜上出现棕黄色颗粒为阳性细胞, 其分布也呈异质性(图1B). P53为细胞核阳性, 细胞核呈现较为清晰的褐色或棕黄色者为阳性(图1C). 49例胆囊癌组织中P-gp、GST-π和P53阳性表达率分别为75.5%、65.3%和69.4%.
有淋巴结转移组P-gp表达率显著高于无淋巴结转移组(P<0.05, P = 0.016), P-gp的表达与临床分期、组织分化程度无关(P>0.05). 中低分化胆囊癌的GST-π表达率显著高于高分化及乳头状腺癌(P<0.05, P = 0.042), GST-π的表达与临床分期及淋巴结转移情况无关(P>0.05). 临床分期S4、S5期和有淋巴结转移的胆囊癌的P53表达率显著高于S1-S3期和淋巴结未转移者(P<0.05, P = 0.043、0.008). P53表达与组织分化程度无关(P>0.05). P-gp、GST-π和P53的表达与患者的性别、年龄均无关(P>0.05, 表1).
| 临床指标 | n | P-pg阳性率(%) | P值 | GST-π阳性率(%) | P值 | P53阳性率(%) | P值 |
| 性别 | >0.05 | >0.05 | >0.05 | ||||
| 男 | 24 | 70.8 | 70.8 | 75.0 | |||
| 女 | 25 | 80.0 | 60.0 | 64.0 | |||
| 年龄(岁) | >0.05 | >0.05 | >0.05 | ||||
| <60 | 25 | 72.0 | 68.0 | 68.0 | |||
| >60 | 24 | 79.2 | 62.5 | 70.8 | |||
| 病理分级 | >0.05 | <0.05 | >0.05 | ||||
| 高分化及 | 22 | 68.2 | 50.0 | 63.6 | |||
| 乳头状腺癌 | |||||||
| 中低分化 | 27 | 81.5 | 77.8 | 74.1 | |||
| Nevin分期 | >0.05 | >0.05 | <0.05 | ||||
| S1-S3 | 19 | 68.4 | 57.9 | 52.6 | |||
| S4-S5 | 30 | 80.0 | 70.0 | 80.0 | |||
| 淋巴结转移 | <0.05 | >0.05 | <0.01 | ||||
| 有 | 27 | 88.9 | 66.7 | 85.2 | |||
| 无 | 22 | 59.1 | 63.6 | 50.0 |
P53表达阳性组中, P-gp表达率为85.3%(29/34), P53阴性组中P-gp表达率为53.3%(8/15), 两者差异具有统计学意义, 相关性分析表明二者呈正相关(r = 0.343, χ2 = 5.749, P = 0.016). P53与GST-π的表达之间无明显相关性(P>0.05, P = 0.604).
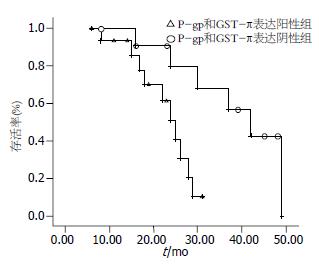
完整随访40例患者, 中位生存期为33 mo, 16例P-gp和GST-π共同表达, 12例P-gp和GST-π均未表达. Kaplan-Meier生存曲线显示P-gp和GST-π表达阳性者累积生存率显著低于阴性者,经Logrank法比较, 差异具有统计学意义(P<0.05, P = 0.007, 图2).
P-gp是MDR-1基因编码的跨膜糖蛋白, P-gp的表达水平与细胞的膜通透性、细胞内药物的浓度以及细胞的耐药程度有关[3]. 肿瘤患者P-gp表达高, 预后较差, 提示P-gp不仅介导耐药, 亦与生物学恶性表型有关. 有学者分别应用免疫组织化学方法和RT-PCR方法检测胆囊癌中P-gp、MDR-1 mRNA的表达率分别为77%和52%, 且与胆囊癌的临床分期有关[4]. 本组研究中P-gp表达率为75.5%, 均为原发性耐药, 其表达与淋巴结转移密切相关, 提示P-gp高表达的胆囊癌易发生淋巴结转移. GST-π在人体许多癌前病变、癌组织及癌细胞系中高表达并参与MDR的形成[5]. GST-π高度表达与细胞癌变过程中的适应性有关, 使癌细胞免受化学毒素及细胞毒类药物的侵袭, 保护癌细胞生长[6]. 本组研究中GST-π表达率为65.3%, 其表达与组织分化程度密切相关, 反映出胆囊癌GST-π的表达和组织学分化的一般规律. 但由于肿瘤的异质性, 临床仅依据分化程度难以判定胆囊癌患者的预后. 通过术后随访, 本组研究发现P-gp和GST-π表达均为阳性的患者术后的累积生存率显著低于阴性患者. 由此可见, 联合检测P-gp和GST-π表达可作为判定胆囊癌恶性程度和预后的客观指标.
P53基因是与化疗敏感性关联最密切的抑癌基因, 他分为野生型和突变型两种[7]. 野生型P53蛋白是一种生长抑制性蛋白, 在损伤细胞的修复中发挥重要作用, 由于野生型P53蛋白的半衰期极短, 因而组织含量低, 利用免疫组织化学只能检测到突变型P53蛋白的表达[8]. P53突变会导致凋亡受抑, DNA修复能力减弱, 不能保证细胞染色体正常数目的维持, 失去了对肿瘤细胞发生的抑制作用[9]. 本组P53表达率为69.4%, P53的表达与临床分期及淋巴结转移密切相关, 这与Kim et al[10]研究结果相一致, 提示突变型P53的过度表达对胆囊癌的发生有重要作用, P53突变会使胆囊癌细胞增殖的抑制作用减弱, 更易发生肿瘤浸润和淋巴结转移. 2007年Oliver et al[11]学者报道突变型P53通过上调MDR-1基因表达介导大量P-gp产生, 使肿瘤细胞对化疗制剂产生选择性抗性. 本组研究显示, P53与P-gp的表达呈正相关, 由此推测P53与P-gp表达具有协同作用, 共同促进肿瘤细胞增殖和发展. 关于GST-π和P53的关系目前研究尚少, 在乳腺癌的研究中Silverstrini et al[12]报道二者无关, 本研究的结果亦表明在胆囊癌中P53与GST-π的表达之间无明显相关性.
总之, 联合检测P-gp和GST-π的表达对于胆囊癌患者的预后判断具有积极的指导作用. 针对P53的基因治疗可能会成为预防肿瘤多药耐药的重要治疗方法.
P-gp可由ATP功能发生能量依赖性变构, 通过疏水区形成的通道主动将抗肿瘤药物泵至细胞外, 使细胞内药物蓄积下降. GST-π参与机体解毒作用, 通过加强亲电物质与GST及亲脂性细胞毒药物结合增加其水溶性, 降低化疗药物的细胞毒性. P-gp和GST-π参与恶性肿瘤的发生发展过程, 并诱导肿瘤治疗过程中多药耐药的产生, P53基因产物与多药耐药相关蛋白相互作用, 参与肿瘤细胞耐药性的调节.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科
2007年Oliver et al报道突变型P53通过上调MDR-1基因表达介导大量P-gp产生, 使肿瘤细胞对化疗制剂产生选择性抗性.
本研究提示, 联合检测P-gp和GST-π的表达对于胆囊癌患者的预后判断具有积极的指导作用. 针对P53的基因治疗可能会成为预防肿瘤多药耐药的重要治疗方法.
本文旨在探讨P-gp和P53的表达与原发性胆囊癌发生、发展及预后的关系, 具有一定创新性和参考意义.
编辑: 李军亮 电编:何基才
| 1. | Xue C, Haber M, Flemming C, Marshall GM, Lock RB, MacKenzie KL, Gurova KV, Norris MD, Gudkov AV. p53 determines multidrug sensitivity of childhood neuroblastoma. Cancer Res. 2007;67:10351-10360. [PubMed] [DOI] |
| 2. | Goldin RD, Roa JC. Gallbladder cancer: a morphological and molecular update. Histopathology. 2009;55:218-229. [PubMed] [DOI] |
| 3. | Ambudkar SV, Kimchi-Sarfaty C, Sauna ZE, Gottesman MM. P-glycoprotein: from genomics to mechanism. Oncogene. 2003;22:7468-7485. [PubMed] [DOI] |
| 4. | Cao L, Duchrow M, Windhövel U, Kujath P, Bruch HP, Broll R. Expression of MDR1 mRNA and encoding P-glycoprotein in archival formalin-fixed paraffin-embedded gall bladder cancer tissues. Eur J Cancer. 1998;34:1612-1617. [PubMed] [DOI] |
| 5. | Huang JX, Li FY, Xiao W, Song ZX, Qian RY, Chen P, Salminen E. Expression of thymidylate synthase and glutathione-s- transferase pi in patients with esophageal squamous cell carcinoma. World J Gastroenterol. 2009;15:4316-4321. [PubMed] [DOI] |
| 6. | Townsend D, Tew K. Cancer drugs, genetic variation and the glutathione-S-transferase gene family. Am J Pharmacogenomics. 2003;3:157-172. [PubMed] [DOI] |
| 7. | Lunghi P, Costanzo A, Mazzera L, Rizzoli V, Levrero M, Bonati A. The p53 family protein p73 provides new insights into cancer chemosensitivity and targeting. Clin Cancer Res. 2009;15:6495-6502. [PubMed] [DOI] |
| 8. | Jakob C, Liersch T, Meyer W, Becker H, Baretton GB, Aust DE. Predictive value of Ki67 and p53 in locally advanced rectal cancer: correlation with thymidylate synthase and histopathological tumor regression after neoadjuvant 5-FU-based chemoradiotherapy. World J Gastroenterol. 2008;14:1060-1066. [PubMed] [DOI] |
| 9. | Zhao Y, Hamza MS, Leong HS, Lim CB, Pan YF, Cheung E, Soo KC, Iyer NG. Kruppel-like factor 5 modulates p53- independent apoptosis through Pim1 survival kinase in cancer cells. Oncogene. 2008;27:1-8. [PubMed] [DOI] |
| 10. | Kim YW, Huh SH, Park YK, Yoon TY, Lee SM, Hong SH. Expression of the c-erb-B2 and p53 protein in gallbladder carcinomas. Oncol Rep. 2001;8:1127-1132. [PubMed] |
| 11. | Oliver I, Lacueva J, Barberá V, Caldés T, Teruel A, Costa D, Medrano J, Pérez-Vázquez T, Quesada P, Ferragut J. p53 genetic abnormalities and P-glycoprotein expression in stump and primary gastric carcinomas. Hepatogastroenterology. 2007;54:377-381. [PubMed] |
| 12. | Silvestrini R, Veneroni S, Benini E, Daidone MG, Luisi A, Leutner M, Maucione A, Kenda R, Zucali R, Veronesi U. Expression of p53, glutathione S-transferase-pi, and Bcl-2 proteins and benefit from adjuvant radiotherapy in breast cancer. J Natl Cancer Inst. 1997;89:639-645. [PubMed] [DOI] |