修回日期: 2009-11-14
接受日期: 2009-11-16
在线出版日期: 2009-12-18
目的: 研究组蛋白去乙酰化酶抑制剂-曲古抑菌素A(trichostatin A, TSA)对胃癌细胞系SGC-7901的生长抑制作用, 证实该作用是通过促使细胞凋亡而实现的.
方法: 用不同浓度(0.2、0.4和0.8 mg/L)和不同作用时间(24、48和72 h)的TSA作用于SGC-7901细胞, 采用MTT法观察TSA对SGC-7901细胞增殖的抑制作用; 通过流式细胞仪检测细胞周期和凋亡率的变化; 通过透射电镜观察细胞超微结构的变化.
结果: TSA可抑制胃癌SGC-7901细胞的生长, 且这种作用呈时间和剂量依赖关系. 当TSA作用浓度分别为0.2、0.4和0.8 mg/L时, 与SGC-7901细胞均作用72 h, TSA对SGC-7901细胞生长的抑制率分别为25%±1.2%, 45%±1.4%和73%±1.7%, 各组均与TSA 0.2 mg/L组比较, 差异显著(P<0.05). 当0.8 mg/L TSA分别与SGC-7901细胞作用24、48和72 h, TSA对SGC-7901细胞生长的抑制率分别为21%±1.1%, 37%±2.0%和73%±1.7%, 各组均与TSA作用24 h组比较, 差异显著(P<0.05). TSA可延缓细胞周期, 具有明显的诱导细胞凋亡作用. 电镜下见细胞染色质凝聚成段片状, 细胞核固缩断裂, 核膜破裂, 细胞器及胞膜自溶, 凋亡小体形成.
结论: TSA通过诱导细胞周期阻止和凋亡来抑制胃癌细胞系SGC-7901的生长, 且这种作用呈时间和剂量依赖性, 为TSA用于胃癌的治疗提供理论依据.
引文著录: 乔文, 杨晓丹, 王丹. 曲古抑菌素A对胃癌细胞生长的抑制作用. 世界华人消化杂志 2009; 17(35): 3611-3614
Revised: November 14, 2009
Accepted: November 16, 2009
Published online: December 18, 2009
AIM: To investigate the inhibitory effects of trichostatin A (TSA) on the growth of human gastric cancer SGC-7901 cells and explore potential mechanisms involved.
METHODS: SGC-7901 cells were treated with different concentrations (0.2, 0.4 and 0.8 mg/L) of TSA for different durations (24, 48 and 72 h). Cell proliferation was detected by methyl thiazolyl tetrazolium (MTT) assay. Cell cycle distribution and apoptotic rate were detected by flow cytometry. Cell ultrastructure was observed using transmission electron microscopy (TEM).
RESULTS: SGC-7901 cells were very sensitive to TSA. TSA inhibited the growth of SGC-7901 cells in a concentration- and time-dependent manner. The reduced rates of growth in cells treated with TSA at concentrations of 0.4 and 0.8 mg/L for 72 h were significantly higher than that in cells treated with TSA at a concentration of 0.2 mg/L for the same duration (45% ± 1.4% and 73% ± 1.7% vs 25% ± 1.2%, respectively; both P < 0.05). The reduced rates of growth in cell treated with TSA at concentrations of 0.8 mg/L for 48 and 72 h were significantly higher than that in cells treated with TSA at the same concentration for 24 hours (37% ± 2.0% and 73% ± 1.7% vs 21% ± 1.1%, respectively; both P < 0.05). TSA could induce apoptosis of SGC-7901 cells. The ultrastructure changes in SGC-7901 cells treated with TSA included nuclear fragmentation, nuclear membrane rupture, membrane and organelle dissolution, and formation of vacuoles and apoptotic bodies.
CONCLUSION: TSA can inhibit cell growth and induce apoptosis in human gastric cancer cell line SGC-7901 in a concentration- and time-dependent manner.
- Citation: Qiao W, Yang XD, Wang D. Trichostatin A inhibits the growth of human gastric cancer SGC-7901 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(35): 3611-3614
- URL: https://www.wjgnet.com/1009-3079/full/v17/i35/3611.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i35.3611
组蛋白乙酰化和去乙酰化在基因的转录调控中发挥着重要作用, 蛋白乙酰化水平由组蛋白乙酰化酶和组蛋白去乙酰化酶的动态平衡调节[1]. 研究发现, 组蛋白乙酰化酶和组蛋白去乙酰化酶的异常与肿瘤的发生密切相关. 组蛋白去乙酰基酶抑制剂是一种新型的抗癌药物, 可抑制肿瘤细胞增殖, 诱导肿瘤细胞分化和凋亡, 并可发挥免疫调节作用[2-4]. 曲古抑菌素A(trichostatin A, TSA)是链霉素代谢产物, 可特异性抑制组蛋白去乙酰基酶, 对多种肿瘤细胞具有明显的抑制作用[5]. 本研究主要了解TSA对胃癌细胞SGC-7901细胞的抑制作用.
TSA购自Sigma公司, 溶解于二甲基亚砜(购自Sigma公司)溶液(DMSO)中, 制成浓度为3 mmol/L的TSA溶液, 保存于-80 ℃中备用. 噻唑蓝(MTT)购自Sigma公司. RPMI-1640培养液购自美国Gibco公司.
1.2.1 细胞培养: 人胃癌细胞株SGC-7901购自西安交通大学医学院细胞库. 将冻存细胞解冻处理后, 加入含100 mL/L胎牛血清的RPMI 1640培养液, 在37 ℃, 含50 mL/L CO2, 950 mL/L空气的饱和湿度培养箱中连续传代培养. 取3-4代的细胞实验用.
1.2.2 人胃癌细胞株SGC-7901的给药处理: 将对数生长期细胞, 弃去原培养液, 加入新培养液, 用不同浓度(0.2、0.4和0.8 mg/L)的TSA, 对照组加入同等体积的DMSO, 在培养箱中继续培养不同的作用时间(24、48和72 h), 收集细胞待测.
1.2.3 SGC-7901细胞增殖抑制的测定: 按MTT法, 靶细胞1×103/孔, 接种于96孔培养皿中, 令其贴壁24 h后, 更换培养液, 同时加入TSA. 分为A、B两组: A组(剂量依赖组)不同浓度(0.2、0.4和0.8 mg/L)的TSA, 均培养72 h, 对照组加入同等体积的DMSO; B组(时间依赖组), TSA 0.8 mg/L培养24、48和72 h. 每孔加入MTT 100 μg, 继续孵育4 h, 弃上清, 各孔加入150 μL DMSO, 振荡20 min后, 测每孔A560nm, 按下列公式计算抑制率. 抑制率 = (1-实验孔A560nm/对照孔A560nm)×100%.
1.2.4 细胞周期DNA检测: 采用流式细胞术. 取对数生长期的SGC-7901细胞按1×106/L, 接种于6孔细胞培养板中, 实验组分别加入不同浓度的TSA, 对照组加入等量的培养液, 作用24 h后, 无菌收集细胞数目约为5×109 个/L, 1200 r/min离心, 弃去培养液, PBS洗涤2次, 加入700 mL/L冷乙醇固定细胞, 4 ℃过夜, 吹散细胞, 再用PBS洗掉固定液, 加入碘化丙啶综合染液0.5 mL, 4 ℃避光, 上机检测.
1.2.5 透射电镜标本制备及观察: 收集细胞, 3%戊二醛、4 ℃固定2 h以上. 常规脱水、浸透、包埋、超薄切片和铅-铀双重染色, JEM-2000EX透射电镜观察和照相[6].
统计学处理 采用SPSS11.5软件包进行配对t检验, 所有数据均采用mean±SD表示.
通过MTT检测, 结果表明TSA能够抑制胃癌细胞SGC-7901的生长, 呈明显的时间和剂量依赖性. 当TSA作用浓度分别为0.2、0.4和0.8 mg/L时, 与SGC-7901细胞均作用72 h, TSA对SGC-7901细胞生长的抑制率分别为25%±1.2%, 45%±1.4%和73%±1.7%, 各组均与TSA 0.2 mg/L组比较, 差异显著(P<0.05). 当0.8 mg/L TSA分别与SGC-7901细胞作用24、48和72 h, TSA对SGC-7901细胞生长的抑制率分别为21%±1.1%, 37%±2.0%和73%±1.7%, 各组均与TSA作用24 h组比较, 差异显著(P<0.05).
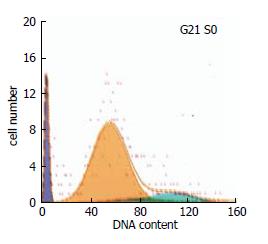
发现TSA对胃癌SGC-7901细胞凋亡的诱导呈时间和剂量依赖性. 凋亡细胞所形成的亚二倍体峰位于DNA周期峰群的前端. 用凋亡程序软件分析确认为凋亡峰(AP)(图1). 不同条件下个实验组DNA周期分布见表1.
| TSA(mg/L) | 作用时间(h) | DNA周期(%) | |||
| G1 | S | G2 | AP | ||
| 0.2 | 24 | 48.3 | 32.0 | 19.7 | 1.5 |
| 0.8 | 24 | 60.8 | 26.6 | 12.6 | 2.3 |
| 0.8 | 48 | 67.8 | 28.1 | 4.1 | 5.6 |
| 0.8 | 72 | 83.2 | 10.0 | 6.8 | 14.4 |
| 0 | 72 | 71.8 | 21.9 | 6.3 | 0.0 |
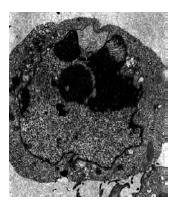
电镜下见核染色质降解和聚集, 形成均匀一致的细小颗粒状团块聚集于核膜处, 胞质浓缩, 凋亡小体形成, 且具有相对完整的包膜及少数结构完好的细胞器(图2).
肿瘤的发生发展受到许多因素的影响, 如细胞的过度增殖、分化受阻等. 近年来, 染色质结构改变与肿瘤的相关研究越来越受到人们的关注. 染色体重塑是调节基因表达和蛋白质功能的重要机制, 染色体重塑主要有两种方式: 组蛋白去乙酰化和DNA甲基化[1]. 组蛋白乙酰化和去乙酰化在基因的转录调控中发挥着重要作用, 组蛋白乙酰化水平由组蛋白乙酰化酶(histone acetyltransferase, HAT)和组蛋白去乙酰化酶(histone deacetylase, HDAC)的动态平衡调节. 组蛋白去乙酰化酶导致核染色质结构更紧密, 转录因子及RNA多聚酶不容易结合靶基因, 从而抑制基因表达. 因过度表达或组蛋白去乙酰化酶异常活化而导致的组蛋白乙酰化程度降低与肿瘤的发生、发展密切相关. 近年来研究表明, 组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor, HDACI)可抑制肿瘤细胞增殖, 诱导肿瘤细胞分化和凋亡, 并可发挥免疫调节作用, 是新一代具有广泛应用前景的抗肿瘤药[2].
TSA源自链霉菌代谢产物, 最先作为抗真菌药物使用, 目前研究发现它是组蛋白去乙酰化酶的强效抑制剂, 以纳摩尔的浓度特异抑制组蛋白去乙酰化酶的活性, 对肝癌、甲状腺癌、宫颈癌、口腔癌、前列腺癌及神经母细胞瘤等肿瘤细胞具有明显的细胞毒作用, 可抑制肿瘤细胞的增殖, 诱导分化或促进凋亡的作用[3,7].
本实验研究证实TSA可以明显抑制SGC-7901细胞的生长, 具有时间和剂量依赖性. 形态学证实TSA可使细胞卷曲变圆, 细胞质浓缩, 核染色质凝聚, 边集于核膜周围, 随后出现细胞核裂解, 包含有高密度染色质的细胞核以芽生的方式从细胞膜脱落而形成多个有膜包裹、内含物不外溢的凋亡小体. 流式细胞仪分析发现TSA可使细胞的生长主要停止在G1期, 阻止细胞由G1期进入S期, 从而抑制细胞的生长. 同时可见在整个细胞周期的前端由于DNA断裂产生特殊的寡核苷酸片段而形成一个凋亡峰, 且成时间和剂量依赖性, 这与多项研究结果相一致[8-11]. TSA抑制肿瘤生长和促进凋亡的机制目前尚不清楚, Zou et al[12]的研究表明TSA可促进乙酰化组蛋白在肿瘤组织中的聚集, 同时, 乙酰化组蛋白H3的高表达与胃癌SGC-7901和BGC-832的凋亡有关. Lee
et al[13]报道肿瘤抑制因子RUNX3参与胃癌细胞的组蛋白修复. Shen et al[14]研究显示组蛋白去乙酰化酶抑制剂可逆转ASSF1A基因的甲基化状态, 并可诱导它的再表达. Wu et al[15]证实TSA诱导胃癌细胞凋亡是通过caspase非依赖途径.
Zhang et al[16]的研究表明TSA可增加抗癌药物的敏感性. 总之, TSA有望成为胃癌治疗的一种新型药物. 但今后还需在其作用机制上做进一步的深入研究.
组蛋白去乙酰化酶导致核染色质结构更紧密, 转录因子及 RNA多聚酶不容易结合靶基因, 从而抑制基因表达. 因过度表达或组蛋白去乙酰化酶异常活化而导致的组蛋白乙酰化程度降低与肿瘤的发生、发展密切相关.
刘连新, 教授, 哈尔滨医科大学第一临床医学院普通外科.
组蛋白去乙酰化酶抑制剂可抑制肿瘤细胞增殖, 诱导肿瘤细胞分化和凋亡, 并可发挥免疫调节作用, 是近年来研究的热点, 有望成为新一代具有广泛应用前景的抗肿瘤药.
本研究观察曲古抑菌酶A对于胃癌细胞系SGC7901的抑制作用和可能的作用机制, 并且从凋亡的角度解释其可能的作用机制.
本文总体设计合理, 思路清楚, 实验方法成熟可靠, 实验结论可信, 讨论紧密结合所研究的内容进行, 有一定的说服力.
编辑: 李军亮 电编:吴鹏朕
| 3. | 孟 春风, 戴 冬秋. 组蛋白修饰与胃肠道恶性肿瘤的关系. 中国普外基础与临床杂志. 2007;14:608-611. |
| 4. | 朱 新江, 孟 春风, 彭 过, 戴 冬秋. 5-Aza-dC和TSA对胃癌细胞系p16和hMLH-1基因甲基化水平及表达的影响. 世界华人消化杂志. 2008;16:1837-1841. [PubMed] |
| 8. | Hauswald S, Duque-Afonso J, Wagner MM, Schertl FM, Lübbert M, Peschel C, Keller U, Licht T. Histone deacetylase inhibitors induce a very broad, pleiotropic anticancer drug resistance phenotype in acute myeloid leukemia cells by modulation of multiple ABC transporter genes. Clin Cancer Res. 2009;15:3705-3715. [PubMed] [DOI] |
| 9. | Park SJ, Kim MJ, Kim HB, Sohn HY, Bae JH, Kang CD, Kim SH. Trichostatin A sensitizes human ovarian cancer cells to TRAIL-induced apoptosis by down-regulation of c-FLIPL via inhibition of EGFR pathway. Biochem Pharmacol. 2009;77:1328-1336. [PubMed] [DOI] |
| 10. | Noro R, Miyanaga A, Shimokawa T, Kuribayashi H, Mizutani H, Minegishi Y, Okano T, Seike M, Soeno C, Kataoka K. The anticancer effect of histone deacetylase inhibitors and combination with the cytotoxic agents in lung cancer cells: biological analyses for future clinical application. J Nippon Med Sch. 2009;76:44-46. [PubMed] [DOI] |
| 12. | Zou XM, Li YL, Wang H, Cui W, Li XL, Fu SB, Jiang HC. Gastric cancer cell lines induced by trichostatin A. World J Gastroenterol. 2008;14:4810-4815. [PubMed] [DOI] |
| 13. | Lee SH, Kim J, Kim WH, Lee YM. Hypoxic silencing of tumor suppressor RUNX3 by histone modification in gastric cancer cells. Oncogene. 2009;28:184-194. [PubMed] [DOI] |
| 14. | Shen WJ, Dai DQ, Teng Y, Liu HB. Regulation of demethylation and re-expression of RASSF1A gene in gastric cancer cell lines by combined treatment of 5-Aza-CdR and NaB. World J Gastroenterol. 2008;14:595-600. [PubMed] [DOI] |
| 15. | Wu ZQ, Zhang R, Chao C, Zhang JF, Zhang YQ. Histone deacetylase inhibitor trichostatin A induced caspase-independent apoptosis in human gastric cancer cell. Chin Med J (Engl). 2007;120:2112-2118. [PubMed] |