修回日期: 2009-09-29
接受日期: 2009-10-12
在线出版日期: 2009-12-18
目的: 考察NADPH氧化酶对门静脉海绵样变(cavernous transformation of portal vein, CTPV)大鼠体内氧化应激的影响.
方法: 将大鼠按随机抓取的方式分为假手术组、CTPV(门静脉海绵样变性)模型组. 采用门脉部分结扎法复制CTPV大鼠动物模型; 测定门静脉内血清超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活力及丙二醛(MDA)、门静脉组织一氧化氮(NO)、内皮型一氧化氮合酶(eNOS)的含量; 采用实时荧光定量RT-PCR法测定门静脉组织NADPH氧化酶p22phox以及gp91phox亚基的mRNA表达.
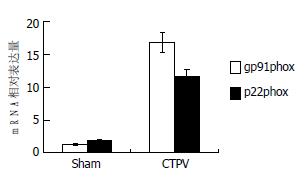
结果: 与Sham组大鼠相比, CTPV组大鼠SOD、GSH-Px活性(酶活力单位)降低(93.79±8.87 μU/L vs 103.05±8.07 μU/L, 157.44±26.46 vs 709.09+83.21, 均P<0.05), 而MDA含量增加(5.33±0.35 μmol/L vs 3.59±0.44 μmol/L, P<0.01); 实时荧光定量RT-PCR显示门静脉NADPH氧化酶亚基gp91phox以及p22phox的mRNA表达增强(16.77±3.27 vs 1.31±0.95, 11.64±7.34 vs 1.93±0.86, 均P<0.01); 门静脉组织NO含量及eNOS活性均降低(2.33±0.82 μmol/L vs 85.00±3.16 μmol/L, 0.24±0.11 U/mg prot vs 1.76±0.78 U/mg prot, 均P<0.01).
结论: CTPV大鼠体内氧化应激状态与NADPH氧化酶亚基gp91phox以及p22phox mRNA过表达有关; NADPH氧化酶依赖的氧化应激可能与CTPV大鼠门静脉内皮功能障碍的发生发展密切相关.
引文著录: 王建尧, 刘磊, 姚君, 王斌, 陈芳, 毛建雄, 缪小平, 林飞飞. NADPH氧化酶对门静脉海绵样变大鼠体内氧化应激的影响. 世界华人消化杂志 2009; 17(35): 3595-3600
Revised: September 29, 2009
Accepted: October 12, 2009
Published online: December 18, 2009
AIM: To investigate the role of nicotinamide adenine dinucleotide phosphate (NADPH) oxidase in oxidative stress that is involved in cavernous transformation of the portal vein (CTPV) in rats.
METHODS: CTPV was induced in rats by partial portal vein ligation. Antioxidant capacity was evaluated by assaying the activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) in the portal vein blood. The content of malonaldehyde (MDA), a marker of lipid peroxidation, was assayed to assess oxidative stress level in the portal vein blood. The changes in endothelial function were evaluated by assaying nitric oxide (NO) and endothelial NO synthase in the portal vein. The mRNA expression of NADPH oxidase subunits gp91phox and p22phox was measured by real-time quantitative reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Compared with sham-operated rats, the activities of SOD and GSH-Px significantly decreased (93.79 ± 8.87 μU/L vs 103.05 ± 8.07 μU/L and 157.44 ± 26.46 vs 709.09 ± 83.21, respectively; both P < 0.05), the content of MDA increased (5.33 ± 0.35 μmol/L vs 3.59 ± 0.44 μmol/L, P < 0.01), the expression of NADPH oxidase subunits gp91phox and p22phox was significantly upregulated (16.77 ± 3.27 vs 1.31 ± 0.95 and 11.64 ± 7.34 vs 1.93 ± 0.86, respectively; both P < 0.01), and the endothelial NO content and endothelial NO synthase activity in the portal vein were significantly reduced in CTPV rats (2.33 ± 0.82 μmol/L vs 85.00 ± 3.16 μmol/L and 0.24 ± 0.11 U/mg prot vs 1.76 ± 0.78 U/mg prot, respectively; both P < 0.01).
CONCLUSION: The upregulation of NADPH oxidase subunits gp91phox and p22phox genes is correlated with the oxidative stress status in CTPV rats. NADPH oxidase-dependent oxidative stress may contribute to endothelial dysfunction in CTPV rats.
- Citation: Wang JY, Liu L, Yao J, Wang B, Chen F, Mao JX, Miao XP, Lin FF. Role of NADPH oxidase in oxidative stress involved in cavernous transformation of the portal vein in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(35): 3595-3600
- URL: https://www.wjgnet.com/1009-3079/full/v17/i35/3595.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i35.3595
门静脉海绵样变性(cavernous transformation of portal vein, CTPV)是指门静脉主干和(或)其分支完全或部分阻塞后, 肝门区和十二指肠韧带及其周围形成许多向肝性扩张迂曲的静脉血管瘤样侧支循环或阻塞后再通, 是机体为保证肝血流量和肝功正常的一种代偿性病变, 是一种肝外性门静脉高压症[1]. 近年研究表明: 氧化应激(oxidative stress, OS)在血管病变中起着关键作用. 氧化应激是指机体活性氧产生过多或/和机体抗氧化能力降低, 活性氧的清除不足, 导致活性氧在体内增多并引起细胞氧化损伤的病理过程[2]. 在血管平滑肌细胞、内皮细胞及外膜成纤维细胞中的NADPH氧化酶产生的ROS在高血压、动脉粥样硬化的发生及发展发病机制中起着关键作用. NADPH氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, Nox)是心血管组织中活性氧簇的主要来源之一[3-5]. 然而对于门静脉海绵样变性大鼠体内的氧化应激状态及NADPH氧化酶的作用, 未见相关报道. 本研究主要考察NADPH氧化酶对CTPV模型大鼠体内的氧化应激状态的影响以及氧化应激与门静脉内皮功能障碍的相关性.
健康SD大鼠40只, SPF级, 体质量150±10 g, 广东省医学实验动物中心提供, 许可证号: SCXK(粤)2008-0002, 粤监证字2008A020, 标准饲料, 自由饮水. 超氧化物歧化酶(superoxide dismutase, SOD)、微量丙二醛(maleic dialdehyde, MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)、一氧化氮(nitric oxide, NO)以及一氧化氮合酶(nitric oxide synthase, NOS)检测试剂盒(南京建成生物工程研究所). 高纯总RNA快速提取试剂盒(北京百泰克生物技术公司); PrimeScriptTM RT reagent Kit试剂盒(TaKaRa 宝生物有限公司); SYBR Premix Ex TaqTM PCR 试剂盒(TaKaRa宝生物有限公司). BS210S电子天平; 756PC紫外分光光度计(上海光谱仪器有限公司); Hema tol-18R台式冷冻离心机(广州广一科学仪器有限公司)、BCD-215KAND2冰箱(青岛海尔集团有限公司), Mx3005P QPCR Systems定量PCR仪(Stratagene Products). 3%戊巴比妥钠(广东汕头新宁化工厂产品); 4-0丝线(上海浦东金环医疗用品公司产品); 三通管; Pclab-US生物医学信号采集系统等.
1.2.1 分组: 将大鼠按随机抓取的方式随机分为Sham(假手术)组、CTPV(门静脉海绵样变性)模型组.
1.2.2 造模: 采用文献[6]介绍的"门脉部分缩窄"的方法制备CTPV动物模型. (1)CTPV模型组大鼠麻醉后, 逐层切开肌肉及腹膜, 进入腹腔. 开腹后沿右侧肝肾隐窝, 暴露肝门区. 探查十二指肠后部的门静脉、肝动脉及肝总管. 辨认肝门静脉后, 距肝门1 cm处用弯头玻璃分针轻柔地分离周围组织, 避免损伤十二指肠和胰腺. 玻璃分针勾挂4号丝线, 丝线从门静脉后方穿过, 21G钝针头平行门静脉放置, 用丝线将门静脉与钝针头一同结扎. 结扎后快速旋转抽出针头, 留线头约2 mm, 剪线. 观察周围组织有无活动性出血, 大鼠基本生命体征稳定后, 逐层关闭腹膜、肌层和皮肤. (2)Sham组手术同上述CTPV动物模型制作, 只是开腹后探查十二指肠后部的门静脉、肝动脉及肝总管. 不予结扎门静脉, 辨认肝门静脉后, 逐层关闭腹膜、肌层和皮肤.
1.2.3 门静脉造影: 术后6 wk, 动物麻醉后开腹, 开腹后沿右侧肝肾隐窝, 用拉钩牵引肠管, 暴露肝门区. 探查十二指肠后部的门静脉、肝动脉及肝总管. 辨认肝门静脉, 肉眼观察门静脉及其周围组织静脉海绵样变情况. 于肠系膜上静脉插入0.4 mm口径静脉输液针末端连有10 mL注射器, 针尖位于门静脉内接近脾静脉入口处, 以0.4 mL/s的速度注入60%泛影葡胺, 使肝外及肝内门静脉系统显影.
1.2.4 门静脉压测定: 术后6 wk, 大鼠麻醉后, 取腹正中切口, 上至剑突下方, 下至耻骨联合上方, 逐层切开皮肤肌肉. 开腹后顺着小肠系膜根部探查肠系膜上静脉, 并且用玻璃分针钝性分离肠系膜上静脉. 用静脉夹将远端肠系膜上静脉夹闭. 于脾静脉与门静脉汇合处以下, 在肠系膜上静脉底部穿入一根4-0丝线. 于脾静脉与门静脉汇合处迅速插入末端接有含100 kU/L肝素的三通管的22G套管针, 缓慢拔出套管针尾部, 见有血液顺着套管针后部流出, 穿刺点近端用4-0丝线固定套管针头, 避免其滑脱. 三通管末端接压力传感器与生物机能信号系统, 松开静脉夹, 待压力信号稳定后测压.
1.2.5 门静脉血清GSH-PX、SOD活力和MDA含量测定: 各组大鼠开腹, 门静脉取血, 离心(3000 r/min, 10 min), 分离血清置4 ℃备用; 分离入肝分叉处以下, 脾静脉汇合处以上门静脉, 称质量, 加入9倍冰冷无菌的生理盐水手动制成10%门静脉匀浆, 离心(2500 r/min, 10 min), 取上清液置4 ℃备用. 采用黄嘌呤氧化酶法测定血清SOD水平; 采用还原型谷胱甘肽法测定GSH-PX活性; 采用硫代巴比妥酸比色法测定MDA水平. 各指标测定均严格按照试剂盒说明书进行, 以上试剂均由南京建成生物研究所提供.
1.2.6 门静脉组织NO浓度及eNOS活性测定: 各组大鼠开腹, 取入肝分叉处以下, 胃冠状静脉分叉处以上门静脉, 称质量, 加入质量×9倍体积的预冷无菌的生理盐水手动制成10%门静脉组织匀浆, 离心(2500 r/min, 10 min), 取上清液置4 ℃备用. 应用自动生化分析仪和紫外分光光度计测量门静脉组织NO浓度以及eNOS活性, 按照试剂盒说明书进行.
1.2.7 实时荧光定量RT-PCR测定: (1)总RNA提取: 取各组大鼠门静脉(上至入肝分叉处, 下至脾静脉汇合处), 生理盐水冲洗干净表面血液, 滤纸吸干后放于电子天平称质量. 150±10 mg, 放入盛有液氮的研钵体中研磨成粉末状, 直接加1 mL裂解液RL后匀浆, 按高纯总RNA快速提取试剂盒提取组织总RNA. 取制备好的RNA, 加入TE Buffer溶解后, 用紫外分光光度计, 进行吸光度的测量, A260/A280为1.8-2.0. (2)逆转录反应(RT): 取总质量500 ng的总RNA, 逆转录反应体系50 μL, 按逆转录试剂盒(大连宝生物公司)说明步骤进行. 5×PrimeScriptTM Buffer 10 μL, PrimeScriptTM RT Enzyme MixⅠ 2.5 μL, Oligo dT Primer(50 μmol/L)2.5 μL, Random 6 mers(100 μmol/L) 2.5 μL, Total RNA(0.5 g/L)15 μL, RNase Free dH2O 17.5 μL. 反应条件为: 37 ℃反应30 min(反转录), 85 ℃反应5 s(变性). (3)聚合酶链反应(PCR): 目的基因及内参基因的引物序列: GenBank中查出引物mRNA序列号, primer5软件设计PCR引物, 以GAPDH为内参. 引物序列如下: GAPDH: M17701, sense: 5'-GGCACAGTCAAGGCTGAGAATG-3'; antisense: 5'-ATGGTGGTGAAGACGCCAGTA-3'; gp91-phox: NM023965, sense: 5'-ACAAGGTTTATGACGATGAGCCTA-3'; antisense: 5'-CACTGGCAGCAAGATCAGCA-3'; p22-phox: NM024160, sense: 5'-ACCGTCTGCTTGGCCATTG-3'. antisense: 5'-TCAATGGGAGTCCACTGCTCAC-3'. 目的基因扩增的条件: 均为50 μL反应体系, 应用GAPDH mRNA作为参照. 变性条件: 95 ℃预变性5 min, 95 ℃变性5 s, 60 ℃退火20 s, 72 ℃延伸20 s, 45个循环. 定量方法参照文献[7], 所有试验数据重复3次, 取均数. 阴性对照不加模板. 使用双标准曲线法, 初始模板量行均一化处理后, 得出目的基因的相对含量.
统计学处理 各组结果以mean±SD表示, 各组间比较采用t检验.
Sham组显示,造影剂沿门静脉顺利进入肝脏, 肝脏内各级门静脉属支显影良好, 呈树枝状分布, 门静脉及其属支通畅, 无曲张与扩张, 此时造影未显示门腔静脉侧支循环形成(图1A). CTPV模型组显示,开始门静脉远侧端显影良好, 随后部分造影剂仍沿门静脉顺利进入肝脏, 入肝门处门静脉狭窄, 肝脏内各级门静脉属支随后缓慢显影, 呈树枝状分布, 但进入肝脏的造影剂较假手术组大鼠造影时明显减少, 在肝脏内各级门静脉属支显影的同时肠系膜上、下静脉及脾静脉各级属支开始显影, 可见其一二级属支有曲张现象, 左肾上腺静脉显影明显, 较正常时增粗. 另外造影可显示肝门区和十二指肠韧带及其周围静脉血管瘤样血管丛包绕门静脉进入肝门. 部分造影剂沿门腔静脉间侧支循环血管由门静脉系统进入腔静脉系统. 说明此时肝门区和十二指肠韧带及其周围侧支循环、门腔间侧支循环已经形成(图1B).
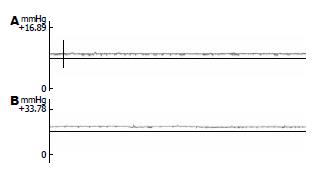
术后6 wk, 通过给各组大鼠门静脉测压, Sham组大鼠门静脉压力9.21±0.20 mmHg(图2A); CTPV模型组大鼠门静脉压力16.29±0.11 mmHg(图2B), 与Sham组大鼠比较CTPV模型组大鼠门静脉压力明显升高, 两组比较差异有显著性意义(P<0.01).
CTPV模型组大鼠静脉血清GSH-PX和SOD活性低于Sham组, 两组比较差异有显著性意义(P<0.05). CTPV模型组大鼠血清的MDA含量较Sham组显著性升高, 两组比较差异有显著性意义(P<0.01, 表1).
CTPV模型组门静脉组织NO浓度明显低于Sham组门静脉组织NO浓度的水平(2.33±0.82 μmol/L vs 85.00±3.16 μmol/L, P<0.01); CTPV模型组门静脉eNOS活力明显低于Sham组门静脉eNOS活力(0.24±0.11 U/mg prot vs 1.76±0.78 U/mg prot, P<0.01).
根据目的基因的原始定量结果, 经过管家基因校正后得到gp91phox以及p22phox亚基的相对定量结果. 从图3可见, Sham组门静脉gp91phox荧光定量结果为1.31±0.95, 明显低于CTPV模型组16.77±3.27, 两组比较差异有显著性意义(P<0.01). Sham组p22phox荧光定量结果为1.93±0.86, 明显低于CTPV模型组11.64±7.34, 两组比较差异有显著性意义(P<0.01).
ROS是指具有高度化学活性的氧依赖性分子, 他包括超氧阴离子、羟自由基、过氧化氢、脂氢过氧化物及其代谢产物. 体内抗氧化系统主要由酶促反应和非酶促反应两部分活性物质组成. 体内酶促反应抗氧化的酶系SOD、CAT、GSH-Px可使活性氧转变为过氧化氢, 最终转变为水和分子氧, 从而发挥清除氧自由基的作用; SOD及GSH-PX是体内非常重要的氧自由基清除剂, 能保护细胞免受损伤, 其活力的高低间接反映了机体清除自由基的能力[8]. 自由基损伤的主要病理机制是引起脂质过氧化, MDA是脂质过氧化的代谢产物, 其水平可反映机体脂质过氧化损害程度.
本实验研究发现, CTPV模型组大鼠门静脉血清抗氧化能力指标SOD及GSH-PX较Sham组比较显著降低, 两组比较差异有显著性意义(P<0.05). 而反映机体氧化应激损伤的指标MDA较Sham组比较显著增加, 两组比较差异有显著性意义(P<0.01), 确证了CTPV模型大鼠门静脉氧化应激状态的存在. 由此可以认为, 大鼠门静脉海绵样变性的发生、发展过程可能与氧化应激有关. 本项研究的结果对此见解提供了新的、直接的证据.
人们在研究高血压、动脉粥样硬化等血管疾病中发现, 源于NADPH氧化酶的ROS增加, ROS是调节血管结构和功能状态的重要信号分子, 血管内皮细胞、平滑肌细胞和动脉外膜细胞等均可产生ROS, ROS过多与炎性反应、动脉粥样硬化、糖尿病、高血压和肿瘤的发生密切相关[9-10]. NADPH氧化酶是由gp91phox, p22phox, p47phox, p67phox, p40phox和小GTP酶Rac 6种亚单位组成的复合体, gp91phox和p22phox亚单位位于膜上, 当与胞质中的另外几种亚单位结合时可形成有活性的Nox复合体, 其中gp91phox是其主要的功能亚单位, p22phox的C末端有一富含脯氨酸的尾巴, 可能用来结合Nox的胞质激活因子, 从而发挥在胞内调节作用[11-12]. 本研究的另一个目的, 就是了解NADPH氧化酶在门静脉氧化应激损伤中的作用. 结果显示在CTPV模型组中NADPH氧化酶的gp91phox与p22phox亚基的mRNA表达明显升高, 促进了体内及门静脉的氧化应激反应; 同时, 检测到门静脉组织MDA增多. 这些结果有力说明, 氧化应激是门静脉海绵样变性疾病的发生、发展机制之一.
由此推测NADPH氧化酶活性增强, 可能导致了门静脉组织的氧化应激的发生, 并且对门静脉组织MDA检查的结果也发现, CTPV模型组中MDA增多, 证实了我们的推测.
NO是内皮细胞分泌的活性物质, 是一种强力的血管舒张因子, 具有调节血管张力, 保持内皮层的完整性等作用, 从而发挥舒张血管的作用. 研究显示: 在心血管病理过程中内皮源性NO生物利用度降低, 这可能是内皮细胞损伤的主要表现[13]. NO主要由血管内皮细胞合成, 源自底物左旋精氨酸(L-arginine, L-Arg)在内皮型一氧化氮合酶(nitric oxide synthase, eNOS)的作用下产生, 四氢生物蝶呤(tetrahydrobiopterin, BH4)则是NOS作用的重要辅助因子[14].
氧化应激是机体ROS产生增多, 超过机体抗氧化防御能力的病理过程, 氧化应激不仅可以引起血管炎症、促进血管脂质过氧化损伤, 参与血管重构, 而且可以调节血管紧张度. ROS通过促进脂质过氧化、促炎基因的表达和内皮NO的氧化失活而损伤内皮功能, 并且促进中性粒细胞黏附于内皮细胞引起内皮氧化应激损伤. 此外, ROS可直接与NO结合, 导致内皮NO的生物利用度降低, 进而引起内皮功能障碍.
此外BH4与血管内皮功能也密切关联. 当BH4水平下降或生物利用度降低时, eNOS的作用不是产生NO, 而是产生超氧阴离子, 同时造成NO减少与氧自由基增加, 并且, BH4缺乏还引起eNOS活性降低等效应, 最终导致血管内皮功能异常[15]. BH4在调节NO生成和氧自由基产生两方面均起着重要作用. 目前研究证实在缺乏L-精氨酸和BH4时, 纯化的eNOS产生O2-, 而且已证实O2-的产生主要发生于eNOS氧化酶的血红素中心[16-17]. BH4是所有NOS同工酶的辅因子, 具有稳定NOS结构、稳定NOS活性二聚体、增加L-精氨酸和NOS结合力等作用, 更为突出的是, BH4直接影响NO和超氧阴离子的产生[18]. 当BH4含量充足时, eNOS接受并储存来自NADPH的电子, 在底物L-精氨酸和O2存在时, eNOS将电子转运给L-精氨酸而使后者被氧化成L-胍氨酸, 同时伴随NO产生, 此过程即为正常的L-精氨酸/NO通路; 当BH4水平不足或生物利用度下降时, 激活的eNOS不能催化L-精氨酸氧化而生成L-胍氨酸和NO, 但是eNOS仍然能够接受来自NADPH的电子并将电子储存在与其相结合的四羟酮醇中, 然后再将电子传递给另一底物O2, 导致主要的终产物是O2-, 而不是NO, 此过程被称为eNOS脱偶联(uncoupling)[19]. 并且eNOS脱偶联所产生的超氧阴离子能迅速与NO结合, 消耗NO并生成毒性更强的过氧化亚硝基(ONOO-), 后者又能迅速将BH4氧化, 导致BH4进一步减少, 从而形成恶性循环. 简言之, BH4缺乏时eNOS脱偶联, NO产生减少, 而主要产生超氧阴离子, 从而导致血管内皮功能异常[20-21].
本实验显示CTPV模型组大鼠门静脉内皮NO含量与Sham组比较明显降低, 两组比较差异有显著性意义(P<0.01), 并且CTPV模型组大鼠门静脉中NADPH氧化酶的功能亚基的mRNA表达增多, 可以推断源于NADPH氧化酶产生的活性氧也增多, 并与NO反应, 使NO生物利用度下降, 导致门静脉内皮功能下降. 此外, 在本实验研究结果中, CTPV模型组大鼠门静脉组织eNOS活性与Sham组比较显著下降, 两组比较差异有显著性意义(P<0.01). 由这些结果可以认为, 门静脉血管内皮细胞在受到持续性门脉高压等危险因子刺激时, NADPH氧化酶的活性增强, 源自NADPH氧化酶的活性氧产生增多, 包括超氧阴离子、过氧化亚硝基等产生增加, 可改变细胞内的氧化-还原状态, 使BH4被氧化成BH2甚至B, 且难以实现再回收(BH2→BH4), 从而导致BH4含量下降、活性降低, 进而引起一系列的eNOS脱偶联与活性氧产生增多的恶性循环, 最终结果导致NO生物利用度进一步降低[22], 门静脉内皮功能
下降.
近年研究表明, 氧化应激(OS)在血管病变中起着关键作用. NADPH氧化酶(Nox)是心血管组织中活性氧簇的主要来源之一. 然而对于门静脉海绵样变性大鼠体内的氧化应激状态、NADPH氧化酶的作用以及氧化应激对门静脉内皮功能的影响, 未见相关报道.
孙诚谊, 教授, 贵阳医学院附属医院普外科; 丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科.
在血管平滑肌细胞、内皮细胞及外膜成纤维细胞中的NADPH氧化酶产生的ROS在高血压、动脉粥样硬化的发生及发展中起着关键作用. NO分泌量是内皮细胞功能的标志, ROS在一些血管疾病中增多并且可以与NO相结合发生相应的反应, 使得NO的生物利用度进一步降低.
Fukui et al在血管紧张素Ⅱ诱导高血压模型中, 发现源于NADPH氧化酶(NADPH oxidase)的超氧阴离子增加, 其亚单位p22phox mRNA表达升高, 这种变化可被超氧化物歧化酶(SOD)所逆转; Kuzkaya et al研究表明ROS对血管紧张度的调节, 也可能通过氧化应激介导的血管舒张受损与体内的主要舒血管活性物质NO释放减少而实现的,这可能是继发于NO合成降低的结果.
目前门静脉海绵样变性的研究多集中于有关诊断、治疗的临床病例报道. 本文将与氧化应激有关的NADPH氧化酶与门静脉海绵样变性结合起来进行研究, 进一步探讨了氧化应激可能对门静脉海绵样变性的门静脉内皮功能的影响.
CTPV大鼠体内氧化应激状态增强和门静脉内皮功能的降低, 可能参与了CTPV的发生、发展过程, 并为其发病机制之一. 为揭示门静脉海绵样变性与氧化应激的关系以及NADPH氧化酶在其中的作用提供了理论基础.
1 门静脉海绵样变性(CTPV): 是指门静脉主干和(或)其分支完全或部分阻塞后, 肝门区和十二指肠韧带及其周围形成许多向肝性扩张迂曲的静脉血管瘤样侧支循环或阻塞后再通, 是机体为保证肝血流量和肝功正常的一种代偿性病变, 是一种肝外性门静脉高压症.
2 NADPH氧化酶: 由gp91phox, p22phox, p47phox, p67phox, p40phox和小GTP酶Rac 6种亚单位组成的复合体, gp91phox和p22phox亚单位位于膜上, 当与胞质中的另外几种亚单位结合时可形成有活性的Nox复合体, 其中gp91phox是其主要的功能亚单位, p22phox的C末端有一富含脯氨酸的尾巴, 可能用来结合Nox的胞质激活因子, 从而发挥在胞内调节作用.
本研究设计合理, 方法可靠, 结论合理, 有一定理论价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | 蒋 小云, 陈 述枚. 门静脉海绵样变性的诊疗进展. 国外医学·儿科学分册. 1999;26:128-131. |
| 2. | de Champlain J, Wu R, Girouard H, Karas M, EL Midaoui A, Laplante MA, Wu L. Oxidative stress in hypertension. Clin Exp Hypertens. 2004;26:593-601. [PubMed] [DOI] |
| 3. | Feairheller DL, Brown MD, Park JY, Brinkley TE, Basu S, Hagberg JM, Ferrell RE, Fenty-Stewart NM. Exercise training, NADPH oxidase p22phox gene polymorphisms, and hypertension. Med Sci Sports Exerc. 2009;41:1421-1428. [PubMed] [DOI] |
| 4. | Guzik TJ, Sadowski J, Kapelak B, Jopek A, Rudzinski P, Pillai R, Korbut R, Channon KM. Systemic regulation of vascular NAD(P)H oxidase activity and nox isoform expression in human arteries and veins. Arterioscler Thromb Vasc Biol. 2004;24:1614-1620. [PubMed] [DOI] |
| 5. | Matsuo J, Oku H, Kanbara Y, Kobayashi T, Sugiyama T, Ikeda T. Involvement of NADPH oxidase and protein kinase C in endothelin-1-induced superoxide production in retinal microvessels. Exp Eye Res. 2009;89:693-699. [PubMed] [DOI] |
| 6. | Omokawa S, Arai Y, Saito H, Furuya T, Sato T, Sato T, Shirayama K, Ito M, Asanuma Y, Koyama K. A simple experimental model of total hepatectomy, hepatic ischemia and extrahepatic portal obstruction in rats using splenic transposition. Jpn J Surg. 1991;21:50-56. [PubMed] [DOI] |
| 8. | Young IS, Woodside JV. Antioxidants in health and disease. J Clin Pathol. 2001;54:176-186. [PubMed] [DOI] |
| 9. | Lacy F, Kailasam MT, O'Connor DT, Schmid-Schönbein GW, Parmer RJ. Plasma hydrogen peroxide production in human essential hypertension: role of heredity, gender, and ethnicity. Hypertension. 2000;36:878-884. [PubMed] [DOI] |
| 10. | Pennathur S, Heinecke JW. Oxidative stress and endothelial dysfunction in vascular disease. Curr Diab Rep. 2007;7:257-264. [PubMed] [DOI] |
| 11. | Brandes RP, Kreuzer J. Vascular NADPH oxidases: molecular mechanisms of activation. Cardiovasc Res. 2005;65:16-27. [PubMed] [DOI] |
| 12. | Ambasta RK, Schreiber JG, Janiszewski M, Busse R, Brandes RP. Noxa1 is a central component of the smooth muscle NADPH oxidase in mice. Free Radic Biol Med. 2006;41:193-201. [PubMed] [DOI] |
| 13. | Forgione MA, Loscalzo J. Oxidant stress as a critical determinant of endothelial function. Drug News Perspect. 2000;13:523-529. [PubMed] [DOI] |
| 14. | Moncada S, Higgs A. The L-arginine-nitric oxide pathway. N Engl J Med. 1993;329:2002-2012. [PubMed] [DOI] |
| 15. | Landmesser U, Dikalov S, Price SR, McCann L, Fukai T, Holland SM, Mitch WE, Harrison DG. Oxidation of tetrahydrobiopterin leads to uncoupling of endothelial cell nitric oxide synthase in hypertension. J Clin Invest. 2003;111:1201-1209. [PubMed] |
| 16. | Xia Y, Tsai AL, Berka V, Zweier JL. Superoxide generation from endothelial nitric-oxide synthase. A Ca2+/calmodulin-dependent and tetrahydrobiopterin regulatory process. J Biol Chem. 1998;273:25804-25808. [PubMed] [DOI] |
| 17. | Vásquez-Vivar J, Kalyanaraman B, Martásek P, Hogg N, Masters BS, Karoui H, Tordo P, Pritchard KA Jr. Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors. Proc Natl Acad Sci USA. 1998;95:9220-9225. [PubMed] [DOI] |
| 18. | Crabtree MJ, Tatham AL, Hale AB, Alp NJ, Channon KM. Critical role for tetrahydrobiopterin recycling by dihydrofolate reductase in regulation of endothelial nitric-oxide synthase coupling: relative importance of the de novo biopterin synthesis versus salvage pathways. J Biol Chem. 2009;284:28128-28136. [PubMed] [DOI] |
| 19. | Sindler AL, Delp MD, Reyes R, Wu G, Muller-Delp JM. Effects of ageing and exercise training on eNOS uncoupling in skeletal muscle resistance arterioles. J Physiol. 2009;587:3885-3897. [PubMed] [DOI] |
| 20. | Moens AL, Takimoto E, Tocchetti CG, Chakir K, Bedja D, Cormaci G, Ketner EA, Majmudar M, Gabrielson K, Halushka MK. Reversal of cardiac hypertrophy and fibrosis from pressure overload by tetrahydrobiopterin: efficacy of recoupling nitric oxide synthase as a therapeutic strategy. Circulation. 2008;117:2626-2636. [PubMed] [DOI] |
| 21. | Oelze M, Daiber A, Brandes RP, Hortmann M, Wenzel P, Hink U, Schulz E, Mollnau H, von Sandersleben A, Kleschyov AL. Nebivolol inhibits superoxide formation by NADPH oxidase and endothelial dysfunction in angiotensin II-treated rats. Hypertension. 2006;48:677-684. [PubMed] [DOI] |
| 22. | Chalupsky K, Cai H. Endothelial dihydrofolate reductase: critical for nitric oxide bioavailability and role in angiotensin II uncoupling of endothelial nitric oxide synthase. Proc Natl Acad Sci USA. 2005;102:9056-9061. [PubMed] [DOI] |