修回日期: 2009-11-20
接受日期: 2009-11-30
在线出版日期: 2009-12-18
目的: 探讨H. pylori对人正常胃黏膜上皮细胞永生细胞株GES-1和人淋巴结转移胃腺癌细胞株SGC-7901的氧化性DNA损伤作用.
方法: 采用细菌-细胞共培养的方法, 比较H. pylori作用前后GES-1和SGC-7901细胞株的形态学变化; 采用激光扫描共聚焦显微镜方法, 比较H. pylori作用前后GES-1和SGC-7901细胞株8-羟基脱氧鸟苷(8-OhdG)的表达.
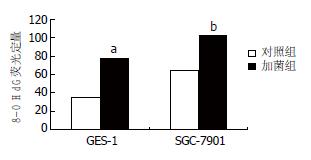
结果: H. pylori对GES-1和SGC-7901细胞株均具有损伤作用; 8-OHdG表达升高, 加菌组与对照组相比差别具有统计学意义(64.9396±17.8142 vs 32.3010±7.3620; 102.8344±30.2632 vs 77.1336±32.3223, 均P = 0.000); 而且8-OHdG表达的变化程度GES-1细胞显著高于SGC-7901细胞.
结论: H. pylori能够诱导GES-1和SGC-7901细胞DNA氧化性损伤显著增加; 在H. pylori氧化损伤的相关研究中, 更适宜选择对损伤作用敏感的GES-1细胞株作为研究对象.
引文著录: 王艳丽, 宫月华, 徐莹, 陈铁军, 柳云恩, 袁媛. 幽门螺杆菌致胃上皮细胞株GES-1和胃癌细胞株SGC-7901的氧化性损伤. 世界华人消化杂志 2009; 17(35): 3590-3594
Revised: November 20, 2009
Accepted: November 30, 2009
Published online: December 18, 2009
AIM: To investigate whether Helicobacter pylori (H. pylori) infection can induce oxidative DNA damage in human gastric epithelial cell line GES-1 and human gastric cancer cell line SGC-7901.
METHODS: H. pylori was co-cultured with GES-1 and SGC-7901 cells, respectively. The morphological changes of GES-1 and SGC-7901 cells between before and after co-culture were observed. The 8-OHdG expression in the two types of cells was detected by laser scanning confocal microscopy.
RESULTS: H. pylori infection induced oxidative DNA damage in both GES-1 and SGC-7901 cells. The expression levels of 8-OHdG in GES-1 and SGC-7901 cells co-cultured with H. pylori were significantly higher than those in control cells (64.9396 ± 17.8142 vs 32.3010 ± 7.3620 and 102.8344 ± 30.2632 vs 77.1336 ± 32.3223, respectively; both P = 0.000). The extent of 8-OHdG upregulation in GES-1 cells co-cultured with H. pylori was significantly higher than that in SGC-7901 cells co-cultured with H. pylori.
CONCLUSION: H. pylori infection induces oxidative DNA damage in both GES-1 and SGC-7901 cells. This result supports the hypothesis that H. pylori induced-oxidative DNA damage plays a pivotal role in the development of gastric carcinoma in patients with chronic gastritis. GES-1 cell line is superior to SGC-7901 cell line in the study of oxidative damage induced by H. pylori.
- Citation: Wang YL, Gong YH, Xu Y, Chen TJ, Liu YE, Yuan Y. Helicobacter pylori infection induces oxidative DNA damage in human gastric epithelial cell line GES-1 and human gastric cancer cell line SGC-7901. Shijie Huaren Xiaohua Zazhi 2009; 17(35): 3590-3594
- URL: https://www.wjgnet.com/1009-3079/full/v17/i35/3590.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i35.3590
幽门螺杆菌(H. pylori)是引起慢性胃炎的病因, 是消化性溃疡的重要致病因子, 且与胃癌的发生密切相关[1]. 关于H. pylori引起胃黏膜病变的确切机制, 目前尚未完全明了. 研究表明, 氧化性DNA损伤的产生和累积与各种胃黏膜病变的发生发展密切相关. 8-羟基脱氧鸟苷(8-OhdG)是检测DNA氧化性损伤的敏感标志物[2], 8-OHdG含量与细胞内DNA氧化损伤程度呈正相关. 目前相关研究多局限于采用免疫组织化学法针对各类H. pylori相关胃黏膜病变的病理资料进行研究, 难以直接反映H. pylori对胃黏膜上皮细胞DNA的氧化性损伤作用. 胃上皮细胞株GES-1为一基本正常的胃黏膜细胞株, 基本保留了正常的细胞骨架结构, 是了解正常胃黏膜细胞离体特征以及胃癌致病机制的良好细胞株[3]. 胃癌细胞株SGC-7901为淋巴结转移胃腺癌细胞株[4], 是目前较为常用的胃癌研究细胞模型. 本研究利用H. pylori悬液直接作用于体外培养的人胃上皮细胞株GES-1和人胃腺癌细胞株SGC-7901, 观察比较H. pylori对正常胃黏膜细胞和胃癌细胞的损伤作用; 应用激光共聚集扫描显微镜检测共培养后GES-1和SGC-7901细胞株DNA氧化性损伤情况, 旨在探讨H. pylori诱导的胃黏膜细胞DNA氧化性损伤在H. pylori相关疾病中的作用.
人胃上皮细胞株GES-1来自北京市肿瘤防治研究所细胞遗传室. 人胃腺癌细胞株SGC-7901和H. pylori菌株来自中国医科大学附属第一医院普通外科研究所暨肿瘤研究所第三研究室, 辽宁省高校肿瘤病因与预防重点实验室.
1.2.1 H. pylori活菌悬液的制备: 在无菌条件下, 以划线培养方式将H. pylori接种于含5%羊血的脑心浸液琼脂培养基(BD), 置于37 ℃微需氧环境中(50 mL/L O2、100 mL/L CO2、850 mL/L N2)培养, 3-5 d后收集针尖样透明菌落, 用含10% FBS的RPMI 1640培养液(无抗生素)作稀释液, 将两种细菌的浓度均调节至8×108 CFU/L. PCR反应证实H. pylori菌株毒力基因型为cagA(+)vacAs1(+)m1b(+).
1.2.2 H. pylori与GES-1和SGC-7901细胞共培养: (1)GES-1和SGC-7901细胞均采用含10% FBS的RPMI 1640培养液, 于37 ℃、50 mL/L CO2的培养箱中培养, 每周换液3次, 选取对数生长期的细胞进行实验. (2)2种细胞均以5×104每孔接种在含洁净小盖玻片的24孔培养板中, 过夜. (3)将稀释好的H. pylori活菌悬液加入过夜后的GES-1和SGC-7901中, 对照组加稀释用培养液. 每种细胞重复3孔. (4)24 h后, 终止共培养. 应用倒置相差显微镜进行数码图像采集, 观察细胞形态学变化. (5)取出小盖玻片, 冷丙酮固定, -20 ℃保存备用.
1.2.3 8-OHdG荧光染色及激光扫描共聚集显微镜观察: (1)取上述保存玻片, 经PBS洗涤后用0.1% Triton-100 PBS液室温孵育30 min. (2)10 g/L BSA封闭10 min后, 将鼠抗人8-OHdG一抗(日本老化研究所)加到玻片上, 4 ℃孵育过夜, 以PBS替代一抗作为阴性对照. (3)经PBS洗涤后加入FITC标记羊抗鼠IgG二抗(北京中杉), 37 ℃水浴孵育60 min. (4)PBS洗涤, 用无荧光缓冲液甘油封固后, 直接在激光扫描共聚集显微镜(德国Leica公司TCS SP2型LSCM)下观察并拍照. (5)以绿色荧光通道扫描观察, 每张玻片选择细胞较为密集的区域, 每高倍视野随机选取20个细胞, 利用Leica confocal software软件分析荧光强度. 实验重复进行3次, 以平均荧光强度作为8-OHdG的相对表达量.
统计学处理 采用统计软件SPSS11.5分析, 组间比较采用t检验, 以α = 0.05作为检验水准.
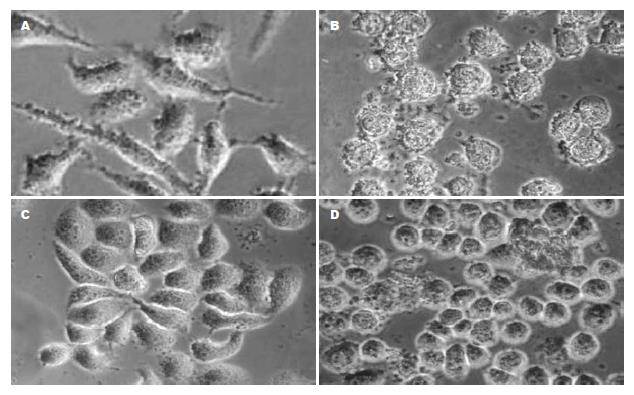
正常情况下, 倒置相差显微镜下观察GES-1细胞(图1A)为扁平多角形, 或近于梭形, 有伪足, 呈小岛状生长, 逐渐扩大成片. SGC-7901细胞(图1C)呈多角形或不规则形; 均贴壁生长, 偶见漂浮细胞; 细胞之间连接紧密. 以不加菌的GES-1和SGC-7901细胞为对照, 加入H. pylori后, GES-1和SGC-7901细胞均变圆; 贴壁细胞减少, 悬浮细胞增多, 并且细胞周围出现碎片; 细胞之间连接减少甚至消失; 细胞核和细胞质分界模糊, 呈现核质融合状态(图1B, 1D).
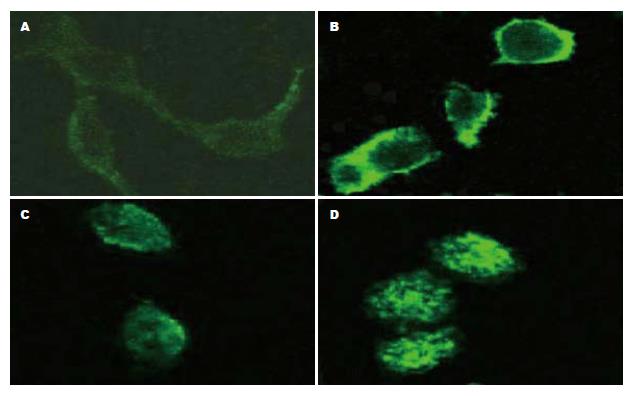
采用激光扫描共聚集显微镜观察发现, 对照组GES-1呈菱形或多边形等不规则形状, 8-OhdG很少表达, 荧光较弱(图2A); SGC-7901细胞8-OHdG荧光较强(图2C). 与H. pylori共培养24 h后, GES-1变圆, 几乎所有细胞胞质内都有8-OHdG表达, 荧光增强(图2B); SGC-7901细胞亦变圆, 荧光显著增强(图2D). 荧光表达强度见表1.
| 细胞株 | 测定值 | 差值 | 变化率(%) | |
| 对照组 | 加菌组 | |||
| GES-1 | 32.30 | 64.94 | 32.64 | 50.26 |
| SGC-7901 | 77.13 | 102.83 | 25.70 | 25.00 |
以平均荧光强度作为与H. pylori共培养前后GES-1和SGC-7901细胞8-OHdG的相对表达量, 应用SPSS11.5进行统计学分析发现, GES-1或SGC-7901细胞8-OHdG表达量, 加菌组与对照组相比均具有统计学意义(64.9396±17.8142 vs 32.3010±7.3620, P = 0.000和102.8344±30.2632 vs 77.1336±32.3223, P = 0.000, 图3), 而且8-OHdG表达的变化程度GES-1细胞显著高于SGC-7901细胞.
氧化性DNA损伤普遍存在于有氧代谢细胞中. 正常情况下, 细胞中氧化性DNA损伤的产生和修复处于一种动态平衡. 在有氧代谢过程中, 氧分子接受电子传递链传递的电子, 产生超氧阴离子(O2-), O2-通过链式反应产生活性氧(reactive oxygen spieces, ROS). 通常细胞能够通过激活自身的DNA损伤修复机制[5-7]及时地清除细胞中氧化性DNA损伤. 但当氧化性DNA损伤显著增加超过了细胞的修复能力或者细胞的DNA修复机制异常时, 这种损伤将会在细胞中累积[8], 导致抑癌基因p53基因和ras原癌基因等基因发生难以修复的DNA G→T或A→C碱基的错误配对及编码, 导致基因突变. 已有研究发现, 氧化性DNA损伤的产生和累积与各种胃黏膜病变的发生发展密切相关. H. pylori感染可通过诱导炎症细胞(如多形核中性粒细胞等)在胃黏膜局部的聚集, 导致胃黏膜内ROS的显著增加[9]. ROS可自由透过细胞膜, 损伤DNA[10]. 其中8-OhdG是ROS导致的最主要的DNA损伤标志物, 可作为反映DNA碱基序列受损程度的敏感指标.
本研究利用H. pylori悬液与人正常胃黏膜上皮细胞永生细胞株GES-1和人淋巴结转移胃腺癌细胞株SGC-7901共培养, 观察两种细胞株在H. pylori悬液作用下形态学变化及8-OhdG表达情况, 旨在了解H. pylori致胃上皮细胞和胃腺癌细胞DNA氧化性损伤作用. 结果发现与H. pylori悬液共培养24 h后, GES-1和SGC-7901细胞由多角形或不规则形变为圆形; 贴壁细胞减少, 悬浮细胞增多; 细胞之间连接减少甚至消失. 8-OHdG免疫荧光染色, 激光扫描共聚集显微镜观察发现: 未加菌组GES-1细胞8-OhdG很少表达, 荧光较弱; SGC-7901细胞8-OHdG荧光较强. 与H. pylori共培养24 h后, GES-1细胞和SGC-7901细胞8-OHdG表达荧光均增强. GES-1或SGC-7901细胞8-OHdG表达量, 加菌组与各自不加菌的对照组相比均具有统计学意义(P<0.01). 结果提示H. pylori能够诱导GES-1和SGC-7901细胞DNA氧化性损伤显著增加. H. pylori感染导致的氧化性DNA损伤可以出现在慢性浅表性胃炎→慢性萎缩性胃炎→肠上皮化生→异型增生→胃癌这一癌变模式的各个阶段[11-13]. DNA氧化性损伤的产生和累积在各种H. pylori相关疾病乃至胃癌的发病机制中具有重要意义. Xu et al[14]报道, H. pylori感染后, 氧自由基释放导致的氧化损伤可以诱导巨噬细胞凋亡, 进而引起宿主免疫耐受. 此外, 由于氧化损伤诱导的细胞凋亡还可以导致胃黏膜损伤, 以及代偿性高增殖, 提示H. pylori感染介导的氧化性DNA损伤可能是胃黏膜从慢性炎症到癌变的驱动力.
GES-1和SGC-7901是目前较为常用的研究H. pylori致病机制的细胞模型. 本研究观察了上述来源及属性不同的两种细胞株在H. pylori悬液作用下8-OhdG表达的差异. 结果发现, 无论是否与H. pylori共培养, SGC-7901细胞株8-OhdG表达量均显著高于GES-1细胞株. 这与人体组织学研究结果相一致. 有研究表明[15], 胃癌患者癌组织及癌旁组织中的8-OHdG均显著高于正常胃黏膜组织(P<0.001). 值得注意的是, 与H. pylori共培养后, GES-1细胞株8-OhdG表达量的增加程度显著高于SGC-7901细胞株. 提示H. pylori对人正常胃黏膜上皮细胞株的损伤强于对胃癌细胞株的损伤. GES-1为人正常胃黏膜上皮细胞永生细胞株[3], SGC-7901为从1例胃癌患者外科手术切除标本中获得的转移淋巴结, 在离体条件下应用静置培养自行建立的胃腺癌细胞株[4]. 因此, 与GES-1细胞相比, 来自于胃癌的SGC-7901细胞已经发生了某些DNA损伤性改变, 因此其未加菌处理组中即有高水平8-OhdG表达, 加菌后8-OhdG表达量的增加程度不明显. 而GES-1细胞因其来源于正常胃黏膜细胞, 因此DNA损伤性改变较轻, 加菌后8-OhdG表达量的增加程度明显提高. 结果提示, 在H. pylori氧化损伤的相关研究中, 更适宜选择对损伤作用敏感的GES-1细胞株作为研究对象.
总之, 本研究结果显示H. pylori能够直接诱导正常胃黏膜上皮细胞株GES-1和人胃腺癌细胞株SGC-7901的DNA氧化性损伤显著增加, 这为进一步探讨H. pylori诱导的DNA氧化性损伤在H. pylori相关疾病发病机制中的作用提供了实验依据.
感谢北京市肿瘤防治研究所细胞遗传室柯杨教授赠送GES-1细胞株.
幽门螺杆菌是引起慢性胃炎及消化性溃疡的重要致病因子, 且与胃癌的发生密切相关. 关于H. pylori引起胃黏膜病变的确切机制, 目前尚未完全明了. 研究表明, 氧化性DNA损伤的产生和累积与各种胃黏膜病变的发生发展密切相关.
白爱平, 副教授, 南昌大学第一附属医院消化内科.
8-羟基脱氧鸟苷是检测DNA氧化性损伤的敏感标志物, 本研究利用H. pylori悬液直接作用于体外培养的人胃上皮细胞株GES-1和人胃腺癌细胞株SGC-7901, 观察比较H. pylori对正常胃黏膜细胞和胃癌细胞的损伤, 旨在探讨H. pylori诱导的胃黏膜细胞DNA氧化性损伤在H. pylori相关疾病中的作用.
目前相关研究多局限于采用免疫组织化学法针对各类H. pylori相关胃黏膜病变的病理资料进行研究, 难以直接反映
H. pylori对胃黏膜上皮细胞DNA的氧化性损伤作用.
本研究体外观察了两种来源及属性不同的细胞株在H. pylori悬液作用下8-OhdG表达的差异. 结果发现, H. pylori能够诱导GES-1和SGC-7901细胞DNA氧化性损伤显著增加. 在H. pylori氧化损伤的相关研究中, 更适宜选择对损伤作用敏感的GES-1细胞株作为研究对象.
本研究为进一步探讨H. pylori诱导的DNA氧化性损伤在H. pylori相关疾病发病机制中的作用提供了实验依据.
8-羟基脱氧鸟苷(8-OhdG): 在有氧代谢过程中, 氧分子接受电子传递链传递的电子, 产生超氧阴离子(O2-), O2-通过链式反应产生活性氧(ROS). ROS可自由透过细胞膜损伤DNA, 8-OHdG是ROS导致的最主要的DNA损伤, 因此可作为反映DNA碱基序列受损程度的敏感指标.
本文选题较好, 设计合理, 结果可信, 具有很好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Peek RM Jr, Blaser MJ. Helicobacter pylori and gastrointestinal tract adenocarcinomas. Nat Rev Cancer. 2002;2:28-37. [PubMed] [DOI] |
| 2. | Wu LL, Chiou CC, Chang PY, Wu JT. Urinary 8-OHdG: a marker of oxidative stress to DNA and a risk factor for cancer, atherosclerosis and diabetics. Clin Chim Acta. 2004;339:1-9. [PubMed] [DOI] |
| 5. | Buschmann T, Potapova O, Bar-Shira A, Ivanov VN, Fuchs SY, Henderson S, Fried VA, Minamoto T, Alarcon-Vargas D, Pincus MR. Jun NH2-terminal kinase phosphorylation of p53 on Thr-81 is important for p53 stabilization and transcriptional activities in response to stress. Mol Cell Biol. 2001;21:2743-2754. [PubMed] [DOI] |
| 6. | Izumi T, Hazra TK, Boldogh I, Tomkinson AE, Park MS, Ikeda S, Mitra S. Requirement for human AP endonuclease 1 for repair of 3'-blocking damage at DNA single-strand breaks induced by reactive oxygen species. Carcinogenesis. 2000;21:1329-1334. [PubMed] [DOI] |
| 7. | Ding SZ, O'Hara AM, Denning TL, Dirden-Kramer B, Mifflin RC, Reyes VE, Ryan KA, Elliott SN, Izumi T, Boldogh I. Helicobacter pylori and H2O2 increase AP endonuclease-1/redox factor-1 expression in human gastric epithelial cells. Gastroenterology. 2004;127:845-858. [PubMed] [DOI] |
| 8. | Choi J, Yoon SH, Kim JE, Rhee KH, Youn HS, Chung MH. Gene-specific oxidative DNA damage in Helicobacter pylori-infected human gastric mucosa. Int J Cancer. 2002;99:485-490. [PubMed] [DOI] |
| 9. | Bréchard S, Bueb JL, Tschirhart EJ. Interleukin-8 primes oxidative burst in neutrophil-like HL-60 through changes in cytosolic calcium. Cell Calcium. 2005;37:531-540. [PubMed] [DOI] |
| 10. | Termini J. Hydroperoxide-induced DNA damage and mutations. Mutat Res. 2000;450:107-124. [PubMed] [DOI] |
| 11. | Nishibayashi H, Kanayama S, Kiyohara T, Yamamoto K, Miyazaki Y, Yasunaga Y, Shinomura Y, Takeshita T, Takeuchi T, Morimoto K. Helicobacter pylori-induced enlarged-fold gastritis is associated with increased mutagenicity of gastric juice, increased oxidative DNA damage, and an increased risk of gastric carcinoma. J Gastroenterol Hepatol. 2003;18:1384-1391. [PubMed] [DOI] |
| 12. | Normark S, Nilsson C, Normark BH, Hornef MW. Persistent infection with Helicobacter pylori and the development of gastric cancer. Adv Cancer Res. 2003;90:63-89. [PubMed] [DOI] |
| 13. | Farinati F, Cardin R, Degan P, Rugge M, Mario FD, Bonvicini P, Naccarato R. Oxidative DNA damage accumulation in gastric carcinogenesis. Gut. 1998;42:351-356. [PubMed] |
| 14. | Xu H, Chaturvedi R, Cheng Y, Bussiere FI, Asim M, Yao MD, Potosky D, Meltzer SJ, Rhee JG, Kim SS. Spermine oxidation induced by Helicobacter pylori results in apoptosis and DNA damage: implications for gastric carcinogenesis. Cancer Res. 2004;64:8521-8525. [PubMed] [DOI] |
| 15. | Chang CS, Chen WN, Lin HH, Wu CC, Wang CJ. Increased oxidative DNA damage, inducible nitric oxide synthase, nuclear factor kappaB expression and enhanced antiapoptosis-related proteins in Helicobacter pylori-infected non-cardiac gastric adenocarcinoma. World J Gastroenterol. 2004;10:2232-2240. [PubMed] |