修回日期: 2009-11-04
接受日期: 2009-11-09
在线出版日期: 2009-12-08
目的: 探讨环氧化酶-2(COX-2)特异性抑制剂塞来昔布(celecoxib)治疗肝门部胆管癌的临床疗效.
方法: 对24例不可切除的肝门部胆管癌患者, 采用塞来昔布治疗, 并与同期随机的17例患者(对照组)进行前瞻性比较, 分析2组生存期、塞来昔布治疗的安全性及其镇痛效果.
结果: 塞来西布组的生存期高于未服用组, 2组生存时间有显著性差异(11.5 mo vs 9.6 mo, P<0.05); 塞来西布组患者未发生明显的不良反应, 他对疼痛缓解的总有效率为83.3%.
结论: 塞来昔布可能是治疗肝门部胆管癌安全、有效的新方法.
引文著录: 吴高松, 马小鹏, 汪杰, 黄丽丽, 刘岩岩, 尹玉平, 刘捷. 塞来昔布治疗肝门部胆管癌24例. 世界华人消化杂志 2009; 17(34): 3558-3560
Revised: November 4, 2009
Accepted: November 9, 2009
Published online: December 8, 2009
AIM: To investigate the clinical efficacy of celecoxib, a cyclooxygenase-2 (COX-2) selective inhibitor, in the treatment of hilar cholangiocarcinoma.
METHODS: Forty-one patients with hilar cholangiocarcinoma were randomly divided into two groups: 24 consecutive patients undergoing treatment with celecoxib (200 mg PO qd; treatment group), and 17 consecutive patients not undergoing celecoxib treatment (control group). The survival time of patients in the two groups was compared. The analgesic effect and safety of the drug were also analyzed.
RESULTS: The survival time of patients in the treatment group was significantly higher than that in the control group (11.5 mo vs 9.6 mo, P < 0.05). N obvious complications were observed in patients treated with celecoxib. Pain relief was noted in 83.3% of patients in the treatment group.
CONCLUSION: Celecoxib is safe and effective in improving the survival time of patients with advanced hilar cholangiocarcinoma.
- Citation: Wu GS, Ma XP, Wang J, Huang LL, Liu YY, Yin YP, Liu J. Efficacy of celecoxib in the treatment of hilar cholangiocarcinoma: an analysis of 24 cases. Shijie Huaren Xiaohua Zazhi 2009; 17(34): 3558-3560
- URL: https://www.wjgnet.com/1009-3079/full/v17/i34/3558.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i34.3558
肝门部胆管癌起病隐匿, 目前总体疗效欠佳, 复发率高, 预后较差[1]. 寻找一种高效低毒的药物辅助治疗晚期肿瘤是许多学者研究的方向. COX-2是前列腺素生物合成过程中的一个重要限速酶. 近年来研究表明, COX-2不仅是炎症反应的中心环节, COX-2基因表达的蛋白更被认为是一种原癌蛋白, 其对多种人类肿瘤的发生与发展中起着重要的促进作用. 已有体外实验证实COX-2选择性抑制剂能诱导多种肿瘤细胞凋亡、抑制其生长. 我们将塞来昔布用于肝门部胆管癌伴轻度癌痛需服用镇痛药物的患者, 在观察期镇痛效果的同时, 经前瞻性对比研究发现, 塞来昔布治疗肝门部胆管癌有效, 治疗期间未发现明显不良反应.
2003-06/2007-06华中科技大学同济医学院附属同济医院普外科、肿瘤科、消化内科以及作者在外院会诊治疗的肝门部胆管癌41例患者, 其中男26例, 女15例. 中位年龄56(38-76)岁. 塞来昔布组24例, 男15例, 女9例, 中位年龄57.7岁; 对照组17例, 男11例, 女6例, 中位年龄54.7岁. 患者均成功行ERCP胆道支架置入治疗, 患者伴有轻度癌痛的症状. 13例伴肝脏转移, 12例有中度黄疸, 2例伴骨转移, 2例伴少量腹水, 1例伴肺转移. 根据Bismuth-Corlette分类法: Ⅰ型5例(12.2%)、Ⅱ13例(31.7%)、Ⅲa型8例(19.5%)、Ⅲb型7例(17.1%)及Ⅳ型8例(19.5%). 2组患者病期、年龄等无统计学差异.
41例患者随机入组分为塞来昔布组和对照组. 塞来昔布组: 口服塞来昔布(商品名-西乐葆)200 mg, ERCP术后2 wk开始, 每天1次, 1-6 mo. 对照组不服塞来昔布. 入组标准: 影像学检查以及病理活检证实为肝门部胆管癌; 并且均成功行ERCP胆道支架置入治疗; 且无磺胺过敏史(塞来昔布禁忌证). 剔除标准: 无完整随访资料者, 因外伤以及ERCP术后并发症等原因意外死亡者不入组, 服用中药抗肿瘤治疗以及采用其他方法治疗者. 经患者知情同意, 告知患者服用塞来昔布主要目的为镇痛, 对其是否能抑制肿瘤目前没有结论.
镇痛效果的评定标准: 参考WHO疼痛分级标准. 完全缓解: 疼痛基本消失或疼痛明显减轻,对日常生活无影响; 部分缓解: 疼痛有所减轻, 但对日常生活及饮食、睡眠仍有影响; 无效: 疼痛无变化或加重, 需服用其他镇痛药.
统计学处理 以放置支架完成为起点, 死亡时间为终点; 中位生存时间采用Kaplan-Meier做生存分析. 不良反应比较采用χ2检验. 应用SPSS13.0统计软件, P<0.05为差异有统计学意义.
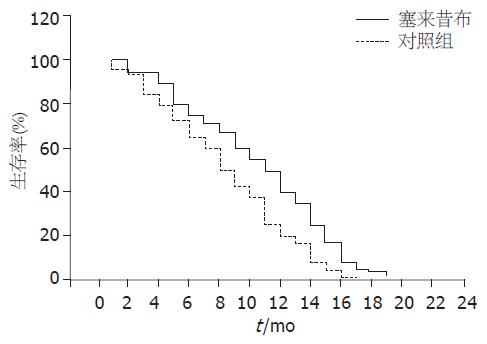
塞来昔布组中位生存时间比对照组延长. 塞来昔布组全组中位生存期11.5 mo(95%CI: 4.5-18.9); 对照组: 全组中位生存期9.6 mo (95%CI: 3.6-17.8); 2组比较差异有统计学意义(P<0.05). 2组服药期间严重不良事件比较, 消化系出血、肝功能损害、肾功能损害、心脑血管意外的发生率均无显著差异(图1, 表1).
| 严重不良事件 | 塞来昔布组(n=24) | 对照组(n=17) | ||
| n | 发生率(%) | n | 发生率(%) | |
| 胃肠道出血 | 3 | 12.5 | 2 | 11.8 |
| 肝功能损害 | 5 | 20.8 | 4 | 23.5 |
| 肾功能损害 | 1 | 4.2 | 0 | 0.0 |
| 心脑血管意外 | 1 | 4.2 | 1 | 5.9 |
塞来昔布组24例患者服药2-3 wk时腹痛情况: 完全缓解者4例(16.7%), 部分缓解者16例(66.7%), 无效者4例(16.7%). 总有效率83.3%.
目前, 肝门部胆管癌的常规手术切除可能已达到一定限度, 需要在治疗观念上有所突破, 才可能获得更好的效果[2]. 寻找一种高效低毒的药物辅助治疗晚期肿瘤是许多学者研究的方向. COX参与维持机体各种生理和病理过程, COX-1是一种结构酶, 他催化产生的PG参与机体正常生理过程和保护功能, COX-2被认为是诱导型酶, 只在病理情况下才表达, 包括炎症、缺氧、损伤、修复及肿瘤的生长和转移[3]. 许多癌前病变和恶性肿瘤均有COX-2基因扩增和蛋白的高表达, COX-2基因表达的蛋白被认为是一种原癌蛋白; COX-2在多种人类肿瘤的发生与发展中起着重要的作用[4-5]; 其主要机制包括: 刺激肿瘤细胞的增殖及抑制细胞凋亡[6]、参与前致癌物的代谢、抑制机体免疫[7]、刺激肿瘤新生血管形成、影响肿瘤细胞周期[8]等; Patti et al[9]认为COX-2在肿瘤组织中过表达所产生的PGE2, 实际上是大部分肿瘤细胞形成和存活的基础; COX-2抑制剂降低COX-2的表达, 能够减少PGE2的合成, 从而能抑制肿瘤细胞增生、诱导其凋亡. 有效抑制COX-2的表达可能对肿瘤发生、发展具有重要意义[10-11].
塞来昔布是已在我国上市的COX-2选择性抑制剂, 可通过抑制COX-2阻止炎性前列腺素类物质的产生, 达到抗炎、镇痛及退热作用; 作为非甾体类抗炎镇痛药用于临床. 近年来有研究发现: 塞来昔布对胰腺癌的生长有抑制作用, 同时还可增强多种化疗药物对肿瘤的杀伤作用[12-13]; 塞来昔布可使偶氮甲烷所致的大肠癌的发生率和数量分别减少93%和97%, 并抑制结肠异常腺管灶的形成[14].
我们在前期的实验中已证实[4-5,15-17]: COX-2在胆管细胞癌中高表达; COX-2反义基因转染能通过改变细胞周期的机制, 抑制胆管癌细胞(QBC939细胞)的增生; 塞来昔布通过COX-2和PGE2途径能抑制人胆囊癌细胞生长和诱导凋亡. 本文通过前瞻性体内研究发现, 口服塞来昔布的胆管癌患者, 与对照组比较, 生存时间延长, 服药期间未发现严重的不良反应. 作者初步认为塞来昔布对治疗肝门部胆管癌有效, 除了传统的镇痛作用还有抗肿瘤的效应, 具有一定得临床应用价值.
目前, 肝门部胆管癌的常规手术切除可能已达到一定限度, 需要在治疗观念上有所突破, 才可能获得更好的效果. 寻找一种高效低毒的药物辅助治疗晚期肿瘤是许多学者研究的方向.
巩鹏, 教授, 大连医科大学附属第一医院普外二科
本研究证实, 口服塞来昔布的胆管癌患者, 生存时间延长, 服药期间未发现严重的不良反应. 塞来昔布除了传统的镇痛作用还有抗肿瘤的效应, 具有一定得临床应用价值.
本研究为肝门部胆管癌的治疗提供了有力的证据和借鉴, 具有重要的临床价值.
编辑: 李军亮 电编: 何基才
| 1. | 孙 学军, 石 景森, 何 平. 影响胆管癌切除术后的预后因素分析. 中国普外基础与临床杂志. 2006;13:85-88. |
| 4. | Wu GS, Zou SQ, Liu ZR, Wang DY. Bile from a patient with anomalous pancreaticobiliary ductal union promotes the proliferation of human cholangiocarcinoma cells via COX-2 pathway. World J Gastroenterol. 2003;9:1094-1097. [PubMed] |
| 5. | Wu GS, Zou SQ, Liu ZR, Tang ZH, Wang JH. Celecoxib inhibits proliferation and induces apoptosis via prostaglandin E2 pathway in human cholangiocarcinoma cell lines. World J Gastroenterol. 2003;9:1302-1306. [PubMed] |
| 6. | Michael MS, Badr MZ, Badawi AF. Inhibition of cyclooxygenase-2 and activation of peroxisome proliferator-activated receptor-gamma synergistically induces apoptosis and inhibits growth of human breast cancer cells. Int J Mol Med. 2003;11:733-736. [PubMed] |
| 7. | Pockaj BA, Basu GD, Pathangey LB, Gray RJ, Hernandez JL, Gendler SJ, Mukherjee P. Reduced T-cell and dendritic cell function is related to cyclooxygenase-2 overexpression and prostaglandin E2 secretion in patients with breast cancer. Ann Surg Oncol. 2004;11:328-339. [PubMed] [DOI] |
| 8. | Shishodia S, Aggarwal BB. Cyclooxygenase (COX)-2 inhibitor celecoxib abrogates activation of cigarette smoke-induced nuclear factor (NF)-kappaB by suppressing activation of IkappaBalpha kinase in human non-small cell lung carcinoma: correlation with suppression of cyclin D1, COX-2, and matrix metalloproteinase-9. Cancer Res. 2004;64:5004-5012. [PubMed] [DOI] |
| 9. | Patti R, Gumired K, Reddanna P, Sutton LN, Phillips PC, Reddy CD. Overexpression of cyclooxygenase-2 (COX-2) in human primitive neuroectodermal tumors: effect of celecoxib and rofecoxib. Cancer Lett. 2002;180:13-21. [PubMed] [DOI] |
| 14. | Jacoby RF, Cole CE, Tutsch K, Newton MA, Kelloff G, Hawk ET, Lubet RA. Chemopreventive efficacy of combined piroxicam and difluoromethylornithine treatment of Apc mutant Min mouse adenomas, and selective toxicity against Apc mutant embryos. Cancer Res. 2000;60:1864-1870. [PubMed] |
| 15. | Wu GS, Wang JH, Liu ZR, Zou SQ. Expression of cyclooxygenase-1 and -2 in extra-hepatic cholangiocarcinoma. Hepatobiliary Pancreat Dis Int. 2002;1:429-433. [PubMed] |
| 16. | Wu GS, Zou SQ, Wu XY, Qiu FZ. Effects of cyclooxygenase-2 antisense vector on proliferation of human cholangiocarcinoma cells. Chin Med Sci J. 2004;19:89-92. [PubMed] |