修回日期: 2009-11-15
接受日期: 2009-11-16
在线出版日期: 2009-12-08
目的: 探讨转染TGF-β1反义寡核苷酸(TGF-β1-ASODN)对食管鳞癌细胞EC9706增殖及凋亡的影响.
方法: 将化学合成的TGF-β1-ASODN转染食管鳞癌细胞EC9706, 采用RT-PCR和流式细胞术检测转染效率; 观察TGF-β1-ASODN转染后细胞形态学的改变; 采用MTT和流式细胞术检测TGF-β1-ASODN转染后对细胞增殖及凋亡的影响.
结果: 转染TGF-β1-ASODN可有效抑制EC9706细胞中TGF-β1的活性, 其mRNA及蛋白的表达均明显低于转染前的水平(0.25±0.07 vs 0.43±0.09; 35.35% vs 41.38%, 均P<0.05); TGF-β1-ASODN可明显促进细胞增殖、抑制细胞凋亡, 转染后细胞生长拥挤失去正常形态, 细胞存活率高于转染前(109.4% vs 100.0%, P<0.05), G1期、S期细胞百分比低于转染前, G2期细胞百分比则高于转染前, 细胞凋亡率低于转染前(62.9% vs 66.5%; 21.3% vs 23.7%; 14.8% vs 9.8%; 0.69% vs 0.96%, 均P<0.05).
结论: TGF-β1-ASODN可高效特异地将TGF-β1基因沉默, 并解除其抑制细胞增殖、阻滞细胞周期、促进细胞凋亡的作用.
引文著录: 张红燕, 李珊珊, 孙洋, 王新华, 阎爱华, 王小军. TGF-β1反义寡核苷酸对食管鳞癌细胞EC9706增殖及凋亡的影响. 世界华人消化杂志 2009; 17(34): 3480-3485
Revised: November 15, 2009
Accepted: November 16, 2009
Published online: December 8, 2009
AIM: To investigate the effects of transforming growth factor-beta 1 antisense oligonucleotide ASODN (TGF-β1-ASODN) on cell proliferation and apoptosis in human esophageal squamous cell carcinoma cell line EC9706.
METHODS: EC9706 cells were transfected with chemically synthesized TGF-β1-ASODN. The expression of TGF-β1 mRNA and protein was detected by reverse transcription-polymerase chain reaction (RT-PCR) and flow cytometry, respectively. Cell morphological changes were observed. The proliferation and apoptosis of EC9706 cells were measured by methyl thiazolyl tetrazolium (MTT) assay and flow cytometry, respectively.
RESULTS: After TGF-β1-ASODN transfection, the expression levels of TGF-β1 mRNA and protein in EC9706 cells were significantly lower than those in untransfected EC9706 cells (0.25 ± 0.07 vs 0.43 ± 0.09 and 35.35% vs 41.38%, respectively; both P < 0.05). TGF-β1-ASODN transfection could stimulate proliferation and inhibit apoptosis of EC9706 cells. After transfection, EC9706 cells lost their normal morphology. Compared with untransfected cells, the survival rate increased (109.4% vs 100.0%, P < 0.05), the percentages of cells in G1 and S phases decreased (62.9% vs 66.5% and 21.3% vs 23.7%, respectively; both P < 0.05), the percentage of cells in G2 phase rose (14.8% vs 9.8%, P < 0.05), and the apoptosis rate declined in cells transfected with TGF-β1-ASODN (0.69% vs 0.96%, P < 0.05).
CONCLUSION: TGF-β1-ASODN can silence the expression of the TGF-β1 gene efficiently and specially, and antagonize TGF-β1-mediated proliferation inhibition, cell cycle arrest and apoptosis in EC9706 cells.
- Citation: Zhang HY, Li SS, Sun Y, Wang XH, Yan AH, Wang XJ. TGF-β1 antisense oligonucleotide ASODN promotes cell proliferation but inhibits apoptosis in human esophageal squamous cell carcinoma cell line EC9706. Shijie Huaren Xiaohua Zazhi 2009; 17(34): 3480-3485
- URL: https://www.wjgnet.com/1009-3079/full/v17/i34/3480.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i34.3480
转化生长因子-β(transforming growth factor beta, TGF-β)是一类多功能的多肽类细胞因子, 首先由Assoian et al[1]于1983年自人血小板中成功提取, 已被证实对细胞增殖分化、细胞外基质产生、血管生成以及细胞凋亡等起重要的调控作用[2]. 近年来发现, TGF-β对肿瘤的作用极其复杂且可能相互矛盾, 在肿瘤早期可抑制细胞增殖、启动细胞分化诱导凋亡; 但在肿瘤的进展期则可通过多种机制促进肿瘤的侵袭和转移[3-5]. 为探讨TGF-β1对食管鳞癌细胞的作用, 本研究运用反义寡核苷酸技术观察了TGF-β1-ASODN对食管鳞癌细胞EC9706增殖及凋亡的影响.
食管鳞癌细胞系EC9706由中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室惠赠.
1.2.1 细胞培养: EC9706细胞在含有100 mL/L的胎牛血清、100 kU/L青霉素、100 mg/L链霉素的RPMI 1640培养基中生长, 并置于37 ℃, 50 mL/L CO2的条件下培养, 实验细胞均处于对数生长期.
1.2.2 TGF-β1-ASODN转染EC9706细胞: 根据文献设计合成针对TGF-β1第一启动子的反义寡核苷酸片段[6], 启动子序列: GGCGCCGCCTCCCCCATGCCGCCCTCCGGG, TGF-β1-ASODN: CCCGGAGGGCGGCATGGGGG, 由北京赛百盛生物技术有限公司合成, 硫代磷酸化修饰, PAGE纯化, 纯度99.9%. 将细胞分为3组, 转染反义寡核苷酸组(ASODN); 转染试剂组(不加反义寡核苷酸仅仅加入转染试剂); 未转染组(不进行任何操作的EC9706细胞). 按KeyGen公司转染试剂说明书将TGF-β1-ASODN(0.2 g/L)转入EC9706细胞中.
1.2.3 观察转染后EC9706细胞形态学改变: 在细胞培养状态下, 用倒置显微镜分别观察各组细胞的生长状态及形态学改变.
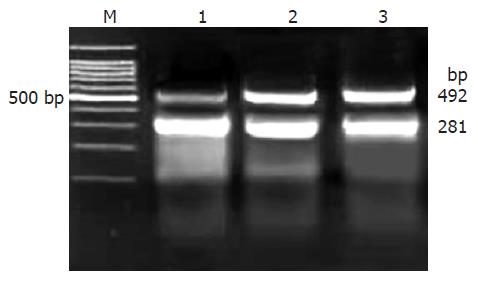
1.2.4 RT-PCR检测EC9706细胞TGF-β1 mRNA表达: TGF-β1引物序列[7]: 上游: 5'- CACATCAGAGCTCCGAGAAG-3', 下游: 5'-GGTCCTTGCGGAAGTCAATG-3', 片段大小: 492 bp, 由北京赛百盛生物技术有限公司合成; 内参β-actin引物序列: 上游: 5'-GTGGACATCCGCAAAGAC-3', 下游: 5'-TCATAGTCCGCCTAGAAGC-3', 片段大小: 281 bp, 由北京奥科生物技术有限公司合成. 按照TRIzol总RNA抽提纯化试剂盒说明(Invitrogen公司)抽提总RNA. 取1 μL总RNA加入50 μL的反应体系中, 根据OneStep RT-PCR Kit(宝生物工程公司有限公司)的说明, 在同一反应体系中同时扩增内参和目的基因. 取5 μL PCR 产物, 2 g/L琼脂糖电泳, 对凝胶进行灰度扫描并对灰度值进行统计学处理.
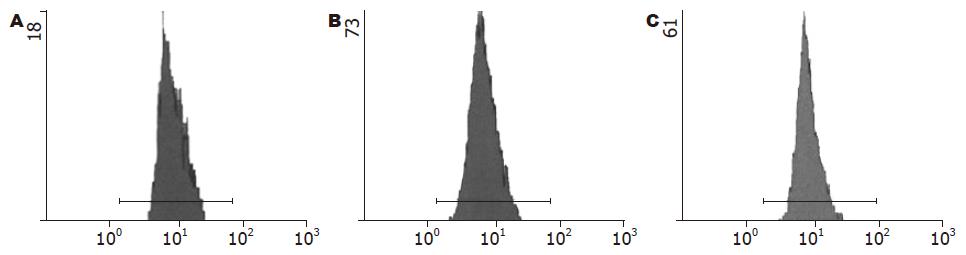
1.2.5 流式细胞术检测EC9706细胞TGF-β1蛋白表达: 将细胞用胰酶消化, 1000 r/min离心5 min, 弃去上清; 用PBS洗2遍, 离心后弃去, 加入70%冰乙醇固定, 过夜; 取单细胞悬液1×106/mL, 加入鼠抗人TGF-β1 mAb(北京中山金桥生物公司)工作液100 μL, 室温孵育30 min; 加入PBS 10 mL洗涤1次, 弃上清; 加入羊抗鼠FITC-IgG二抗工作液100 μL, 避光室温孵育30 min; 加入PBS 10 mL洗涤1次, 加入PBS 0.1 mL经500目铜网过滤后流式细胞仪检测TGF-β1蛋白.
1.2.6 四甲基偶氮唑蓝(MTT)法检测EC9706细胞增殖活性: 将细胞按每孔5×103铺入96孔板, 培养24 h后进行转染, 在72 h时按常规方法加入MTT、二甲基亚砜, 用酶标仪测定各孔的A492, 并计算细胞存活率(细胞存活率 = 实验组A均值/对照组A均值×100%).
1.2.7 流式细胞术检测EC9706细胞凋亡及细胞周期: 细胞准备同1.2.5, 取单细胞悬液1×109/L, 加1 mL PI(100 mg/L), 避光30 min, 流式细胞仪检测细胞凋亡及细胞周期.
统计学处理 所有数据均经SPSS13.0软件进行统计分析. 计数资料采用阳性率表示, 阳性率之间的比较采用χ2检验; 计量资料采用mean±SD表示, 2组均数的比较用t检验. 显著性水准α = 0.05.
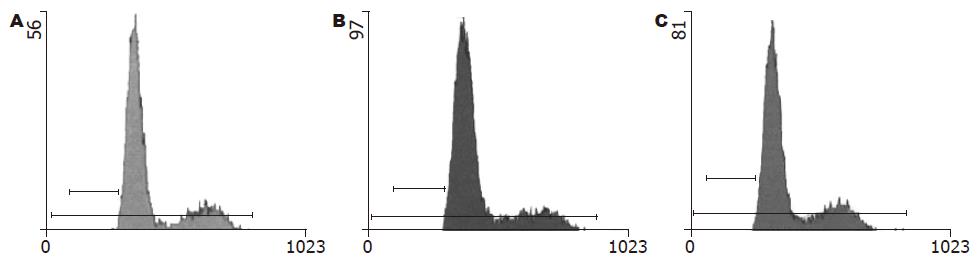
RT-PCR结果显示, TGF-β1片段大小为492 bp(图1). 经TGF-β1/β-actin mRNA半定量分析显示, 转染TGF-β1-ASODN后72 h, EC9706细胞TGF-β1 mRNA的表达水平明显低于对照组(P<0.01, 表1, 图1). 流式细胞术结果显示, 转染TGF-β1-ASODN后72 h, EC9706细胞TGF-β1蛋白阳性表达率明显低于对照组(P<0.01, 表1, 图2). 以上结果表明, TGF-β1-ASODN可有效抑制TGF-β1基因的表达.
| 分组 | TGF-β1 mRNA | t值 | P值 | TGF-β1蛋白 | χ2值 | P值 | |
| 细胞数 | 阳性率(%) | ||||||
| TGF-β1-ASODN组 | 0.25±0.07 | 5741 | 35.35 | ||||
| 转染试剂组 | 0.44±0.09 | 17.085 | 0.002 | 5628 | 45.32 | 157.108 | 0.000 |
| 未转染组 | 0.43±0.09 | 13.847 | 0.000 | 2061 | 41.38 | 23.513 | 0.000 |
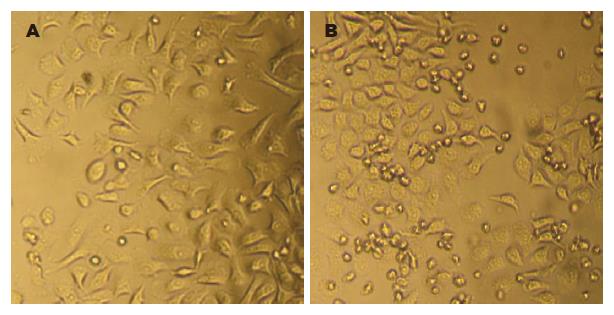
倒置显微镜下观察发现, 未转染组部分细胞呈多边形, 部分细胞呈梭形、菱形或泪滴形, 边缘锐利, 癌细胞呈散在分布或呈片状、放射状、条索状排列, 细胞轮廓清楚, 贴壁生长, 生长旺盛. 转染TGF-β1-ASODN组, 24 h, 癌细胞折光性减弱, 形态基本正常; 48 h, 细胞体积变小, 细胞形态变圆滑, 呈圆形、椭圆形或方形, 细胞间隙变宽, 细胞胞质减少、颗粒增多, 折光性差; 72 h, 细胞生长拥挤失去正常形态, 部分细胞死亡脱落而悬浮于培养液中(图3).
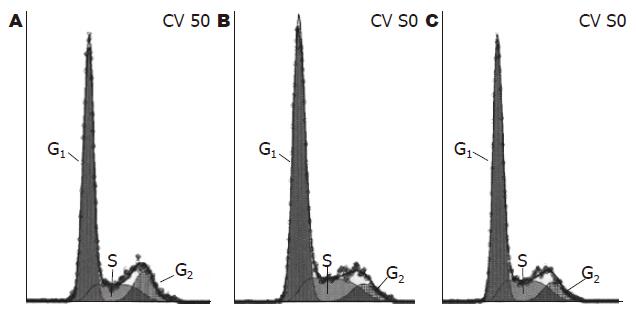
流式细胞术检测细胞周期, 结果显示转染TGF-β1-ASODN组G1期、S期细胞较对照组减少(P<0.01), 而G2期细胞较对照组增多(P<0.01, 表2, 图4); MTT法检测结果显示转染TGF-β1-ASODN组细胞的存活率较对照组高(P<0.05, 表3). 表明TGF-β1-ASODN可使EC9706细胞增殖加快.
| 分组 | 细胞数 | G1(%) | χ2值 | P值 | G2(%) | χ2值 | P值 | S(%) | χ2值 | P值 |
| TGF-β1-ASODN组 | 24332 | 62.9 | 14.8 | 21.3 | ||||||
| 转染试剂组 | 7325 | 65.1 | 11.653 | 0.001 | 10.7 | 79.171 | 0.000 | 24.2 | 27.686 | 0.000 |
| 未转染组 | 8873 | 66.5 | 15.204 | 0.004 | 9.8 | 93.521 | 0.000 | 23.7 | 1293.858 | 0.000 |
| 分组 | A值 | 存活率(%) | t值 | P值 |
| TGF-β1-ASODN组 | 0.58±0.11 | 109.4 | ||
| 转染试剂组 | 0.53±0.09 | 96.2 | 4.272 | 0.043 |
| 未转染组 | 0.53±0.09 | 100.0 | 4.445 | 0.039 |
流式细胞术检测细胞凋亡, 结果显示, 转染TGF-β1-ASODN组细胞凋亡率较对照组降低(P<0.05), 表明TGF-β1-ASODN可抑制EC9706细胞凋亡(表4, 图5).
| 分组 | 细胞数 | 凋亡百分率(%) | χ2值 | P值 |
| TGF-β1-ASODN组 | 24332 | 0.69 | ||
| 转染试剂组 | 7325 | 0.95 | 5.306 | 0.021 |
| 未转染组 | 8873 | 0.96 | 6.154 | 0.013 |
TGF-β在机体的胚胎发育、创伤修复、免疫调节、细胞外基质的合成和储存等方面发挥重要作用, 同时也对许多细胞的生长具有调节作用. TGF-β对细胞的作用可表现为刺激或抑制, 这主要取决于细胞的类型、来源、分化状态和实验条件的不同. 体外研究表明, TGF-β家族成员可抑制上皮细胞的增殖, 促进细胞凋亡, 但对不同的肿瘤细胞其作用还有待进一步探讨.
本研究根据文献[6]合成针对TGF-β1第一启动子的反义寡核苷酸(TGF-β1-ASODN), 并进行硫代磷酸化修饰, 运用阳离子聚合物瞬时转染食管鳞癌细胞EC9706, 观察TGF-β1-ASODN对EC9706细胞增殖及凋亡的影响. RT-PCR结果显示, 转染TGF-β1-ASODN后24 h TGF-β1 mRNA的表达水平即有所下降, 72 h(0.25±0.07)明显低于转染前(0.43±0.09, P<0.01), 而同一样本中TGF-β1-ASODN非靶向基因β-actin的表达未见明显变化. 流式细胞术结果也显示, 转染后TGF-β1蛋白的表达(35.35%)明显低于转染前(41.38%, P<0.01). 以上结果表明, TGF-β1-ASODN可以高效特异地将TGF-β1基因沉默, 这为进一步研究TGF-β1-ASODN对食管鳞癌细胞的增殖及凋亡的影响奠定了基础.
正常的TGF-β功能取决于正常的TGF-β信号通路, TGF-β具有抑制细胞增殖及促进凋亡的作用. TGF-β抑制细胞增殖主要是对细胞周期的阻滞作用[8-10]. G1期向S期转化是细胞周期调控的关卡, 细胞一旦通过此控制点, 将通过整个细胞周期. 本研究结果显示, TGF-β1-ASODN转染EC9706细胞后, G2期细胞明显增多, 其百分比(14.8%)明显高于转染前(9.8%), 而G1期的细胞减少, 其百分比(62.9%)低于转染前(66.5%), S期细胞百分比(21.3%)也明显低于转染前(23.7%). 由此可见, TGF-β1-ASODN对食管鳞癌细胞EC9706中TGF-β1的特异性抑制, 可能解除了TGF-β1对细胞的生长抑制, 使得细胞通过G1期及S期, 进入G2期, 导致有更多的细胞进行细胞分裂. 本研究MTT检测结果也证实转染TGF-β1-ASODN后72 h, 细胞存活率(109.4%)明显高于转染前(100%, P<0.05), 细胞增殖加快, 提示转染TGF-β1-ASODN后, 细胞增殖活性增强. 转染之后细胞形态学的改变也提示TGF-β1-ASODN对TGF-β1基因的抑制, 导致EC9706细胞增长速度加快. 72 h时, 细胞生长明显拥挤并失去正常形态, 使得部分细胞死亡脱落而悬浮于培养液中.
TGF-β1不仅可抑制上皮细胞的增殖并对细胞凋亡具有诱导作用. Patel et al[11]的研究结果表明, TGF-β1对肝癌细胞凋亡具有诱导作用. 本研究转染TGF-β1-ASODN对EC9706细胞凋亡的影响也是显而易见的, 在转染TGF-β1-ASODN后, 细胞凋亡率降低(转染前: 0.96%, 转染后: 0.69%, P<0.05), 表明以TGF-β1-ASODN沉默TGF-β1基因, 可阻断TGF-β1对食管鳞癌细胞EC9706的凋亡促进作用.
对大多数上皮细胞TGF-β1发挥着生长抑制作用, 本研究结果提示TGF-β1对食管鳞癌细胞EC9706也具有生长抑制及诱导凋亡的作用. TGF-β抑制细胞增殖的机制主要是对细胞周期的阻滞作用. TGF-β在G1期发挥调节细胞周期的作用, 这些作用主要通过对细胞周期素(cyclin)、细胞周期素依赖激酶(cyclin-dependent kinase, CDK)、细胞周期素依赖激酶抑制因子(cyclin-dependent kinase inhibitor, CKI)以及c-Myc[12-13]的表达水平及功能状态进行调控, 最终使pRB去磷酸化而活化, 活化的pRB结合并抑制大量生长因子, 导致细胞停滞在G1期. 此外, TGF-β1对细胞凋亡的诱导可能通过以下途径: (1)提高细胞内组织型转谷氨酰胺酶的含量; (2)与c-Myc基因相互作用; (3)抑制RB蛋白的表达及磷酸化或与其他凋亡相关基因相互作用. 这些调节过程始终离不开TGF-β1/Smads信号的正常转导, 信号通路中任何分子的异常都可能干扰细胞周期的正常运转, 从而成为肿瘤发生的诱因. TGF-β1-ASODN可以高效特异地将TGF-β1基因沉默, 解除其促进细胞凋亡、阻滞细胞周期、抑制细胞增殖的作用. 本研究结果显示的TGF-β1对食管癌细胞增殖及凋亡的影响有助于进一步探讨TGF-β1在食管癌发生发展中的作用.
食管癌是世界范围内, 特别是中国河南省死亡率较高的恶性肿瘤之一, 严重危害人们的生命健康. 因此研究食管癌的发病机制对于降低肿瘤患者的死亡率尤为重要.
李玉明, 教授, 江苏省南通市第一人民医院消化内科
Gong et al的研究结果显示, TGF-β1可导致大肠癌细胞细胞周期受阻, 细胞生长受抑. Patel et al的研究结果表明, TGF-β1对肝癌细胞凋亡具有诱导作用.
TGF-β对肿瘤的作用极其复杂且可能相互矛盾, 本研究运用反义寡核苷酸技术观察TGF-β1-ASODN对食管鳞癌细胞增殖及凋亡的影响, 可明确TGF-β1对食管癌细胞的作用, 并为阐明食管癌的发病机制奠定基础.
本研究提示, TGF-β1-ASODN可以高效特异地将TGF-β1基因沉默, 解除其促进细胞凋亡、阻滞细胞周期、抑制细胞增殖的作用. 这有助于进一步探讨TGF-β1在食管癌发生发展中的作用.
本研究科学地观察并分析了TGF-β1反义寡核苷酸对食管鳞癌细胞EC9706增殖及凋亡的影响, 有一定先进性和可读性.
编辑: 李军亮 电编: 何基才
| 1. | Assoian RK, Komoriya A, Meyers CA, Miller DM, Sporn MB. Transforming growth factor-beta in human platelets. Identification of a major storage site, purification, and characterization. J Biol Chem. 1983;258:7155-7160. [PubMed] |
| 3. | Pasche B. Role of transforming growth factor beta in cancer. J Cell Physiol. 2001;186:153-168. [PubMed] [DOI] |
| 4. | Roberts AB, Wakefield LM. The two faces of transforming growth factor beta in carcinogenesis. Proc Natl Acad Sci USA. 2003;100:8621-8623. [PubMed] [DOI] |
| 6. | Romeo D, Allison RS, Kondaiah P, Wakefield LM. Recharacterization of the start sites for the major human transforming growth factor-beta 1 mRNA. Gene. 1997;189:289-295. [PubMed] [DOI] |
| 7. | 王 医术, 李 玉林, 李 一雷, 王 心蕊, 张 丽红. TGFβ1在乳腺癌间质新生血管周细胞中的表达. 吉林大学学报(医学版). 2004;30:684-686. |
| 8. | Alexandrow MG, Moses HL. Transforming growth factor beta and cell cycle regulation. Cancer Res. 1995;55:1452-1457. [PubMed] |
| 10. | Gong J, Ammanamanchi S, Ko TC, Brattain MG. Transforming growth factor beta 1 increases the stability of p21/WAF1/CIP1 protein and inhibits CDK2 kinase activity in human colon carcinoma FET cells. Cancer Res. 2003;63:3340-3346. [PubMed] |
| 11. | Patel T, Gores GJ. Apoptosis and hepatobiliary disease. Hepatology. 1995;21:1725-1741. [PubMed] |
| 12. | Warner BJ, Blain SW, Seoane J, Massagué J. Myc downregulation by transforming growth factor beta required for activation of the p15(Ink4b) G(1) arrest pathway. Mol Cell Biol. 1999;19:5913-5922. [PubMed] |
| 13. | Hu X, Cress WD, Zhong Q, Zuckerman KS. Transforming growth factor beta inhibits the phosphorylation of pRB at multiple serine/threonine sites and differentially regulates the formation of pRB family-E2F complexes in human myeloid leukemia cells. Biochem Biophys Res Commun. 2000;276:930-939. [PubMed] [DOI] |