修回日期: 2009-11-09
接受日期: 2009-11-09
在线出版日期: 2009-11-28
目的: 探讨维药西帕依溃结安对溃疡性结肠炎模型大鼠结肠组织中即刻早期原癌基因c-jun表达的影响.
方法: 采用2, 4-二硝基氯苯(DNCB)与乙酸复合法制备大鼠溃疡性结肠炎模型, 分为5组进行实验. 应用RT-PCR和Western blot方法分别检测各组c-jun mRNA及其蛋白质表达.
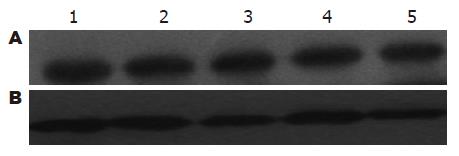
结果: 在对大鼠溃疡性结肠炎模型治疗中, 维药西帕依溃结安大剂量治疗组中c-jun的蛋白质表达水平与生理盐水阴性对照组及5-氨基水杨酸组相比均明显下调, 差异有统计学意义(0.50±0.14 vs 0.84±0.44, 0.79±0.17, 均P<0.05).
结论: 维药西帕依溃结安可能是通过在转录后水平上降低c-jun在结肠中的表达来促进溃疡性结肠炎的愈合.
引文著录: 贺捷, 哈木拉提•吾甫尔, 黄静静, 吴军, 库热西•玉努斯. 维药西帕依溃结安对大鼠溃疡性结肠炎模型组织中c-jun表达的影响. 世界华人消化杂志 2009; 17(33): 3441-3445
Revised: November 9, 2009
Accepted: November 9, 2009
Published online: November 28, 2009
AIM: To investigate the effects of Uygur medicine Xipayi Kui Jie'an (KJA) on c-jun expression in rat ulcerative colitis (UC).
METHODS: Wistar rats were used to induce UC with 2, 4-dinitrochlorobenzene (DNCB) and acetic acid. The UC rats were then divided into five groups: normal saline group, 5-aminosalicylic acid (5-ASA) group, and low-, medium- and high-dosage KJA groups. The expression of c-jun mRNA and protein was detected by semiquantitative reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: No significant differences were noted in the expression level of c-jun mRNA among each group. Compared with the normal saline (NS) group and the 5-aminosalicylic acid group, the expression levels of c-jun protein was significantly down-regulated in the high-dosage KJA group (0.50 ± 0.14 vs 0.84 ± 0.44 and 0.79 ± 0.17, respectively; both P < 0.05).
CONCLUSION: KJA exerts therapeutic action against UC in rats perhaps via downregulation of c-jun at the post-transcriptional level.
- Citation: He J, Wufuer H, Huang JJ, Wu J, Yunusi K. Xipayi Kui Jie'an downregulates c-jun expression in rat ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(33): 3441-3445
- URL: https://www.wjgnet.com/1009-3079/full/v17/i33/3441.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i33.3441
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性肠道炎症, 临床主要表现为腹痛、腹泻、黏液稀便等, 常反复发作, 迁延不愈. 该病还有发生癌变的可能[1-2]. 由于其持续增高的发病率[3], 日益引起人们的关注. c-jun为即刻早期原癌基因. 经研究推测炎症细胞内c-jun的表达可能是炎症细胞活化的早期标志, c-jun的表达产物亦可促进炎症细胞的增殖、分化, 并可促进其进一步活化. 目前c-jun与UC间关系的研究很少见, 本实验旨在成功建立大鼠UC模型的基础上[4]探讨维药西帕依溃结安对模型结肠组织中c-jun mRNA及c-jun蛋白表达变化及其可能的作用机制.
健康的SPF级Wistar大鼠, ♂, 体质量200-250 g, 由新疆医科大学实验动物中心提供. 2, 4-二硝基氯苯(DNCB)(Sigma公司), 山羊的β-actin mAb(Santa Cruz公司), c-jun抗体(兔多克隆抗体)(Santa Cruz公司), 抗山羊及抗鼠的二抗(北京中杉金桥公司), TRIzol法总RNA提取试剂盒、逆转录试剂盒(上海生工生物有限公司), BCA蛋白浓度检测试剂盒(德国MERK公司), 维药西帕依溃结安(新疆维吾尔医研究所提供), 垂直电泳仪(美国Bio-Rad公司产品), 其他试剂为进口或国产分析纯.
1.2.1 分组: 按完全随机法将Wistar大鼠(108只)分为生理盐水阴性对照组(21只, 死3只)、5-氨基水杨酸(5-ASA)阳性对照组(21只, 死6只)、西帕依溃结安治疗大剂量组(22只, 死1只)、中剂量组(21只, 死2只)、小剂量组(23只, 死1只), 分笼喂养.
1.2.2 大鼠UC模型的建立: 采用DNCB加乙酸双重诱导致敏复合法[5], 各实验组大鼠先适应性喂养1 wk后, 颈背部脱毛, 每天用2%的DNCB丙酮液滴背, 每次5滴, 用药14 d, 于第15天用直径3 mm的导管经肛门插入大鼠结肠内5-8 cm注入0.25 mL 0.1%的DNCB乙醇液, 第16天同法灌2 mL 5%的乙酸, 作用15 s后立即注入5 mL生理盐水冲洗, 以消除乙酸的作用(灌肠前24 h禁食, 自由饮水). 各实验组灌酸7 d后进行治疗, 用直径3 mm的导管经肛门插入大鼠结肠内8 cm左右分别注入生理盐水、5-氨基水杨酸、治疗药物维药西帕依溃结安: 生理盐水阴性对照组2.25 mL/(100 g•d), 5-氨基水杨酸阳性对照组100 mg/(kg•d), 维药西帕依溃结安大剂量组225 mg/(kg•d), 中剂量组150 mg/(kg•d), 小剂量组75 mg/(kg•d), 治疗20 d后脱颈椎处死各组大鼠, 取距肛门5-8 cm的病变部位结肠于-80 ℃保存.
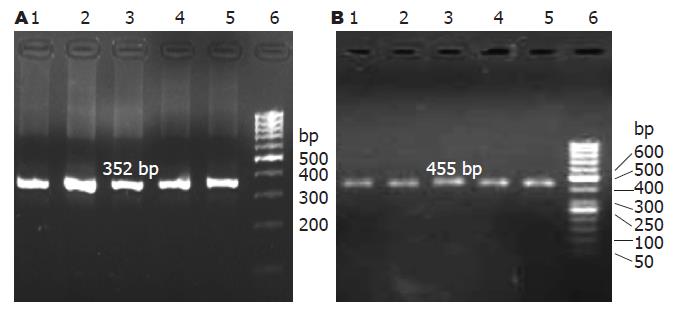
1.2.3 RT-PCR法检测c-jun mRNA的表达: 采用经典TRIzol法提取大鼠结肠组织总RNA, 应用GeneQuant核酸定量分析仪测定总RNA的浓度和纯度, 确保A260/A280比值>1.8, 并经含有溴乙锭的10 g/L琼脂糖凝胶电泳鉴定. 参照逆转录试剂盒说明书进行逆转录, 在20 µL反应体系中加入1 µg总RNA, Oligo (dT)18 (0.5 µg/µL)1 µL, 加无RNA酶去离子水至总体积12 µL, 混匀后离心3-5 s, 70 ℃水浴5 min, 冰浴30 s, 离心3-5 s后再加入: 5×Reaction Buffer 4 µL, RNase-inhibitor (20 U/µL)1 µL, dNTP Mix(10 mmol/L)2 µL. 混匀离心3-5 s, 37 ℃水浴5 min, 加1 µL逆转录酶(20 U/µL), 终体积为20 µL, 42 ℃水浴1 h, 70 ℃加热10 min, 4 ℃终止反应. 用cDNA 模板1 µL对大鼠内参照β-actin及c-jun基因进行PCR扩增. 运用Primer5.0设计软件设计内参照β-actin及c-jun基因的上下游引物. 引物由上海生工生物工程公司合成. 内参照β-actin引物序列为: 上游引物: 5'-GGGACCTGACAGACTACCTC-3', 下游引物: 5'-GACAGCACTGTGTTGGCA TA G-3', 产物长度352 bp. c-jun引物序列为: 上游引物: 5'-CCAGCAATGGGCACATCACC-3', 下游引物: 5'-CGTCTGCGGCTCTTCCTTCA-3', 产物长度455 bp. 反应体系为50 µL, 其中含cDNA 1 µL, 2×PCR Master Buffer 25 µL, 上游引物1 µL(10 µmol/L), 下游引物1 µL(10 µmol/L), 无菌双蒸水补足至50 µL. 扩增参数为: 预变性94 ℃ 5 min, 94 ℃变性30 s, 退火30 s: β-actin退火温度为55 ℃. c-jun退火温度为56.6 ℃, 72 ℃延伸45 s, 共29个循环, 总延伸72 ℃ 10 min. PCR扩增产物于含有溴乙锭的20 g/L琼脂糖凝胶中进行电泳鉴定, 并以Gene RulerTM 100 bp DNA ladder作为Marker.电泳条件: 100 V进样5 min, 80 V电泳40 min, 紫外灯下观察结果, 并在凝胶成像仪上成像. 采用Quantity One图像分析软件分析数据, 获得各电泳条带的积分吸光度(X), 用β-actin的积分吸光度(A)作为内参照, 计算基因的相对表达量(X/A) 作为实验数据.
1.2.4 Western blot法检测C-jun蛋白的表达: 将结肠组织标本称质量, 按1:5的比例加入细胞裂解液, 在冰上进行匀浆, 置于冰上裂解30 min后, 4 ℃下12 000 r/min离心5 min, 取上清分装后置于-80 ℃保存. 用BCA(bicinchoninic acid)比色法检测样品蛋白浓度(按试剂盒说明书操作), 并计算出上样体积. 样品中加入等体积的2×SDS上样缓冲液, 混匀后置于沸水中加热5 min使蛋白变性, 进行SDS-聚丙烯酰胺凝胶电泳(条件: 稳流45 mA, 1.5 h), 用NC膜进行电转膜(条件: 稳压100 V, 2 h), 丽春红S染膜鉴定转膜结果, 根据Marker剪下相应的c-jun和β-actin蛋白条带(c-jun蛋白相对分子质量为39 kDa, β-actin内参照相对分子质量为43 kDa), 洗至背景变白后以50 g/L脱脂奶粉封闭液4 ℃封闭过夜, 用TBST洗膜3次×10 min后分别加入β-actin山羊mAb(1:200), c-jun抗体(兔多克隆抗体)(1:100)4 ℃孵育12 h, 用TBST洗膜3次×10 min, 分别加入结合有辣根过氧化酶标记的抗山羊二抗(1:5000)、抗兔二抗(1:4000)4 ℃孵育12 h, 用TBST洗膜3次×10 min, 于暗室中将杂交膜上滴加已混匀的ECM化学发光剂, X光胶片曝光, 显影, 定影, 使目的蛋白质印迹于X光胶片. 采用Image Tool凝胶图像分析系统对X光胶片扫描分析, 根据蛋白条带的面积和灰度计算出每个条带的积分吸光度. 以每组β-actin(内参照)表达的面积灰度值与c-jun表达的面积灰度值进行比较而进行半定量分析.
统计学处理 数据采用SPSS15.0统计软件处理. 半定量RT-PCR及半定量Western blot结果: 数据方差不齐, 采用Dunnett C检验进行组间两两比较, P<0.05为差异有统计学意义.
RT-PCR检测结果显示: 各实验组间大鼠结肠组织中c-jun mRNA的表达无显著差异(P>0.05, 表1, 图1).
UC是一种主要累及结肠、直肠的疾病. 免疫紊乱是致病的关键, 精神刺激、感染、劳累、饮食失调、过敏常为本病发病的诱因, 其中免疫紊乱近年来受到基本肯定的认识[6-8]. 感染、毒素、药物、精神刺激等始发因素能破坏肠上皮屏障, 使肠组织暴露于大量的肠抗原中, 在遗传易感的宿主诱发黏膜免疫反应, 引起免疫调节异常, 产生炎症过程并逐级扩大, 最后造成组织损伤[9-10].
原癌基因(proto-oncogene)是一类广泛存在于原核细胞和真核细胞基因组内的高度保守基因. 许多疾病的病理变化都涉及原癌基因的表达. c-jun属于myc基因家族, 是核内转录因子类原癌基因家族, 此类原癌基因的特点是具有高度的保守性, 其蛋白质表达在细胞核内, 并可作为转录因子直接影响细胞核中DNA的转录功能, 改变基因的表达. Matossin et al研究证实[11], c-jun在细胞的增殖、活化分化过程中发挥重要作用. 近年来的研究资料提示[12]: 原癌基因几乎参与信号传递通路的每一环节, 该类基因能对神经递质、激素、神经冲动等外界刺激引起的传入信息在数分钟内作出反应, 进行表达, 因而对生命的活动起着极为重要的作用. 程晓刚 et al[13]研究表明: c-jun在炎症中发挥着重要的作用, 多种炎性细胞因子(IL-1、IL-2、IL-3、IL-4、IL-6、TNF等)可直接或间接激活c-jun, 激活的c-jun进一步调节各相关细胞因子的表达调控, 从而参与炎症反应; 国内有学者认为, c-jun在外周组织中炎症细胞的表达增高, 可被视为一种炎症细胞活化的早期标志. 另一方面, c-jun的表达产物c-jun蛋白亦可促进炎症细胞的增殖、分化, 并可促进其进一步活化. c-jun表达产物jun蛋白是细胞核内重要的转录因子, jun蛋白家族成员可以形成同源二聚体或者和Fos蛋白家族成员形成异源二聚体组成转录活化蛋白-1(activator protein-1, AP-1)转录因子AP-1. 后者整合上游传来的信号, 进而调节其下游一系列基因启动子区域含有AP-1结合位点靶基因的转录表达, 是细胞增殖及生物合成的早期标志之一. AP-1调节的很多靶基因产物参与肿瘤细胞侵袭, 该过程需要降解细胞外基质(extra celluar matrix, ECM)成分以促使血管形成及细胞迁徙[14-15]. 肿瘤的侵袭和转移需要突破细胞外基质屏障, 这一过程由蛋白水解酶(丝氨酸蛋白酶、半胱氨酸蛋白酶、天门冬氨酸蛋白酶和基质金属蛋白酶)降解细胞外基质成分完成, 而基质金属蛋白酶(matrix metalloproteinase, MMP)是其中较为重要的一类, 研究显示UC易发生癌变, AP-1介导的MMP-7参与了UC相关性癌的发生[16].
西帕依溃结安处方来自维吾尔医名方"西帕依固龈液", 具有去腐生肌、收敛止痢的功效[17], 为《中华人民共和国卫生部药品标准-维吾尔药分册》1999年版收载品种, 他由没食子一味药组成. 没食子(turkishgalls)中含有大量的可水解鞣质, 其具有固涩、收敛、燥湿、止血[18]、消炎、防腐, 抗腹泻[19]的作用, 用于大肠虚滑、泻痢不止、习惯性肠炎、疗疮出血、蔓延性疮疥、斑秃、黄水疮、牙跟松弛、牙周炎[20]、口臭、咽喉炎、中耳炎、类囊炎等的治疗. 西帕依溃结安是一种液体灌肠制剂, 灌肠给药可使药物直达病变部位, 提高病变部位的血药浓度, 保护肠道溃疡面, 改善局部的血流, 能较快的解除炎症症状, 促进溃疡愈合, 并可避免或减少消化液和消化酶对药物作用的影响和破坏, 有利于药物作用的发挥. 西帕依溃结安己被应用于临床治疗, 发现此药不良反应少, 患者容易接受, 取得了较好的临床疗效.
据前期实验已知模型组中c-jun蛋白表达高于正常组[21]. 本实验的结果也显示, 各治疗组c-jun mRNA表达无明显差异, 但c-jun蛋白表达则有差异: 5-氨基水杨酸治疗组中c-jun蛋白表达低于生理盐水阴性对照组(P<0.05), 维药西帕依溃结安治疗大剂量组c-jun蛋白表达低于5-氨基水杨酸治疗组、生理盐水阴性对照组(P<0.01和0.05), 5-氨基水杨酸是西医临床用来治疗炎症性肠病的常用药, 但维药西帕依溃结安与5-氨基水杨酸相比, 治疗效果更好. 我们推测: (1)c-jun可能是维药西帕依溃结安治疗UC的作用靶点. 据研究已经证实: 大鼠UC组织中NF-κB、iNOS、IL-6基因mRNA表达较正常结肠组织明显增高, 经维药西帕依溃结安治疗后, NF-κB、iNOS、IL-6基因mRNA表达较模型组结肠组织明显降低[22-23]. 模型组中c-jun蛋白的高表达一方面可能是在各种炎性因子的作用下使c-jun基因的转录活性增强所致; 另一方面, 高表达的c-jun蛋白又促进了各种炎性因子的活化及释放, 形成正反作用, 即NF-κB活化引起c-jun的过度或持续表达, 形成一个正反馈调节, 导致持续或放大的炎症反应, 引起结肠黏膜损伤. 用维药西帕依溃结安治疗的过程中, 则是通过降低结肠中c-jun的表达来促进UC的愈合. c-jun表达受抑制使AP-1生成减少, 进而MMP减少, 不能分解ECM, 有利于损伤组织的修复, c-jun表达量减少同时有可能降低其他促炎因子, 结果抗炎因子的作用占优势或有利于促炎因子与抗炎因子间平衡的恢复, 从而促进UC的愈合. (2)维药西帕依溃结安调节c-jun的表达在转录后水平上进行.
本实验发现维药西帕依溃结安调节c-jun基因的表达, 这不仅对UC治疗有利, 还有可能预防UC的癌变, 从而拓展维药西帕依溃结安的药用范围.
溃疡性结肠炎(UC)被世界卫生组织列为疑难病, 近年来发病率有明显增加趋势. 该病的病因和发病机制尚未完全阐明, 成为消化病学研究的新热点. c-jun蛋白表达可能是炎症细胞活化的早期标志. 作为原癌基因的c-jun及其蛋白产物在生命活动中起着极为重要的作用. 所以研究c-jun在UC中的作用机制是十分必要的.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室
本实验应用维药西帕依溃结安调节c-jun基因的表达, 对于从分子水平上探讨维药的作用机制有重要意义. 这不仅有利于治疗UC, 还提高了维医药理论的现代化研究.
本文结果提示, 维药西帕依溃结安可能是通过在转录后水平上降低c-jun在结肠中的表达来促进溃疡性结肠炎的愈合. 从而拓展维药西帕依溃结安的药用范围.
原癌基因(proto-oncogene): 是一类广泛存在于原核细胞和真核细胞基因组内的高度保守基因. 许多疾病的病理变化都涉及他的表达. 原癌基因和肿瘤抑制基因控制着正常细胞的生长和分化, 这些基因的改变被认为是一些人体恶性肿瘤发生的重要原因.
本研究探讨了维药西帕依溃结安对大鼠溃疡性结肠炎模型组织中c-jun表达的影响, 有一定的科学意义和可读性.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] [DOI] |
| 2. | Bernstein CN, Blanchard JF, Kliewer E, Wajda A. Cancer risk in patients with inflammatory bowel disease: a population-based study. Cancer. 2001;91:854-862. [DOI] |
| 3. | 江 学良, 崔 慧斐. 溃疡性结肠炎. 第1版. 北京: 中国医药科技出版社 2004; 1-12. |
| 6. | Kirsner JB. Historical origins of current IBD concepts. World J Gastroenterol. 2001;7:175-184. [PubMed] |
| 7. | Wu HG, Zhou LB, Shi DR, Liu SM, Liu HR, Zhang BM, Chen HP, Zhang LS. Morphological study on colonic pathology in ulcerative colitis treated by moxibustion. World J Gastroenterol. 2000;6:861-865. [PubMed] |
| 8. | MacDonald TT, Monteleone G, Pender SL. Recent developments in the immunology of inflammatory bowel disease. Scand J Immunol. 2000;51:2-9. [PubMed] [DOI] |
| 11. | Shaw RJ, Doherty DE, Ritter AG, Benedict SH, Clark RA. Adherence-dependent increase in human monocyte PDGF(B) mRNA is associated with increases in c-fos, c-jun, and EGR2 mRNA. J Cell Biol. 1990;111:2139-2148. [PubMed] [DOI] |
| 15. | 张 庆原, 张 剑宁. VEGF、uPA在侵袭性垂体腺瘤中的表达及意义. 中华神经外科疾病研究杂志. 2007;6:146-149. |
| 16. | Newell KJ, Matrisian LM, Driman DK. Matrilysin (matrix metalloproteinase-7) expression in ulcerative colitis-related tumorigenesis. Mol Carcinog. 2002;34:59-63. [PubMed] [DOI] |
| 17. | Glick ME, Falchuk ZM. Dinitrochlorobenzene-induced colitis in the guinea-pig: studies of colonic lamina propria lymphocytes. Gut. 1981;22:120-125. [PubMed] [DOI] |
| 20. | 江苏新医学院编. 中药大词典. 第1版. 上海: 上海科学技术出版社 2000; 1169. |