修回日期: 2009-11-09
接受日期: 2009-11-09
在线出版日期: 2009-11-28
目的: 探讨靶向mdr1 4个不同位点的siRNAs对胃癌耐药细胞SGC7901/VCR和人红白血病耐药细胞K562/A02的作用效果.
方法: 设计并体外转录合成4条靶向mdr1的siRNAs(mdr1si326、mdr1si1513、mdr1si2631及mdr1si3071), 分别转染SGC7901/VCR细胞和K562/A02细胞, 用RT-PCR和免疫组织化学检测mdr1 mRNA与P-gp的表达, 流式细胞仪检测细胞内阿霉素(ADR)的蓄积, MTT法检测细胞对阿霉素的敏感性.
结果: 4条siRNAs对人胃癌细胞SGC7901/VCR mdr1介导的MDR逆转效果由高到低依次为mdr1si326、mdr1si2631、mdr1si3071及mdr1si1513; 对人红白血病细胞K562/A02 mdr1介导的MDR逆转效果由高到低依次为mdr1si326、mdr1si2631、mdr1si3071及mdr1si1513.
结论: 4条siRNAs对SGC7901/VCR和K562/A02两种耐药细胞作用效果趋势相似.
引文著录: 张敏, 李勇莉, 高建凯, 王国栋, 高福莲. 靶向mdr1不同位点的siRNA对两种耐药细胞MDR的逆转效果. 世界华人消化杂志 2009; 17(33): 3387-3393
Revised: November 9, 2009
Accepted: November 9, 2009
Published online: November 28, 2009
AIM: To investigate the effects of four siRNAs targeting different regions of the multidrug resistance 1 (mdr1 gene) on multidrug resistance (MDR) of SGC7901/VCR and K562/A02 cells.
METHODS: Four siRNAs (mdr1si326, mdr1si1513, mdr1si2631 and mdr1si3071) targeting the mdr1 gene were designed and transfected into SGC7901/VCR and K562/A02 cells, respectively. The expression level of mdr1 mRNA was analyzed by reverse transcription-polymerase chain reaction (RT-PCR). The expression level of P-glycoprotein (P-gp) was detected by immunohistochemistry. The accumulation of intracellular adriamycin (ADR) was examined by flow cytometry. The cell sensitivity to ADR was detected by methyl thiazolyl tetrazolium (MTT) assay.
RESULTS: The best reversal effects on MDR of SGC7901/VCR cells were achieved with mdr1si326, followed by mdr1si2631, mdr1si3071 and mdr1si1513. Similarly, the best reversal effects on MDR of K562/A02 cells were also achieved with mdr1si326, followed by mdr1si2631, mdr1si3071 and mdr1si1513.
CONCLUSION: The four siRNAs exerts similar reversal effects on multidrug resistance of both SGC7901/VCR and K562/A02 cells.
- Citation: Zhang M, Li YL, Gao JK, Wang GD, Gao FL. Reversal effects of siRNAs targeting different regions of the mdr1 gene on multidrug resistance in two drug-resistant tumor cell lines. Shijie Huaren Xiaohua Zazhi 2009; 17(33): 3387-3393
- URL: https://www.wjgnet.com/1009-3079/full/v17/i33/3387.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i33.3387
RNA干扰(RNA interference, RNAi)是21-23个核苷酸(nucleotide, nt)的小分子干扰RNA(small interfering RNA, siRNA)诱导细胞同源基因mRNA降解而特异性抑制基因表达的过程. 这一特异、有效的技术已应用于肿瘤多药耐药(multidrug resistance, MDR)等方面的研究. siRNA是RNAi过程中重要的中间分子, siRNA的特异性是诱发RNAi的一个重要问题. 大量研究表明, 靶向同一基因不同靶位点的siRNA的作用效果不同, 因此有效靶位点的筛选对于RNAi的成功与否十分重要. 高福莲et al[1]用的4条siRNA之一mdr1si326的靶序列相同于Peng et al[2]用的三条序列之一si-mdr1-1, 高福莲 et al研究显示此条siRNA转染SGC7901/VCR细胞后, mRNA表达水平、细胞内ADR蓄积和ADR耐药性逆转三方面的数据变动和转染前比较有统计学意义; Peng et al用此条siRNA转染K56/A02细胞后, 发现mRNA表达、P-gp表达和细胞内柔红霉素蓄积、对ADR的敏感性的转染前后数据变化无统计学意义. 上述研究显示示靶向同一位点siRNA的作用效果和细胞种类有关系, 靶向不同靶位点的siRNA对不同种类细胞的作用效果趋势如何, 尚未见相关报道. 本研究选定并合成靶向mdr1 mRNA不同靶位点的4条siRNAs, 分别转染胃癌耐药细胞SGC7901/VCR和人红白血病耐药细胞K562/A02, 用RT-PCR检测mdr1 mRNA的表达、免疫组织化学检测mdr1蛋白水平的表达、流式细胞仪检测细胞内化疗药物的蓄积、MTT法检测细胞对化疗药物的敏感性, 判断靶向不同位点的siRNAs对不同细胞作用效果的趋势有无差别, 探讨高效靶点的通用性, 为靶点的选择提供理论资料, 也为siRNA药物研发提供依据, 具有潜在的临床应用前景.
SGC7901细胞由郑州大学基础医学院组胚教研室惠赠, SGC7901/VCR细胞由中国人民解放军第四军医大学西京医院消化病研究所樊代明教授惠赠, K562/A02细胞购自协和血液学研究中心, K562细胞由山东大学血研室惠赠. TRIzol试剂购自Nvitrogen公司, AMV第一链cDNA合成试剂盒和PCR扩增试剂盒均购自上海Sangon公司, DAB显色试剂盒和SABC免疫组织化学染色试剂盒(SA2002)购自武汉Boster公司, 兔抗人P-gp多克隆抗体(Mdr(H-241): sc-8313)购自Santa Cruz公司, CodeBreaker siRNA转染试剂和T7 RiboMAXTM Express RNAi System购自美国Promega公司.
1.2.1 siRNA的siRNA的设计和合成: 参照高福莲[3]的研究选取的靶序列, 用T7 RiboMAXTM Express RNAi System在体外转录分别合成4条siRNAs: mdr1si326, mdr1si1513, mdr1si2631和mdr1si3071.
1.2.2 siRNAs沉默SGC7901/VCR细胞和K562/A02细胞mdr1效果的检测: (1)细胞培养: K562/A02和SGC7901/VCR用含10%灭活小牛血清、100 kU/L链霉素、100 kU/L青霉素的RPMI 1640培养基, 置37 ℃、50 mL/LCO2饱和湿度的恒温孵育箱中培养, 培养基中分别含1 mg/L ADR和1 mg/L VCR以维持其耐药性, 实验前2 wk停药. 用CodeBreaker siRNA转染试剂, 分别将siRNAs以20 nmoL的终浓度转染SGC7901/VCR细胞和K562/A02细胞. 实验分7组. 空白对照组: 只加PBS; 转染试剂组: 转染试剂+PBS; mdr1si326组: 转染试剂+mdr1si326; mdr1si1513组: 转染试剂+mdr1si1513; mdr1si2631组: 转染试剂+mdr1si2631; mdr1si3071组: 转染试剂+mdr1si3071; SGC7901或K562组(亲本组): SGC7901细胞或K562细胞+PBS. (2)RT-PCR: 用TRIzol试剂按说明书提取转染48h后的细胞总RNA, 测定RNA的纯度和浓度, 判定RNA的完整性. 取总RNA 4.5 μg, 用AMV第一链cDNA合成试剂盒合成cDNA. mdr1引物上游序列为5'-tgactaccaggctcgccaatgat-3', 下游为5'-tgtgccaccaagtaggctccaaa-3', 扩增片段跨越3个内含子, 产物457 bp; β-actin引物上游序列为5'-tcctgtggcatccacgaaact-3', 下游为5'-gaagcatttgcggtggacgat-3', 产物314 bp[3]. 取5 μL cDNA, 用PCR扩增剂盒进行PCR, 目的和内参片段同管扩增. 以pUC19 DNA/Msp Ⅰ作参照, PCR产物进行琼脂糖凝胶电泳分析, 以mdr1和β-actin的比值进行mdr1基因mRNA表达水平的半定量分析. (3)免疫组织化学: 收取转染96 h后的SGC7901/VCR和K562/A02细胞, 细胞涂片, 采用SABC法检测P-gp的表达, 以PBS代替兔抗人P-gp多克隆抗体作阴性对照, 用已知P-gp阳性表达的结肠癌组织作阳性对照, 步骤严格按说明书进行. P-gp免疫组织化学阳性位于细胞膜, 呈棕黄色. 用彩色病理图文分析系统, 对结果进行定量分析. (4)FCM检测细胞内ADR蓄积: 转染72 h后的SGC7901/VCR细胞和K562/A02细胞换用含10 mg/L ADR的RPMI 1640培养液, 作用90 min, 收取细胞行流式细胞仪检测, 激发波长为488 nm, 接受波长为575 nm; 同时设PBS取代ADR的同种细胞为空白对照. 每次检测细胞(1-2)×105个. 用ADR特异荧光阳性强度和特异荧光阳性率代表细胞内ADR蓄积量. (5)MTT法检测细胞对化疗药的敏感性: SGC7901/VCR细胞于转染48 h后收获, 并调节细胞密度至5×108/L, 加200 μL/孔入96孔培养板培养24 h后, 加入终浓度分别为1.65、3.3、33、330、660 mg/L的ADR[3], 继续培养48 h, 按常规方法依次加入MTT和二甲基亚砜, 用酶标仪测定各孔的吸光度A570. K562/A02细胞于转染72 h后收获, 调节细胞密度至5×108/L, 加90 μL/孔入于96孔培养板, 同时加入浓度为0.01、0.1、1、10和100 mg/L的ADR[2], 培养48 h, 按改良MTT方法[4]依次加入MTT、三联液(10% SDS, 5%异丁醇, 0.012 mol/L HCL)100 μL/孔, 于37 ℃放置过夜, 用酶标仪测定各孔的吸光度A570. 每种药物浓度接种3个复孔, 设立只加PBS的细胞对照和无细胞的试剂对照. 用对照组和药物组A570分别减去试剂组A570, 得出校正对照组和药物组A570, 计算存活率(校正药物组A570/校正对照组A570). 用Origin 7.0软件, 绘制剂量生存曲线, 求出肿瘤细胞对ADR的半数抑制浓度(IC50), 计算相对逆转率. 相对逆转率 = (IC50A-IC50B)/(IC50A-IC50C)×100%, 其中IC50A为空白对照组耐药细胞, IC50B为转染siRNA组耐药细胞, IC50C为亲本细胞.
统计学处理 应用SPSS12.0统计软件进行统计学处理, 计量数据用mean±SD表示, 两样本均数的比较用t检验, 多样本均数的比较采用方差分析, 方差不齐时进行变量转换. 计数资料计算阳性率, 阳性率的比较用χ2检验, 检验水准α = 0.05.
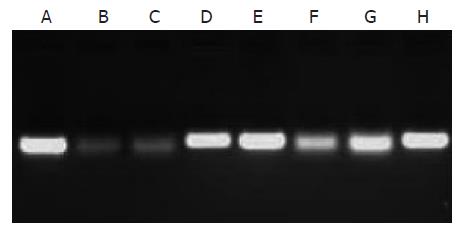
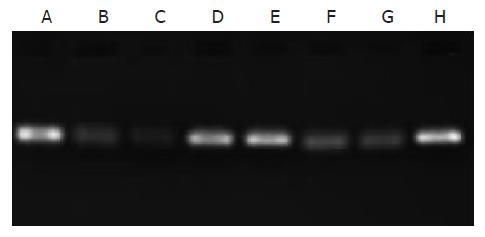
以合成siRNAs的DNA模板为参照, 用2.5%琼脂糖凝胶进行合成siRNAs电泳的结果显示, 尽管合成的siRNAs相对分子质量较DNA模板小使泳动速度快, 但同分子量RNA在琼脂糖凝胶的电泳速度慢于DNA, 而使合成的siRNAs和DNA模板的距离拉开不大; 合成siRNAs的大小与设计相符, 浓度有别(图1-2).
siRNAs转染48 h后, SGC7901/VCR细胞mdr1 mRNA表达水平在mdr1si2631组的下降最明显, mdr1si326组次之(P<0.05), mdr1si1513组和mdr1si3071组下降最少(P<0.05); mdr1si1513组和mdr1si3071组之间的差别无统计学意义(P>0.05). siRNAs转染48 h后, K562/A02细胞mdr1 mRNA表达水平在mdr1si326组下降最明显, mdr1si1513组其次, mdr1si3071组下降最少; 4组之间的差别有统计学意义(P<0.05, 表1).
| 分组 | 灰度比值(mean±SD) | 积分吸光度(mean±SD) | 阳性率(%) | |||
| SGC7901/VCR | K562/A02 | SGC7901/VCR | K562/A02 | SGC7901/VCR | K562/A02 | |
| 空白对照 | 1.27±0.06a | 1.54±0.03a | 150.19±22.89a | 34.82±11.31a | 0.13a | 23.47a |
| 转染试剂 | 1.23±0.04 | 1.55±0.01 | 138.87±68.76 | 38.27±9.21 | 0.16 | 27.15 |
| mdr1si326 | 1.06±0.02 | 1.07±0.02 | 45.76±9.31 | 8.06±4.76 | 0.25 | 35.17 |
| mdr1si1513 | 1.18±0.08 | 1.28±0.02 | 99.26±24.23 | 17.41±2.86 | 0.16 | 29.20 |
| mdr1si2631 | 0.86±0.03 | 1.37±0.03 | 70.50±6.11 | 17.01±3.17 | 1.40 | 34.26 |
| mdr1si3071 | 1.17±0.06 | 1.50±0.03 | 65.81±5.73 | 23.40±4.86 | 0.32 | 28.95 |
| 亲本 | 7.65a | 36.90a | ||||
siRNAs转染96 h后, SGC7901/VCR细胞的P-gp表达水平在mdr1si326组下降最明显, mdr1si2631组和mdr1si3071组次之(P<0.05), mdr1si1513组下降最少(P<0.05); mdr1si2631组和mdr1si3071组之间的差别无统计学意义(P>0.05). siRNAs转染96 h后, K562/A02细胞的P-gp表达水平在mdr1si326组的下降最明显, mdr1si1513和mdr1si2631组次之(P<0.05), mdr1si3071组下降最少(P<0.05); mdr1si1513和mdr1si2631组之间的差别无统计学意义(P>0.05, 表1).
siRNAs转染72 h后, SGC7901/VCR细胞内ADR特异荧光阳性率在mdr1si2631组最高, mdr1si326组和mdr1si3071组次之(P<0.05); mdr1si326组和mdr1si3071组两组之间的差别无统计学意义(P>0.05). siRNAs转染72 h后, K562/A02细胞内ADR特异荧光阳性率在mdr1si326组最高, mdr1si2631组次之(P<0.05), mdr1si1513和mdr1si3071组最小(P<0.05); mdr1si1513和mdr1si3071组之间的差别无统计学意义(P>0.05, 表1).
siRNAs转染72 h后, SGC7901/VCR细胞对ADR的IC50在mdr1si1513组的变动最大, mdr1si326组和mdr1si3071组次之, mdr1si2631组变动最小; mdr1si326组和mdr1si3071组之间的差异无统计学意义(P>0.05), 其他组之间的差异有统计学意义(P<0.05). siRNAs转染72 h后, K562/A02细胞对ADR的IC50在mdr1si1513组变动最小, mdr1si326组、mdr1si2631组和mdr1si3071组减少显著(P<0.05); mdr1si326组、mdr1si2631组和mdr1si3071组之间的差别无统计学意义(P>0.05), 与亲本之间的差别无统计学意义(P>0.05, 表2). 综合mdr1 mRNA和P-gp表达, P-gp功能以及对ADR耐药逆转程度4方面结果: 对人胃癌细胞SGC7901/VCR mdr1介导的MDR逆转效果由高到低依次为mdr1si326、mdr1si2631、mdr1si3071和mdr1si1513; 对人红白血病细胞K562/A02 mdr1介导的MDR逆转效果由高到低依次为mdr1si326、mdr1si2631、mdr1si3071和mdr1si1513.
2001年Elbashir et al[5]首次报道siRNA在多种哺乳动物体细胞系内成功抑制特异基因表达后, RNAi能否用于人类疾病治疗引起研究者兴趣. 近年来, 国内外大量研究表明siRNA的作用效果与靶位点密切相关, 靶向不同靶位点的siRNA作用效果不同. 许可慰 et al[6]用3条siRNAs靶向沉默人膀胱癌细胞株T24的bcl-2基因, 研究发现, 其中pGenesil-12042的抑制效果最好. 潘修成 et al[7]针对HBV C基因序列设计5个siRNA靶位, 其中, 以SEC-492i的RNAi效率最高而SEC-282i相对较差. 赵刚 et al[8]合成靶向幽门螺杆菌(H pylori)vacA基因的5对siRNAs, 结果vacA-s2和vacA-s4的抑制作用最大. 王春光 et al[9]用载体介导的3条siRNAs转染Lewis肺癌细胞, 结果Psilencer2•1-U6-siRNA-stat3-2对Lewis肺癌细胞中STAT3基因表达的抑制作用最强. 在siRNA逆转mdr1介导的MDR的研究中, Pichler et al[10]证明针对8个靶位点所设计的siRNAs中, 只有第1条和第7条对降低mdr1 mRNA和P-gp表达水平以及逆转MDR表型有效. 在高福莲 et al[1]的实验中, 针对胃癌SGC7901/VCR细胞mdr1 4段靶位点所设计的4条siRNAs中, mdr1si326的逆转效果最好, 并且研究提示: 在siRNA靶序列设计和选择中, 除了遵守Tuschl et al的设计原则外, 还应考虑靶序列的位置、靶序列结构、siRNA的正义链5'和3'末端碱基的种类, 尤其是靶序列结构, 尽可能选择自身无成茎和成袢现象、靶序列和靶序列外碱基配对和氢键的数量最少的部位. 赵澎 et al[11]针对神经胶质瘤耐药细胞系BT325的mdr1基因所设计的3条短发夹状RNA(short hairpin RNA, shRNA)中MDR1A和MDR1B对MDR的逆转作用较强; Chen et al[12]在肝癌细胞HepG2/ADM中转染的2条shRNA中, pGenSil-1/MDRB抑制了P-gp的表达, 而pGenSil-1/MDRA却不起作用; 在Ganet al[13]的实验中2条shRNAs均能降低乳腺癌耐药细胞MCF7/AdrR mdr1 mRNA和P-gp表达水平并逆转MDR表型, 2条shRNA对MDR表型效果明显不同, 但对降低mdr1 mRNA和P-gp表达水平的效果却无显著差异. Klosek et al[14]研究显示: 靶向Stat3不同位点的10条siRNAs, 对Stat3表达抑制效果不同, 10 nmol/L的siRNAs对Stat3表达抑制范围为21%-67%, 1 nmol/L的siRNAs对Stat3表达抑制范围为13%-73%. 对于靶向同一基因不同靶位点的siRNA作用效果不同的现象, Luo et al[15]试图通过试验证明这种"位点效应"是否主要与靶位点mRNA的二级结构有关. 对此他们提出了"氢键指数(H-bond index)"-在靶位点和mRNA其他位点之间形成的平均氢键数, 并应用计算机方法, 检测Bcl-2, hTF, 和cyclin B1这3种基因的氢键指数, 发现氢键指数与siRNA的效果呈反比, 证明了"位点效应"主要与靶位点mRNA的二级结构有关, 并建议在将来siRNA的设计中参考氢键指数. 本实验选定[3]并合成了4条siRNAs, 转染后SGC7901/VCR和K562/A02细胞的mdr1 mRNA和P-gp的表达水平降低, 细胞内ADR蓄积增加, 细胞对ADR的敏感性增加, 提示4条siRNAs均能逆转SGC7901/VCR和K562/A02细胞的MDR. 本研究显示, 在SGC7901/VCR和K562/A02R细胞中, 4条siRNAs的作用效果均不同, 并且都是mdr1si326的逆转效果最强, mdr1si1513的作用最差. 这进一步验证了siRNA的作用效果的"位点效应".
靶向同一靶序列的siRNA在不同细胞中作用效果不同, siRNA的作用效果与细胞种类密切相关. 张汝钢 et al[16]研究人端粒酶逆转录酶(hTERT)RNAi对2种肝癌细胞HepG2、SMMC-7221的影响, 将载体介导的siRNA转染2种细胞, 在2种细胞中的抑制效果不同: 2种细胞的老化率分别由0、3.6%增加到20.4%、10.0%, 凋亡率分别由3.5%、4.8%增加到5.2%、7.9%. 孙延霞[17]用RNAi沉默胃癌细胞SGC7901的Survivin基因, 所用的Survivin2(166-185)和汤建光 et al[18]所用的pBSHH1-S(166-184)靶位点仅有1个碱基之差, 抑制效果却不相同: Survivin2和pBSHH1-S对Survivin mRNA表达的抑制率分别为69.24%和74%, 对Survivin蛋白表达的抑制率分别为58.17%和82%. 在siRNA逆转MDR的大量实验中, 高福莲[3]用的4条siRNAs之一mdr1si326相同于Peng et al[2]用的3条序列之一si-mdr1-1, 高福莲研究显示此条siRNA转染后, SGC7901/VCR细胞mRNA表达水平、细胞内ADR积累和ADR耐药逆转3方面的数据变动和转染前比较有统计学意义, Peng et al研究显示此条siRNA转染后, K562/A02细胞mRNA表达水平、细胞内DAM积累和ADR耐药性逆转3方面的数据变动和转染前比较无统计学意义; Nieth et al[19]实验显示相同的mdr1 siRNA同时转染胰腺癌细胞(EPP85-181RDB)和胃癌细胞(EPG85-257RDB)时, 2种细胞对柔红霉素的耐药性分别降低89%和58%; Chen et al[12]实验中所选用的pGenSil-1/MDR-A与Yagüe et al[20]逆转白血病耐药细胞KD30 MDR实验中所2条shRNAs中的1条相同, 在Yagüe et al的实验中此条shRNA的RNAi作用显著, 在Chen et al[12]的实验中对肝癌细胞HepG2/ADM却不起作用. 本实验以靶向mdr1不同靶位点的4条siRNAs, 分别转染胃癌耐药细胞SGC7901/VCR和人红白血病耐药细胞K562/A02. 本研究显示, 转染mdr1si2631 72 h后, SGC7901/VCR细胞内ADR荧光阳性率由0.13%增加至1.40%, 耐药相对逆转率达37.31%; K562/A02细胞内ADR荧光阳性率由23.47%增加至34.26%, 耐药相对逆转率达96.39%. 本研究进一步验证了siRNA的作用效果与细胞种类有关.
孙延霞[17]用载体介导的siRNA-Survivin1和siRNA-Survivin2沉默Survivin基因在人胃癌细胞SGC7901和人白血病细胞K562的表达, 结果siRNA-Survivin1具有抑制人胃癌细胞SGC7901增殖活性的作用, siRNA-Survivin2对细胞的抑制作用较弱; 在siRNA-Survivin-1作用下, Survivin蛋白表达明显减少(Survivin/β-actin灰度比为0.21), 抑制率为78.25%, 在siRNA-Survivin-2作用下, Survivin蛋白表达也有所减少(Survivin/β-actin灰度比为0.58), 抑制率为42%. 总体来讲, 在人胃癌细胞SGC7901和人白血病细胞K562中均是siRNA-Survivin1的抑制作用较强. Xu et al[21]以scAAV vector(Self-Complementary Recombinant Adeno-Associated Virus Vector)介导的2条siRNAs AAV-siMDR28mer和AAV-siMDR25mer转染人乳腺癌细胞NCI/ADR-RES和口腔癌细胞KB-C1, 均能降低2种细胞P-gp表达, 并逆转耐药表型, 同研究表明scAAV vector介导的siRNA的抑制作用具有剂量和时间依赖性, 但是未研究2条siRNAs的抑制作用是否有差别. Lu et al[22]为了研究前列腺肿瘤诱导基因1(prostage tumor-inducing gene 1, PTI-1)在人类前列腺癌中的作用, 构建了载体介导的3条siRNAs pSlencer3.1-neo-Yu Lei[YL]1-2, -YL3-4 and -YL5-6, 分别转染人前列腺癌细胞DU145和PC3, 研究表明, 仅siRNA pSlencer3.1-neo-YL1-2可以几乎完全抑制PTI-1在两种细胞中的表达, 并可以阻止2种前列腺癌细胞的生长, 而且在2种细胞的作用效果相似.
靶向同一基因不同靶位点的siRNA在不同细胞中作用效果的趋势如何尚未见报道. 本实验针对高福莲 et al[1]和Peng et al[2]的研究, 为探讨靶向mdr1不同靶位点的siRNAs对不同细胞作用效果的趋势如何, 设计靶向mdr1 mRNA不同靶位点的4条siRNAs, 分别转染胃癌耐药细胞SGC7901/VCR和人红白血病耐药细胞K562/A02, 用RT-PCR检测mdr1 mRNA的表达、免疫组织化学检测mdr1蛋白水平的表达、流式细胞仪检测细胞内化疗药物的蓄积量、MTT法检测细胞对ADR的敏感性. 综合mdr1 mRNA、P-gp表达以及P-gp功能和对ADR耐药逆转程度4方面结果显示, 对SGC7901/VCR细胞mdr1介导MDR逆转效果由高到低的siRNAs依次为mdr1si326、mdr1si2631、mdr1si3071和mdr1si1513, 这与高福莲[3]的实验结果相一致; 对K562/A02细胞mdr1介导MDR逆转效果由高到低的siRNAs依次为mdr1si326、mdr1si2631、mdr1si3071和mdr1si1513. 针对同一基因不同靶位点的4条siRNAs在2种肿瘤耐药细胞SGC7901/VCR和K562/A02中作用效果的趋势相似.
RNA干扰(RNAi)是21-23个核苷酸(nt)的小分子干扰RNA(siRNA)诱导细胞同源基因mRNA降解, 而特异性抑制基因表达的过程. siRNA是RNAi过程中重要的中间分子, 其的特异性是诱发RNAi的一个重要因素.
吴健雄, 教授, 中国医学科学院中国协和医科大肿瘤研究所肿瘤医院腹部外科
RNAi这一特异、有效的技术已应用于肿瘤多药耐药(MDR)等方面的研究. 大量研究表明, 靶向同一基因不同靶位点的siRNA的作用效果不同, 因此有效靶位点的筛选对于RNAi的成功与否十分重要, 成为一项研究热点.
本研究利用RNAi技术, 探讨靶向不同位点的siRNAs对胃癌耐药细胞SGC7901/VCR和人红白血病耐药细胞K562/A02作用效果的趋势.
本研究显示, 靶向不同位点的siRNAs对两种耐药细胞作用效果趋势相似, 为靶点的选择提供理论资料, 也为siRNA药物研发提供依据.
小分子干扰RNA(siRNA): 是一种小RNA分子(21-23核苷酸), 由Dicer(RNAase Ⅲ家族中对双链RNA具有特异性的酶)加工而成. siRNA是siRISC的主要成员, 激发与之互补的目标mRNA的沉默.
本研究紧随目前肿瘤药物治疗的前沿理念, 讨论了靶向治疗中的关键问题, 对于深入研究靶向治疗有很好的借鉴意义.
编辑: 李军亮 电编: 吴鹏朕
| 2. | Peng Z, Xiao ZJ, Wang Y, Liu P, Cai YL, Feng WL, Han ZC. [Reversal of multi-drug resistance in K562/A02 cells by small interference RNA of mdr1 gene]. Zhonghua Xueyexue Zazhi. 2004;25:5-7. [PubMed] |
| 3. | 高 福莲. siRNA逆转人胃癌细胞mdr1介导的多药耐药. 郑州: 郑州大学 2006; 5-6. |
| 5. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 6. | 许 可慰, 黄 健, 林 天歆, 郭 正辉, 胡 明, 尹 心宝, 潘 秋辉. RNAi技术沉默Bcl-2基因对人膀胱癌细胞株T24增殖影响的研究. 中华泌尿外科杂志. 2007;28:26-29. |
| 7. | 潘 修成, 陈 智, 倪 勤, 羊 正纲, 徐 宁, 金 晗英. tRNA-(val)-shRNA表达框在筛选HBV C基因小干扰RNA靶位中的应用. 浙江大学学报(医学版). 2006;35:154-160. |
| 8. | 赵 刚, 詹 文华, 严 燕国, 马 晋平, 彭 俊生, 董 文广, 蔡 世荣, 何 裕隆. 靶向siRNA抑制幽门螺杆菌vacA表达. 世界华人消化杂志. 2006;14:470-475. [DOI] |
| 10. | Pichler A, Zelcer N, Prior JL, Kuil AJ, Piwnica-Worms D. In vivo RNA interference-mediated ablation of MDR1 P-glycoprotein. Clin Cancer Res. 2005;11:4487-4494. [PubMed] [DOI] |
| 12. | Chen XP, Wang Q, Guan J, Huang ZY, Zhang WG, Zhang BX. Reversing multidrug resistance by RNA interference through the suppression of MDR1 gene in human hepatoma cells. World J Gastroenterol. 2006;12:3332-3337. [PubMed] |
| 13. | Gan HZ, Zhang GZ, Zhao JS, Zhang FC, Bu LS, Yang SJ, Piao SL, Du ZW, Gao S, Zheng DM. Reversal of MDR1 gene-dependent multidrug resistance using short hairpin RNA expression vectors. Chin Med J (Engl). 2005;118:893-902. [PubMed] |
| 14. | Klosek SK, Nakashiro K, Hara S, Goda H, Hamakawa H. Stat3 as a molecular target in RNA interference-based treatment of oral squamous cell carcinoma. Oncol Rep. 2008;20:873-878. [PubMed] |
| 15. | Luo KQ, Chang DC. The gene-silencing efficiency of siRNA is strongly dependent on the local structure of mRNA at the targeted region. Biochem Biophys Res Commun. 2004;318:303-310. [PubMed] [DOI] |
| 17. | 孙 延霞. RNAi沉默survivin基因对胃癌及白血病细胞生长的抑制作用. 长春: 吉林大学 2006; 31. |
| 19. | Nieth C, Priebsch A, Stege A, Lage H. Modulation of the classical multidrug resistance (MDR) phenotype by RNA interference (RNAi). FEBS Lett. 2003;545:144-150. [PubMed] [DOI] |
| 20. | Yagüe E, Higgins CF, Raguz S. Complete reversal of multidrug resistance by stable expression of small interfering RNAs targeting MDR1. Gene Ther. 2004;11:1170-1174. [PubMed] [DOI] |
| 21. | Xu D, McCarty D, Fernandes A, Fisher M, Samulski RJ, Juliano RL. Delivery of MDR1 small interfering RNA by self-complementary recombinant adeno-associated virus vector. Mol Ther. 2005;11:523-530. [PubMed] [DOI] |
| 22. | Lu PY, Xie FY, Woodle MC. siRNA-mediated antitumorigenesis for drug target validation and therapeutics. Curr Opin Mol Ther. 2003;5:225-234. [PubMed] |