修回日期: 2009-09-29
接受日期: 2009-10-12
在线出版日期: 2009-11-18
目的: 评估GOLFIG-1在化疗耐药晚期结直肠癌患者中的疗效和不良反应.
方法: 选择化疗耐药的晚期结直肠癌患者, 先予吉西他滨、奥沙利铂、亚叶酸和氟尿嘧啶化疗, 随后予粒细胞巨噬细胞集落刺激因子和IL-2治疗, 每14 d为1周期. 研究的主要终点是生存时间.
结果: 9例患者入组, 早期出组和早期死亡各1例, 无完全缓解病例, 1例部分缓解, 4例稳定, 2例进展. 中位生存时间为91 d(23-325 d). 2例出现间质性肺炎(考虑为自身免疫的临床症状)患者的生存时间(325 d和250 d)明显优于其他患者.
结论: GOLFIG-1方案在化疗耐药患者中是有效的, 特别在那些出现自身免疫的患者中.
引文著录: 林榕波, 范南峰, 陈玲, 刘捷. GOLFIG-1在化疗耐药转移性结肠癌中的疗效. 世界华人消化杂志 2009; 17(32): 3346-3350
Revised: September 29, 2009
Accepted: October 12, 2009
Published online: November 18, 2009
AIM: To evaluate the efficacy and safety of gemcitabine plus FOLFOX followed by subcutaneous granulocyte macrophage colony-stimulating factor and interleukin-2 (GOLFIG-1 regimen) in patients with chemotherapy-refractory metastatic colorectal cancer.
METHODS: The patients with chemotherapy-refractory metastatic colorectal cancer were given gemcitabine, oxaliplatin, levofolinic acid, and 5-fluorouracil, followed by subcutaneous granulocyte macrophage colony-stimulating factor and interleukin-2. Each cycle lasted for 14 d. The primary endpoint was survival.
RESULTS: A total of 9 patients were enrolled, of which 2 could not be evaluated because of early death or refusal of treatment. No complete response was observed. Partial response was observed in 1 patient, stable diseases in 4, and progressive disease in 2. The median survival was 91 days (range: 23-325 days). Two patients with interstitial pneumonitis (considered as clinical signs of autoimmunity) had longer survival (325 and 250 days, respectively) than other patients.
CONCLUSION: GOLFIG-1 regimen is effective in patients with chemotherapy-refractory metastatic colorectal cancer, especially in those suffering from autoimmune disorders.
- Citation: Lin RB, Fan NF, Chen L, Liu J. Chemoimmunotherapy of chemotherapy-refractory metastatic colorectal cancer with gemcitabine plus FOLFOX followed by subcutaneous granulocyte macrophage colony-stimulating factor and interleukin-2. Shijie Huaren Xiaohua Zazhi 2009; 17(32): 3346-3350
- URL: https://www.wjgnet.com/1009-3079/full/v17/i32/3346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i32.3346
在我国人群中结直肠癌的死亡率是17.4/10万, 是癌症死亡原因的第5位[1]. 目前, 氟尿嘧啶、亚叶酸联合伊立替康或奥沙利铂, 或再联合抗血管内皮生长因子单抗(贝伐单抗)或抗表皮生长因子受体单抗(西妥昔单抗、帕尼单抗)是晚期结直肠癌的最佳治疗方式[2-7], 这使得晚期结直肠癌患者的中位生存期延长到18 mo以上. 但大多数患者仍将最终死于对化疗的耐药. 因此, 需要有更多新的有效方案来治疗化疗耐药的晚期结直肠癌. 传统的观念认为化疗导致的细胞死亡是一种凋亡过程, 没有免疫原性. 但近来资料提示, 某些化疗方案可以激活免疫系统, 从而搭起一个全新的癌症治疗平台[8]. 由吉西他滨、奥沙利铂、氟尿嘧啶和亚叶酸组成的GOLF方案在离体人结肠癌细胞株研究中发现, 他们不仅有协同的细胞毒作用和促进凋亡作用, 还能导致肿瘤细胞分子和抗原的改变[9-10], 这就使化学免疫治疗成为可能. 粒细胞巨噬细胞集落刺激因子和IL-2组成的IG-1方案可以增加外周血树突状细胞和抗原特异性细胞毒T淋巴细胞的数量和活性[11], 使经GOLF改造过的抗原可以通过外周血树突状细胞递呈给特异性细胞毒T淋巴细胞, 从而杀伤对化疗耐药的肿瘤细胞, 此即为GOLFIG-1方案[12-13]. 本研究评估这个全新的治疗模式在多药耐药晚期结直肠癌患者中的疗效和毒性.
患者年龄在18岁以上; 组织学证实为结肠或直肠腺癌; 接受过氟尿嘧啶、奥沙利铂和伊立替康化疗后进展者(肠梗阻患者允许没有使用过伊立替康); 有不能手术切除的转移灶, 并且转移灶至少有单个病灶最大单径测量≥20 mm(若螺旋CT≥10 mm); 东部肿瘤合作组织行为状态评分(ECOG PS)≤3; 有充分的肝肾功能和血液学功能. 排除标准是有第二肿瘤者、有神经病变者、有脑或脑膜侵犯者、有自身免疫性疾病者(如红斑狼疮、类风湿性关节炎、硬皮病等)、正在接受免疫抑制剂治疗者(如器官移植使用环孢菌素者). 所有患者必须签署知情同意书.
1.2.1 治疗: 先给予吉西他滨1000 mg/m2, 静脉滴注30 min, 第1天, 然后依次给予亚叶酸200 mg/m2, 静脉推注30 min, 第1、2天, 氟尿嘧啶400 mg/m2, 静脉推注, 第1、2天, 氟尿嘧啶800 mg/m2, 持续静脉滴注22 h, 第1、2天, 奥沙利铂85 mg/m2, 在亚叶酸和氟尿嘧啶前静脉滴注4-6 h, 第2天, 14 d为1周期. 在单数周期中, 粒细胞巨噬细胞集落刺激因子150 μg, 皮下注射, 第3-6天, IL-2100万单位, 静脉滴注, 第7-14天. 在偶数周期中, 仅接受IL-2100万单位, 静脉滴注第3-14天. 每2周期进行1次疗效评价, 疗效有效或稳定者继续使用原方案, 直至疾病进展或出现不能耐受不良反应或患者拒绝再使用.
1.2.2 疗效和不良反应评价: 疗效评价按WHO疗效评价标准执行, 但是考虑到患者为化疗耐药的晚期患者, 生存时间短, 且多为行动不便患者, 故没有要求进行疗效确认. 同时也将观察的主要终点定为生存时间. 疾病无进展时间被定义为从入组之日开始至在肿瘤评估中首次证实疾病进展之日之间的时间, 生存时间被定义为从入组之日开始至任何原因导致死亡之日之间的时间. 不良反应评估按NCI-CTCAE v3.0分级标准执行.
统计学处理 采用Kaplan-Meier方法进行生存分析, 有效率的置信区间计算使用精确二项置信区间. 统计分析利用SPSS16.0统计软件包进行处理.
2008-01/2009-02共有结肠癌患者9例进入本研究. 患者特征详见表1. 患者年龄32-65(中位年龄45)岁, 其中男5例(55.6%), 女4例(44.4%). 大多数患者组织学分化程度较差(77.8%为G3/4). 5例(55.6%)患者累及脏器数为1个, 其余4例(44.4%)至少有3个以上的累及脏器. 最常见的累及部位为淋巴结(共5例, 占总患者的55.5%), 其次为腹膜和肝脏(各4例, 各占总患者的44.4%). 7例患者接受过结肠癌手术. 3例患者接受过氟尿嘧啶、亚叶酸和奥沙利铂(FOLFOX)治疗, 因肠梗阻和经济原因无法接受含伊立替康方案或含抗表皮生长因子受体单抗方案, 而直接进入此研究.
9例患者共接受了25个治疗周期, 中位周期数为2个(1-6个). 治疗期间的主要不良反应详见表2. 最常见的不良反应是1、2度发热、流感样症状、1、2度血液学毒性(贫血、中性粒细胞下降和血小板下降)和1、2度谷丙转氨酶增高. 3、4度不良反应最常见的是血液学毒性(主要为中性粒细胞下降和血小板下降). 2例患者出现奥沙利铂过敏反应(表现为低血压、皮疹、呼吸困难和发热). 患者5在第5周期末出现咳嗽、气促, 经胸部摄片证实为间质性肺炎, 在第6周期逐渐加重, 而停用GOLFIG-1方案. 患者1在化疗第3周期出现咳嗽、气促, 经胸部CT证实为间质性肺炎, 而停止化疗.
| 1、2度 | 3、4度 | |||
| n | % | n | % | |
| 白细胞下降 | 3 | 33.3 | 3 | 33.3 |
| 中性粒细胞下降 | 3 | 33.3 | 3 | 33.3 |
| 贫血 | 7 | 77.8 | 1 | 11.1 |
| 血小板下降 | 4 | 44.4 | 3 | 33.3 |
| 恶心 | 1 | 11.1 | 0 | 0.00 |
| 呕吐 | 1 | 11.1 | 0 | 0.00 |
| 腹泻 | 1 | 11.1 | 1 | 11.1 |
| 口腔炎 | 1 | 11.1 | 1 | 11.1 |
| 感觉神经毒性 | 1 | 11.1 | 0 | 0.00 |
| 过敏 | 2 | 22.2 | 0 | 0.00 |
| 发热 | 7 | 77.8 | 0 | 0.00 |
| 转氨酶增高 | 5 | 55.6 | 0 | 0.00 |
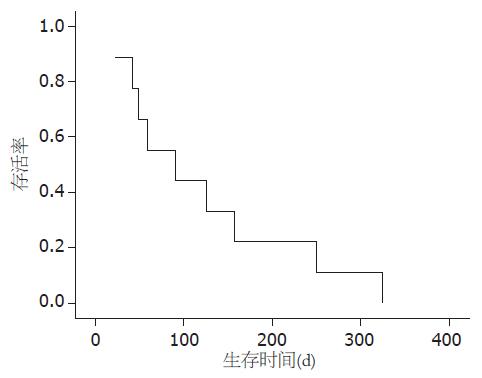
所有病例随访截至2009-05-06均已死亡. 治疗结果详见表1. 除1例因早期出组和1例因肿瘤进展早期死亡患者未能进行评价疗效之外, 其余7例患者均进行了疗效评价. 无完全缓解病例, 1例患者部分缓解, 有效率为11.1%(95%CI: 0.3%-48.3%), 4例稳定, 疾病控制率为55.6%(95%CI: 21.2%-86.3%), 2例进展. 9例患者的中位生存时间为91(23-325) d, Kaplan-Meier方法进行的生存分析见图1. 在2例间质性肺炎患者中, 编号5为曾使用过FOLFOX和伊立替康联合西妥昔单抗治疗的腹膜转移患者, 接受了6个周期GOLFIG-1, 疗效达到部分缓解, 疾病无进展时间为165 d, 生存时间为325 d. 编号1为曾使用过卡陪他滨联合奥沙利铂和FOLFIRI化疗的肺转移患者, 接受了3个周期GOLFIG-1, 疗效评价稳定, 疾病无进展时间为151 d, 生存时间为250 d.
对于氟尿嘧啶、伊立替康和奥沙利铂均耐药的晚期结直肠癌的治疗还相当困难. 目前多数指南推荐的标准治疗是抗表皮生长因子受体单抗(西妥昔单抗或帕尼单抗)单药或联合化疗, 但其疗效并不理想. 在Jonker et al[5]的Ⅲ期临床研究中, 西妥昔单抗对比最佳支持治疗治疗氟尿嘧啶、伊立替康和奥沙利铂均耐药的晚期结直肠癌, 西妥昔单抗和最佳支持治疗的中位生存时间分别为6.1和4.6 mo, 有效率分别为8%和0%. Van Cutsem et al[6]报道帕尼单抗对比最佳支持治疗治疗氟尿嘧啶、伊立替康和奥沙利铂均耐药的晚期结直肠癌Ⅲ期临床研究中, 帕尼单抗和最佳支持治疗的疾病无进展时间分别为8 wk和7.3 wk, 生存时间均为6.2 mo, 有效率分别为10%和0%. 在这2个Ⅲ期临床研究中, 最佳支持治疗的总生存时间并不相同(4.3 mo和6.2 mo), 我们认为主要是因为在Jonker et al[5]研究中有7%的最佳支持治疗患者最终接受了西妥昔单抗治疗. 而在Van Cutsem et al[6]研究中有76%的患者接受了帕尼单抗治疗. 因此, 4.3 mo更能反应氟尿嘧啶、伊立替康和奥沙利铂均耐药后的晚期结直肠癌最佳治疗的中位生存时间.
Correale et al[12]用GOLFIG-1治疗了46例晚期结直肠癌患者, 24例接受过一线化疗, 10例接受过FOLFOX或FOLFIRI二线化疗. 一线化疗方案9例为氟尿嘧啶/亚叶酸或卡陪他滨, 4例为FOLFIRI, 11例为FOLFOX. 在接受过化疗的患者中6例联合了西妥昔单抗, 3例联合了贝伐单抗. 结果10例患者达到完全缓解, 16例部分缓解, 16例稳定, 有效率为56.5%, 疾病控制率为91.3%. 中位疾病无进展时间为12.26 mo, 总生存时间为18.76 mo. Correale et al发现在出现皮损(考虑为系统性红斑狼疮)和关节炎这些自身免疫临床症状的患者中, 疾病无进展时间和生存时间均明显高于其他患者[12-14]. 多变量分析证实自体免疫的发生是疾病无进展时间和总生存时间最主要的预测变量.
在本研究中, 使用GOLFIG-1治疗氟尿嘧啶、伊立替康和奥沙利铂均耐药的晚期结直肠癌, 有1例部分缓解, 4例稳定, 中位生存时间为91 d. 而在Jonker et al[5]和Van Cutsem et al[6]的研究中最佳支持治疗的有效率为0%. 虽然本研究的中位生存时间还不如他们的最佳支持治疗结果, 但我们认为这主要源于本研究中患者的行为状况差. 本研究中ECOG PS 3分患者为4例(44.4%), 2分3例(33.3%). 而在Jonker et al[5]的研究中2分患者占23.5%, 没有3分病例. 在Van Cutsem et al[6]的研究中2分患者占15%, 3分只占1%.
Correale et al[12]的研究的有效率、疾病控制率和生存时间也明显的优于本研究. 我们分析认为除了EGOC PS的因素之外, 还有可能在Correale et al[12]的研究中有近半数患者(47.8%)未接受过化疗. 一线中有19.5%的患者只接受过氟尿嘧啶(或其衍生物)化疗. 文中并未提到对氟尿嘧啶、奥沙利铂和伊立替康均耐药患者的比例, 也未提到更改化疗方案是否是因为在既往化疗中肿瘤进展. 在实际工作中, 多数化疗患者在接受一定周期数的化疗后, 会休息一段时间. 这些休息中出现进展患者多数再接受原方案治疗仍然有效. 而本研究的病例均为接受过氟尿嘧啶、奥沙利铂和伊立替康化疗(除外3例肠梗阻患者未接受伊立替康), 并在化疗中进展. 这点可能是影响本研究疗效的最主要原因.
本研究的2例出现间质性肺炎患者有着明显优于其他患者的疗效, 我们考虑间质性肺炎是否与Correale et al研究中的皮损和关节炎一样属于自身免疫的临床症状[12-14]. 在某些恶性肿瘤中, 自体免疫和生存时间之间有着密切的关系[15-16]. 这种现象被解释为: 激活免疫系统所靶向的自体抗原是抗肿瘤免疫效应的关键, 在肿瘤和靶组织免疫过程中的抗原表达和构型的特有改变在抗原选择和继发损害中起了一定作用[16]. 在Correale et al[12]的研究中发现, 在外周血的淋巴细胞、嗜酸性粒细胞和被活性的中心记忆T淋巴细胞数目的增加的同时, 外周血调节T细胞亚群(Treg)也进行性下降. Treg是一种有强烈免疫抑制功能的淋巴细胞亚群, 他能够预防自身免疫的发生, 并且通常在癌症患者中过度增高. Treg的下降不但和自身免疫疾病的发生有关, 还可能与抗肿瘤免疫效应有关[17-18].
总之, GOLFIG-1方案在氟尿嘧啶、奥沙利铂和伊立替康均耐药的患者中是有效的, 特别是在那些出现自身免疫的患者中. 我们希望通过进一步的研究来证实他的疗效以及与自身免疫的关系.
在我国人群中结直肠癌的死亡率是17.4/10万, 是癌症死亡原因的第5位. 晚期结直肠癌的治疗是以期达到延长生存期, 提高生活质量的姑息治疗为目的, 化疗较最佳支持治疗无论是延长生存时间还是提高生活质量都有显著优势.
何超, 教授, 浙江大学医学院附属邵逸夫医院肛肠外科
对于氟尿嘧啶、伊立替康和奥沙利铂均耐药的晚期结直肠癌的治疗还相当困难. 目前多数指南推荐的标准治疗是抗表皮生长因子受体单抗(西妥昔单抗或帕尼单抗)单药或联合化疗, 但其疗效并不理想. 因此, 需要有更多新的有效方案来治疗化疗耐药的晚期结直肠癌.
抗表皮生长因子受体单抗单药或联合化疗治疗氟尿嘧啶、伊立替康和奥沙利铂均耐药的晚期结直肠癌疗效并不理想. Correale et al用本方案治疗晚期结直肠癌疗效好. 特别是在出现自身免疫临床症状(皮损和关节炎)患者中.
本研究的病例均为接受过氟尿嘧啶、奥沙利铂和伊立替康化疗, 并在化疗中进展. GOLFIG-1方案在此类化疗耐药患者中仍有效, 特别在出现自身免疫临床症状(间质性肺炎)的患者中.
经过氟尿嘧啶、奥沙利铂和伊立替康治疗失败的晚期结直肠癌患者具有体能状况较差、耐受性差等特点, 而本方案不良反应小, 治疗费用低, 有一定疗效, 值得临床推广使用.
本研究结果为晚期结直肠癌患者, 特别是化疗耐药的患者提供了新延长生命的选择, 具有一定的临床应用价值.
编辑: 李军亮 电编: 何基才
| 1. | He J, Gu D, Wu X, Reynolds K, Duan X, Yao C, Wang J, Chen CS, Chen J, Wildman RP. Major causes of death among men and women in China. N Engl J Med. 2005;353:1124-1134. [PubMed] [DOI] |
| 4. | Tournigand C, André T, Achille E, Lledo G, Flesh M, Mery-Mignard D, Quinaux E, Couteau C, Buyse M, Ganem G. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol. 2004;22:229-237. [PubMed] [DOI] |
| 5. | Jonker DJ, O'Callaghan CJ, Karapetis CS, Zalcberg JR, Tu D, Au HJ, Berry SR, Krahn M, Price T, Simes RJ. Cetuximab for the treatment of colorectal cancer. N Engl J Med. 2007;357:2040-2048. [PubMed] [DOI] |
| 6. | Van Cutsem E, Peeters M, Siena S, Humblet Y, Hendlisz A, Neyns B, Canon JL, Van Laethem JL, Maurel J, Richardson G. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol. 2007;25:1658-1664. [PubMed] [DOI] |
| 7. | Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342. [PubMed] [DOI] |
| 8. | Lake RA, van der Most RG. A better way for a cancer cell to die. N Engl J Med. 2006;354:2503-2504. [PubMed] [DOI] |
| 9. | Caraglia M, Marra M, Budillon A, Meo G, Ricciardiello F, Bismuto E, Brachelente G, Francini G, Giordano A, Correale P. Chemotherapy regimen GOLF induces apoptosis in colon cancer cells through multi-chaperone complex inactivation and increased Raf-1 ubiquitin-dependent degradation. Cancer Biol Ther. 2005;4:1159-1167. [PubMed] |
| 10. | Correale P, Cusi MG, Del Vecchio MT, Aquino A, Prete SP, Tsang KY, Micheli L, Nencini C, La Placa M, Montagnani F. Dendritic cell-mediated cross-presentation of antigens derived from colon carcinoma cells exposed to a highly cytotoxic multidrug regimen with gemcitabine, oxaliplatin, 5-fluorouracil, and leucovorin, elicits a powerful human antigen-specific CTL response with antitumor activity in vitro. J Immunol. 2005;175:820-828. [PubMed] |
| 11. | Correale P, Campoccia G, Tsang KY, Micheli L, Cusi MG, Sabatino M, Bruni G, Sestini S, Petrioli R, Pozzessere D. Recruitment of dendritic cells and enhanced antigen-specific immune reactivity in cancer patients treated with hr-GM-CSF (Molgramostim) and hr-IL-2. results from a phase Ib clinical trial. Eur J Cancer. 2001;37:892-902. [PubMed] [DOI] |
| 12. | Correale P, Tagliaferri P, Fioravanti A, Del Vecchio MT, Remondo C, Montagnani F, Rotundo MS, Ginanneschi C, Martellucci I, Francini E. Immunity feedback and clinical outcome in colon cancer patients undergoing chemoimmunotherapy with gemcitabine + FOLFOX followed by subcutaneous granulocyte macrophage colony-stimulating factor and aldesleukin (GOLFIG-1 Trial). Clin Cancer Res. 2008;14:4192-4199. [PubMed] [DOI] |
| 13. | Correale P, Cusi MG, Tsang KY, Del Vecchio MT, Marsili S, Placa ML, Intrivici C, Aquino A, Micheli L, Nencini C. Chemo-immunotherapy of metastatic colorectal carcinoma with gemcitabine plus FOLFOX 4 followed by subcutaneous granulocyte macrophage colony-stimulating factor and interleukin-2 induces strong immunologic and antitumor activity in metastatic colon cancer patients. J Clin Oncol. 2005;23:8950-8958. [PubMed] [DOI] |
| 14. | Correale P, Fioravanti A, Bertoldi I, Montagnani F, Miracco C, Francini G. Occurrence of autoimmunity in a long-term survivor with metastatic colon carcinoma treated with a new chemo-immunotherapy regimen. J Chemother. 2008;20:278-281. [PubMed] |
| 15. | Gogas H, Ioannovich J, Dafni U, Stavropoulou-Giokas C, Frangia K, Tsoutsos D, Panagiotou P, Polyzos A, Papadopoulos O, Stratigos A. Prognostic significance of autoimmunity during treatment of melanoma with interferon. N Engl J Med. 2006;354:709-718. [PubMed] [DOI] |
| 16. | Rodriguez-Lecompte JC, Kruth S, Gyorffy S, Wan YH, Gauldie J. Cell-based cancer gene therapy: breaking tolerance or inducing autoimmunity? Anim Health Res Rev. 2004;5:227-234. [PubMed] [DOI] |
| 18. | Baecher-Allan C, Viglietta V, Hafler DA. Human CD4+CD25+ regulatory T cells. Semin Immunol. 2004;16:89-98. [PubMed] [DOI] |