修回日期: 2009-10-09
接受日期: 2009-10-19
在线出版日期: 2009-11-18
目的: 探讨Syndecan-1在葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎中的表达及其在肠道炎症中的作用.
方法: 54只C57BL/6小鼠随机分为正常对照组和模型组, 每组27只. 模型组自由饮用3% DSS溶液, 5 d后改饮用蒸馏水2 wk, 建立急性结肠炎慢性化模型. 正常对照组饮用蒸馏水19 d. 于实验第5、12、19天分别处死2组各9只小鼠. HE染色评价小鼠结肠组织学改变; RT-PCR检测小鼠肠黏膜Sdc-1 mRNA及IL-8 mRNA表达; 免疫组织化学检测小鼠肠黏膜Sdc-1蛋白的表达.
结果: 第5、12、19天模型组小鼠结肠组织学评分均高于对照组(2.17±1.03、2.60±1.73、1.18±0.75 vs 0.04±0.13, 均P<0.05); 模型组小鼠肠黏膜Sdc-1 mRNA表达水平均明显低于对照组(1.58±0.13、1.39±0.17、1.78±0.08 vs2.12±0.03, 均P<0.05); 模型组小鼠肠黏膜细胞表面Sdc-1蛋白水平均明显低于对照组(1.59±0.12、1.43±0.12、1.81±0.10 vs 2.20±0.04, 均P<0.01); 模型组小鼠结肠黏膜IL-8 mRNA表达评分均高于对照组(1.20±0.15、1.53±0.05、1.65±0.04 vs 1.02±0.08,均P<0.01).
结论: 小鼠结肠炎症的严重程度可能与肠黏膜Sdc-1 mRNA及蛋白表达水平减低均有关, 而肠黏膜Sdc-1 mRNA及蛋白表达水平减低可能与肠黏膜IL-8水平增高有关.
引文著录: 王显飞, 陈予, 戴俊臣, 陈村龙, 王霞, 陈烨. Syndecan-1在急性结肠炎及慢性化小鼠模型中的表达及其意义. 世界华人消化杂志 2009; 17(32): 3296-3301
Revised: October 9, 2009
Accepted: October 19, 2009
Published online: November 18, 2009
AIM: To investigate the expression of syndecan-1 (SDC-1) in dextran sodium sulphate (DSS)-induced colitis that progresses to chronicity in mice and explore the role of SDC-1 in the progression of colitis.
METHODS: Fifty-four C57BL/6 mice were equally divided into control group and model group. The model group was fed 3% DSS ad libitum for 5 days, followed by administration of distilled water for 2 weeks to induce acute colitis that progressed to chronic inflammation. The control group was only fed distilled water. Mice were killed on days 5, 12 and 19, respectively. The histological changes in the colon were observed and scored under light microscopy. The expression of SDC-1 and interleukin-8 (IL-8) mRNAs as well as SDC-1 protein in colonic tissue was detected by reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry, respectively.
RESULTS: The histological scores on days 5, 12 and 19 were significantly higher in the model group than in the control group (2.17 ± 1.03, 2.60 ± 1.73 and 1.18 ± 0.75 vs 0.04 ± 0.13, respectively; all P < 0.05). The expression levels of SDC-1 mRNA and protein in the colon at all time points were significantly lower in the model group than in the control group (mRNA: 1.58 ± 0.13, 1.39 ± 0.17 and 1.78 ± 0.08 vs 2.12 ± 0.03, respectively; all P < 0.05; protein: 1.59 ± 0.12, 1.43 ± 0.12 and 1.81 ± 0.10 vs 2.20 ± 0.04, respectively; all P < 0.01). The expression levels of IL-8 mRNA in the colon at all time points were significantly higher in the model group than in the control group (1.20 ± 0.15, 1.53 ± 0.05 and 1.65 ± 0.04 vs 1.02 ± 0.08, respectively; all P < 0.01).
CONCLUSION: The reduced severity of colitis is associated with downregulated SDC-1 mRNA and protein expression in the colon of mice. The downregulation of SDC-1 mRNA and protein may be associated with increased IL-8 mRNA level.
- Citation: Wang XF, Chen Y, Dai JC, Chen CL, Wang X, Chen Y. Significance of syndecan-1 expression in dextran sulfate sodium-induced colitis that progresses to chronicity in mice. Shijie Huaren Xiaohua Zazhi 2009; 17(32): 3296-3301
- URL: https://www.wjgnet.com/1009-3079/full/v17/i32/3296.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i32.3296
Syndecan-1(Sdc-1)属于黏附分子整合素跨膜粘结蛋白聚糖家族成员, 生理状态下主要表达于上皮细胞表面, 是肠上皮细胞紧密连接的重要组成部分, 在炎性过程中, Sdc-1通过其胞外段硫酸乙酰肝素链(属于GAGs)共价结合多种胞外配体, 结合各种生物分子及调节各种结合蛋白的生物学功能, 参与炎症反应的多个环节[1]. 本研究通过葡聚糖硫酸钠(DSS)诱导的急性结肠炎慢性化小鼠模型监测Sdc-1在结肠炎中的变化, 探讨Sdc-1在肠道炎症中的作用.
选用健康♀C57BL/6小鼠54只, 鼠龄6-8 wk, 体质量16-20 g, 无特殊病原体(SPF)级; DSS为美国MPBiomedicals公司产品, 相对分子质量36 000-44 000 Da; TRIzol反应剂(美国Invitrogen); TaKaRa RNA PCR试剂盒(AMV)Ver.3.0及标本保存液(日本TaKaRa); 大鼠抗小鼠Sdc-1胞外段 mAb(clone 281-2)(美国休斯顿医学中心提供); 即用型非生物素免疫组织化学试剂盒与DAB显色试剂盒(福州迈新生物技术开发有限公司).
1.2.1 分组及造模: 54只C57BL/6小鼠随机分为正常对照组和模型组, 每组27只. 模型组小鼠造模按Melgar et al[2]和Cooper et al[3]的方法建立急性结肠炎慢性化模型: 给小鼠自由饮用3% DSS溶液5 d后饮用蒸馏水14 d. 对照组小鼠饮用蒸馏水19 d. 两组于实验第5、12、19天分别处死9只. 所有小鼠均以皮下注射10%水合氯醛的方法处死.
1.2.2 标本取材: 每只小鼠留取2份结肠标本: 一份以100 g/L甲醛固定, 常规石蜡包埋, 用于HE染色及免疫组织化学染色, 观察病理组织形态学变化以及Sdc-1蛋白表达. 另一份用标本保存液保存, 用于RT-PCR检测.
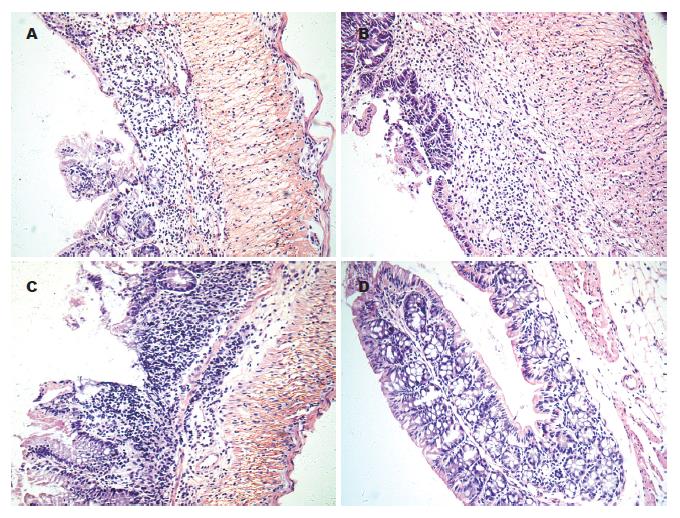
1.2.3 小鼠结肠HE染色及组织学评分: 参照Cooper et al[3]的研究观察组织学改变并评分, 平均观察15个放大100倍的视野, 取其平均值. 评分标准: 0分为正常结肠黏膜; 1分为隐窝腺体丢失1/3; 2分为隐窝腺体丢失2/3; 3分为隐窝腺体全部丢失, 黏膜上皮完整, 伴有轻度炎性细胞浸润; 4分为黏膜上皮糜烂、破坏, 伴有明显炎性细胞浸润.
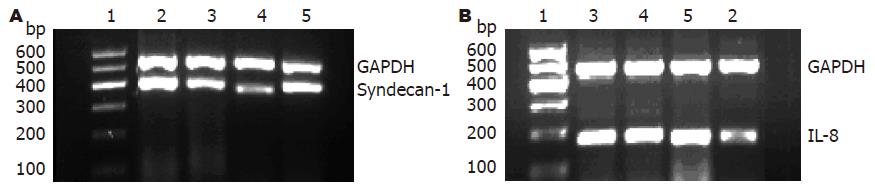
1.2.4 RT-PCR检测肠黏膜Sdc-1 mRNA表达: 提取总RNA后, 逆转录为cDNA, 行PCR扩增: 94 ℃、10 min, 94 ℃、45 s, 57.5 ℃、1 min, 72 ℃、1 min, 35个循环, 终末延伸72 ℃、10 min. 引物GAPDH上游: 5'-TGGCAAAGTGGAGATTGTT-3'; GAPDH下游: 3'-TAGTGACGGTGGGTCTTC-5'(484 bp). Sdc-1上游: 5'-CAGCAGCAACACCGAGAC-3'; Sdc-1下游: 3'-CTCCTACCTTGACGGTTAG-5'(359 bp). IL-8上游: 5'-AGAAGCATGGCCCAGAAATCA-3'; IL-8下游: 3'-GGCCTTGTAGACACCTTGGT-5'(产物: 176 bp). 扩增产物经琼脂糖电泳后, 进行成像及分析. 用Image-Pro Plus 6.0软件对RT-PCR条带进行半定量, 目的条带灰度值/内参条带灰度值 = IA比值, 以此来表示Sdc-1及IL-8 mRNA的表达水平.
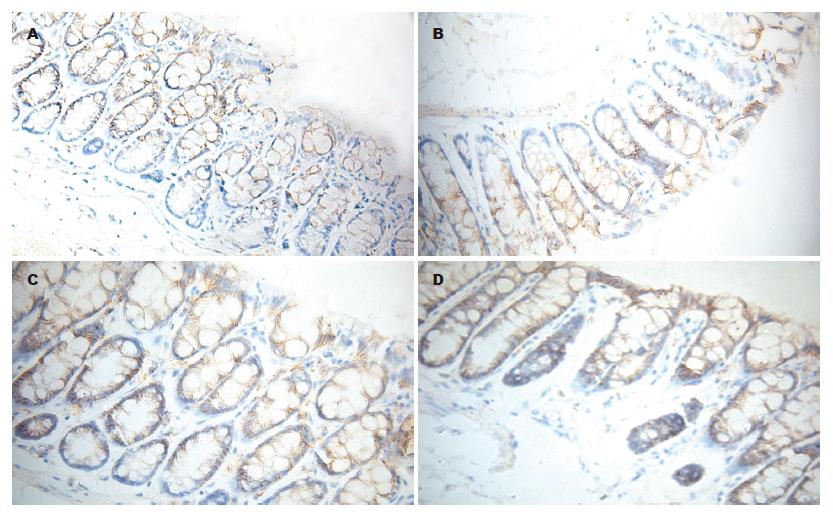
1.2.5 免疫组织化学检测肠黏膜Sdc-1蛋白表达: 免疫组织化学结果判断参照文献[4]: 凡肠黏膜上皮细胞膜和腺体细胞膜着色者为阳性, 根据染色强度和显色细胞的比例进行综合评分. 每张切片随机选取8个高倍视野(400倍)进行评分. (1)按组织显色深浅评分: 无显色者为0分, 呈浅黄色或黄色者为1分, 呈棕黄色者为2分, 呈棕褐色者为3分, 求出8个视野的平均分. (2)以细胞着色比例分级为: <25%的细胞着色, 计0.1分; 26%-50%的细胞着色, 计0.4分; 51%-75%的细胞着色, 计0.6分; 76%-100%的细胞着色, 计0.9分; 求出8个视野的平均分. (3)每张切片的积分为(1)×(2).
统计学处理 应用SPSS13.0统计软件, 数据以mean±SD表示, 组内比较采用单因素方差分析(One-way ANOVA), 组间比较采用单向方差分析(One-way ANOVA)或独立样本t检验, P<0.05为差异有统计学意义.
正常对照组小鼠结肠黏膜完整, 黏膜上皮完整、连续, 腺体排列规则、结构清楚, 几乎没有炎细胞浸润及溃疡. 模型组小鼠在第5、12、19天结肠组织学评分均高于对照组(P<0.05). 模型组小鼠第5天结肠黏膜不完整, 可见多灶性浅溃疡, 全部隐窝被破坏, 大部分腺体被破坏, 腺体正常结构丧失, 排列紊乱, 腺腔消失, 黏膜固有层大量中性粒细胞浸润; 第12天隐窝部分或全部被破坏, 杯状细胞显著丢失, 较大溃疡出现, 黏膜固有层仍有大量炎细胞浸润, 组织学评分较对照组及模型组第5天显著升高(P<0.01); 第19天可见局限性灶性小溃疡, 边缘见隐窝及杯状细胞再生、修复及腺体再生, 炎症主要累及黏膜及黏膜下层, 以淋巴细胞浸润为主, 组织学评分较模型组第5、12天显著降低(P<0.05, 图1, 表1).
正常对照组小鼠免疫组织化学积分最高. 模型组小鼠在第5、12、19天结肠黏膜Sdc-1蛋白水平均明显低于对照组(P<0.01), 且第5天时积分明显低于对照组(P<0.01), 第12天时积分最低(P<0.05), 第19天时积分较第5、12天时有所回升, 但仍低于正常对照组(P<0.05, 图2, 表2).
正常对照组小鼠Sdc-1 mRNA表达最高. 模型组小鼠在第5、12、19天结肠黏膜Sdc-1 mRNA表达均低于对照组(P<0.05), 第12天最低(1.39±0.17), 第5天次之(1.58±0.13), 第19天有所回升(1.78±0.08)但仍低于正常对照组; 且第12天Sdc-1 mRNA表达显著低于第5、19天(P<0.05, 图3A, 表2).
Sdc-1来自于希腊文syndein, 其意是指将细胞微环境成分与细胞骨架结合起来. 他属于黏附分子整合素跨膜粘结蛋白聚糖家族成员, 通过其分子表面的硫酸肝素侧链(heparan sulfate, HS), 可结合一系列配基如细胞黏附分子、基质成分、生长因子、酶和酶抑制物等, 以共受体(as cell-surface co-receptors)方式调节细胞与微环境之间的相互作用, 参与组织器官分化发育、血管形成、组织再生等一系列生理过程的调节[5]. 生理状态下, 大部分Sdc-1结合于细胞膜上, 仅有少量Sdc-1在某些切割酶类(基质金属蛋白酶等)的作用下被切割而脱落, 成为游离的Sdc-1胞外功能区. 同时, 细胞内又合成新的Sdc-1以补充细胞膜表面缺失的Sdc-1. 游离的Sdc-1包含有完整的HS链, 即Sdc-1发挥作用的主要部分[6].
本实验中, 模型组小鼠结肠组织学评分逐渐升高, 在第12天时最高, 其后逐渐减低. 模型组小鼠肠黏膜Sdc-1 mRNA表达及Sdc-1蛋白水平在各时间点均明显低于对照组, 且均表现为先逐渐下降, 在第12天时Sdc-1 mRNA表达及Sdc-1蛋白水平均出现最低值, 后随着炎症反应的逐步减轻而逐渐回升. 模型组小鼠结肠黏膜Sdc-1 mRNA表达、Sdc-1蛋白水平与组织学改变是一致的, 且Sdc-1 mRNA表达的变化与蛋白水平的变化是一致的, 这与国外学者在研究其他炎症时得出的结论相一致: 炎症时上皮细胞表面Sdc-1脱落增加[7-9], 提示Sdc-1 mRNA及Sdc-1蛋白水平表达水平与结肠炎病变严重程度有关.
本实验结论与王霞 et al[10]以三硝基苯磺酸(TNBS)-乙醇溶液灌肠诱导的小鼠结肠炎模型中肠黏膜Sdc-1蛋白水平减低而Sdc-1 mRNA表达水平无明显变化不一致, 可能与动物模型及动物种系不同有关. 小鼠DSS模型是目前应用极其广泛的结肠炎模型[11]. 国外文献认为IBD模型建立成功与否与动物种系、DSS浓度、DSS相对分子质量、DSS溶液饮用时间4种因素相关, 其中关键因素是DSS浓度和相对分子质量[12]. 本试验中选用对DSS敏感的C57BL/6小鼠, 饮用诱导结肠黏膜病变典型的分子质量为40 000的DSS制备的3% DSS溶液5 d后, 饮用蒸馏水3 wk诱发的急、慢性结肠炎, 无论是在症状还是病理变化均类似于人类结肠炎急性期和缓解期的变化[13], 具有良好的重复性.
国外文献报道中性粒细胞跨内皮的募集反应由趋化因子IL-8的浓度梯度介导, 是内皮组织对炎症信号比如TNF-α及IL-1的反应[14]. 内皮是炎症反应中白细胞募集反应的主要屏障. 中性粒细胞募集反应由跨内皮的IL-8的浓度梯度所调控, 而在活体内, 其被限制在内皮细胞表面. 在白细胞跨内皮迁移的一个体外模型中, 研究结合位点的同一性及功能表明: 在内皮组织培养的上清液中, IL-8被检测到通过结合到Syndecan-1的外功能区固定在内皮细胞的表面, 与HS及Syndecan-1形成一个三分子的复合物; IL-8/HS/Sdc-1复合物脱落增加时, 中性粒细胞跨膜迁移被抑制[14]. 在本实验中IL-8 mRNA表达水平随着造模时间的延长逐渐升高, 在19 d时最高, 而Sdc-1 mRNA及Sdc-1蛋白水平表达水平在急性期逐渐下降, 在慢性期随着炎症反应的逐步减轻逐渐回升. 提示Sdc-1 mRNA及Sdc-1蛋白水平表达水平的变化可能与IL-8 mRNA表达水平增高有关, 有待进一步研究加以证实.
鉴于近年来炎症性肠病在我国的发病率逐渐升高, 且病因及发病机制尚未完全阐明[15-16], 上述发现为临床工作中炎症性肠病的检查和病变监测提供了新的思路, 但其具体机制和意义仍有待进一步研究.
Syndecan-1(Sdc-1)属于黏附分子整合素跨膜粘结蛋白聚糖家族成员, 生理状态下主要表达于上皮细胞表面, 是肠上皮细胞紧密连接的重要组成部分, 在炎性过程中, Sdc-1通过其胞外段硫酸乙酰肝素链(属于GAGs)共价结合多种胞外配体, 结合各种生物分子及调节各种结合蛋白的生物学功能, 参与炎症反应的多个环节.
高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科
国外文献认为IBD模型建立成功与否与动物种系、DSS浓度、DSS相对分子质量、DSS溶液饮用时间4种因素相关, 其中关键因素是DSS浓度和相对分子质量.
小鼠结肠炎症的严重程度可能与肠黏膜Sdc-1 mRNA及Sdc-1蛋白表达水平减低均有关, 而肠黏膜Sdc-1 mRNA及Sdc-1蛋白表达水平减低可能与肠黏膜IL-8水平增高有关. 本实验结论与王霞 et al以三硝基苯磺酸(TNBS)-乙醇溶液灌肠诱导的小鼠结肠炎模型中肠黏膜Sdc-1蛋白水平减低而Sdc-1 mRNA表达水平无明显变化不一致, 可能与动物模型及动物种系不同有关.
Syndecan-1(Sdc-1): 属于黏附分子整合素跨膜粘结蛋白聚糖家族成员, 生理状态下主要表达于上皮细胞表面, 是肠上皮细胞紧密连接的重要组成部分.
本文实验及造模方法可靠, 统计分析合理, 参考文献较新, 选题密切注意基础联系临床, 值得临床医生阅读.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Alexopoulou AN, Multhaupt HA, Couchman JR. Syndecans in wound healing, inflammation and vascular biology. Int J Biochem Cell Biol. 2007;39:505-528. [PubMed] [DOI] |
| 2. | Melgar S, Karlsson A, Michaëlsson E. Acute colitis induced by dextran sulfate sodium progresses to chronicity in C57BL/6 but not in BALB/c mice: correlation between symptoms and inflammation. Am J Physiol Gastrointest Liver Physiol. 2005;288:G1328-G1338. [PubMed] [DOI] |
| 3. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 4. | Maitra A, Ashfaq R, Gunn CR, Rahman A, Yeo CJ, Sohn TA, Cameron JL, Hruban RH, Wilentz RE. Cyclooxygenase 2 expression in pancreatic adenocarcinoma and pancreatic intraepithelial neoplasia: an immunohistochemical analysis with automated cellular imaging. Am J Clin Pathol. 2002;118:194-201. [PubMed] [DOI] |
| 5. | Attonen A, Kajanti M, Heikkila P, Jalkanen M, Joensuu H. Syndecan-1 expression has prognostic significance in head and neck carcinoma. Br J Cancer. 1999;79:558-564. [PubMed] [DOI] |
| 6. | Dhodapkar MV, Kelly T, Theus A, Athota AB, Barlogie B, Sanderson RD. Elevated levels of shed syndecan-1 correlate with tumour mass and decreased matrix metalloproteinase-9 activity in the serum of patients with multiple myeloma. Br J Haematol. 1997;99:368-371. [PubMed] [DOI] |
| 7. | Xu J, Park PW, Kheradmand F, Corry DB. Endogenous attenuation of allergic lung inflammation by syndecan-1. J Immunol. 2005;174:5758-5765. [PubMed] |
| 8. | Hayashida A, Bartlett AH, Foster TJ, Park PW. Staphylococcus aureus beta-toxin induces lung injury through syndecan-1. Am J Pathol. 2009;174:509-518. [PubMed] [DOI] |
| 9. | Chen Y, Hayashida A, Bennett AE, Hollingshead SK, Park PW. Streptococcus pneumoniae sheds syndecan-1 ectodomains through ZmpC, a metalloproteinase virulence factor. J Biol Chem. 2007;282:159-167. [PubMed] [DOI] |
| 11. | Ohkawara T, Nishihira J, Takeda H, Hige S, Kato M, Sugiyama T, Iwanaga T, Nakamura H, Mizue Y, Asaka M. Amelioration of dextran sulfate sodium-induced colitis by anti-macrophage migration inhibitory factor antibody in mice. Gastroenterology. 2002;123:256-270. [PubMed] [DOI] |
| 12. | Vowinkel T, Kalogeris TJ, Mori M, Krieglstein CF, Granger DN. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Dig Dis Sci. 2004;49:556-564. [PubMed] [DOI] |
| 14. | Marshall LJ, Ramdin LS, Brooks T, DPhil PC, Shute JK. Plasminogen activator inhibitor-1 supports IL-8-mediated neutrophil transendothelial migration by inhibition of the constitutive shedding of endothelial IL-8/heparan sulfate/syndecan-1 complexes. J Immunol. 2003;171:2057-2065. [PubMed] |
| 15. | Hendrickson BA, Gokhale R, Cho JH. Clinical aspects and pathophysiology of inflammatory bowel disease. Clin Microbiol Rev. 2002;15:79-94. [PubMed] [DOI] |