修回日期: 2009-11-02
接受日期: 2009-11-02
在线出版日期: 2009-11-08
目的: 构建增强型绿色荧光蛋白为报告基因的pEGFP-C1-FUT3真核表达载体, 分析其在细胞系MDA-MB-231中的表达.
方法: 采用RT-PCR扩增FUT3全长基因片段, 克隆至pMD18-T载体进行测序分析, 将FUT3亚克隆至pEGFP-C1表达载体并酶切鉴定. 利用脂质体将重组真核表达载体pEGFP-C1-FUT3转染入人乳腺癌细胞MDA-MB-231中, 经G418筛选获得稳定转染的细胞系, 荧光显微镜观察及RT-PCR检测FUT3的表达.
结果: 成功获得人全长FUT3基因并构建了真核表达载体pEGFP-C1-FUT3, 体外转染MDA-MB-231细胞后荧光显微镜下可见绿色荧光蛋白的表达, 半定量RT-PCR检出高水平表达的FUT3.
结论: 成功构建了增强型绿色荧光蛋白为报告基因的FUT3真核表达载体, 并在MDA-MB-231中稳定表达, 为进一步研究FUT3的生物学功能提供基础.
引文著录: 岳丽玲, 樊丽, 刘吉成. 人FUT3基因真核表达载体的构建与表达. 世界华人消化杂志 2009; 17(31): 3210-3213
Revised: November 2, 2009
Accepted: November 2, 2009
Published online: November 8, 2009
AIM: To construct the human FUT3 (α 1, 3-fucosyltransferase) eukaryotic expression vector and analyze its expression in human breast adenocarcinoma MDA-MB-231 cells.
METHODS: The full-length FUT3 cDNA was obtained by reverse transcription-polymerase chain reaction (RT-PCR) and cloned into pMD18-T simple vector for sequence analysis. Then the FUT3 gene was subcloned into pEGFP-C1 plasmid. The resulting recombinant vector pEGFP-C1-FUT3 was identified by digestion with restriction endonucleases and transfected into MDA-MB-231 cells. A stably transfected cell line was established using G418 selection. The expression of FUT3 was observed under a fluorescence microscope and examined by semi-quantitative RT-PCR.
RESULTS: The full-length human FUT3 cDNA was successfully obtained, and the recombinant plasmid pEGFP-C1-FUT3 was successfully constructed. After transfection into MDA-MB-231 cells, green fluorescence (green fluorescent protein) was observed. Semi-quantitative RT-PCR analysis showed that FUT3 was highly expressed in MDA-MB-231 cells.
CONCLUSION: The FUT3 eukaryotic expression vector pEGFP-C1-FUT3 that can express FUT3 in MDA-MB-231 cells is constructed successfully and can be used to study the biological functions of the FUT3 gene.
- Citation: Yue LL, Fan L, Liu JC. Construction of human FUT3 eukaryotic expression vector and its expression in human breast adenocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3210-3213
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3210.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3210
肿瘤复发转移是癌症患者死亡的主要原因, 异常糖基化是恶性肿瘤转移的重要机制之一. Lewis寡糖抗原是细胞表面糖复合物(糖蛋白、糖脂和蛋白聚糖)中的糖链成分, 已经发现其在多种肿瘤中的合成异常增加, 与肿瘤增殖、浸润、转移、临床分期及预后密切相关[1]. 岩藻糖基转移酶(fucosyltransferase, FUT)是参与合成Lewis寡糖抗原的关键酶, 催化GDP-Fuc的Fuc转移至糖链中N-乙酰氨基乳糖残基的N-乙酰氨基葡萄糖上, 并以α1, 2、α1, 3/4和α1, 6岩藻糖苷键相连接[2]. αFUT共有9个亚型, 其中只有αFUT3可以形成α1, 3以及α1, 4两类键, 故又称为α1, 3/1, 4 FUT3, 既可合成LeX、LeY及sLeX, 又可合成LeA、LeB及sLeA[3]. 本研究成功地构建人FUT3基因真核表达载体pEGFP-C1-FUT3, 并体外转染人乳腺癌细胞系MDA-MB-231, 为进一步研究FUT3及其产物Lewis抗原的表达调控提供实验基础.
人乳腺癌细胞株MDA-MB-231购自上海中科院细胞库; 大肠杆菌DH5α感受态细胞由本室保存; 脂质体(lipofectamineTM 2000)及TRIzol为Invitrogen公司产品; pEGFP-C1质粒购自Biosciences Clontech公司; 胎牛血清、Leibovitz's L-15培养基购自Gibco公司; 血液总RNA提取试剂盒、质粒小量及中量提取试剂盒、凝胶回收试剂盒购自Omega公司; 限制性内切酶EcoRⅠ、XhoⅠ、T4 DNA连接酶、pMD18-T Simple、RT-PCR试剂盒为TaKaRa公司产品, 引物由上海生工生物工程技术服务有限公司合成. 其他试剂均为国产分析纯.
1.2.1 目的基因FUT3的RT-PCR扩增: 参照GenBank FUT3基因ORF序列通过Primer 5.0软件设计特异性引物: 上游5'-ccgctcgagTTCGCAACCCATACAGTGAA-3', 下游5'-ccggaattcCAGGCAGATGAGGTTCCC-3', 分别在5'端加上XhoⅠ和EcoRⅠ的酶切位点. 采用Omega血液总RNA提取试剂盒提取健康男性外周血总RNA. 以总RNA为模板, 使用TaKaRa cDNA Kit进行逆转录反应, 获得cDNA. PCR扩增FUT3基因, 反应体系按说明书, 反应条件为: 95 ℃预变性5 min, 95 ℃变性50 s, 62.8 ℃退火l min, 72 ℃延伸1.5 min, 35个循环; 最后72 ℃延伸10 min, 扩增片段长度为1172 bp. PCR扩增产物用1.0%琼脂糖凝胶电泳进行鉴定.
1.2.2 T载体克隆和测序: DNA凝胶回收试剂盒回收纯化PCR产物, 将目的片段与pMD18-T载体16 ℃过夜连接. 取连接产物转化DH5α感受态大肠杆菌, 蓝白斑筛选挑取阳性克隆送交Invitrogen公司测序鉴定.
1.2.3 pEGFP-C1-FUT3真核表达载体的构建: 用XhoⅠ、EcoRⅠ分别双酶切重组pMD18-T-FUT3质粒及pEGFP-C1空载体, 凝胶电泳回收并纯化目的基因片段, 用T4 DNA连接酶连接, 过夜. 次日, 连接产物转化DH5α感受态大肠杆菌, Omega小提质粒试剂盒抽提质粒DNA, 内切酶XhoⅠ和EcoRⅠ双酶切鉴定.
1.2.4 真核表达载体pEGFP-C1-FUT3转染人乳腺癌细胞MDA-MB-231: 转染前24 h将处于对数生长期的人乳腺癌细胞MDA-MB-231用胰酶消化, 按4×105个细胞/孔的浓度接种于6孔板内, 37 ℃培养至细胞密度为80%-90%时换无血清无双抗Leibovitz's L-15培养基, 用脂质体lipofectamineTM 2000分别介导空质粒及重组质粒转染MDA-MB-231细胞, 按试剂说明书进行操作. 转染24 h后, 换用含有G418(800 mg/L)的L-15培养液进行筛选, 2 wk后G418改为400 mg/L维持剂量筛选. 分离出抗G418的阳性克隆, 然后再扩大培养, 得到稳定传代的细胞克隆, 荧光显微镜下观察增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)的表达情况.
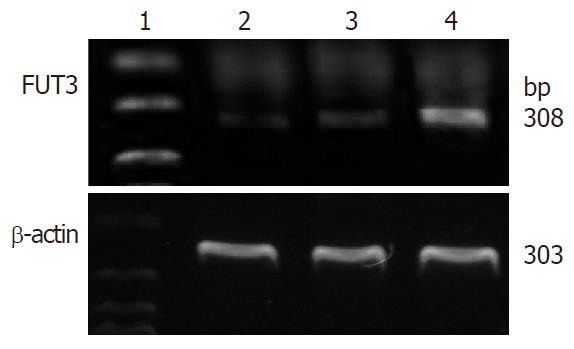
1.2.5 RT-PCR鉴定FUT3基因在MDA-MB-231细胞中的稳定表达: 收集稳定转染FUT3基因的乳腺癌MDA-MB-231细胞, 用TRIzol提取细胞总RNA, 进行逆转录. 以β-actin为内参照, 半定量PCR鉴定FUT3基因. FUT3引物序列为: 上游5'-GAAGCTGTGGAGGAACGC-3', 下游5'- TGAACCAAGCCGCTATGC3-3', 扩增片段为308 bp; β-actin引物序列为: 上游5'-GTGGACATCCGCAAAGAC-3', 下游5'-GAAAGGGTGTAACGCAACT-3', 扩增片段为303 bp. 1.5%琼脂糖凝胶电泳检测PCR产物.
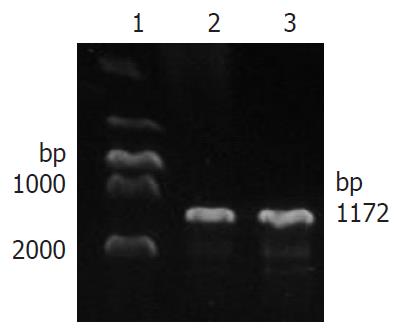
以人外周血白细胞提取的RNA为模板, 逆转录合成cDNA, PCR扩增产物经1.0%琼脂糖凝胶电泳可见1172 bp处有明显的扩增条带, 与预期结果一致(图1).
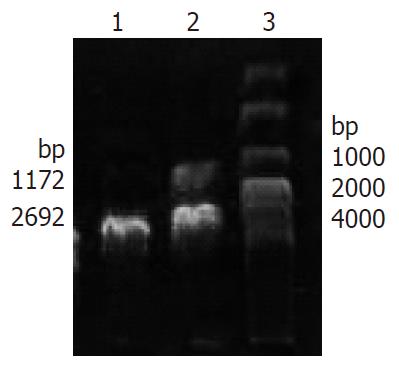
目的基因与T载体连接后, pMD18-T-FUT3重组体经XhoⅠ与EcoRⅠ双酶切后产生2692 bp的pMD18-T载体片段和1172 bp的FUT3基因片段2个条带, 表明pMD18-T-FUT3质粒构建成功(图2). 菌液测序结果显示: 插入T载体的序列与GenBank中登录的人FUT3基因编码区(CDS)报道序列完全一致.
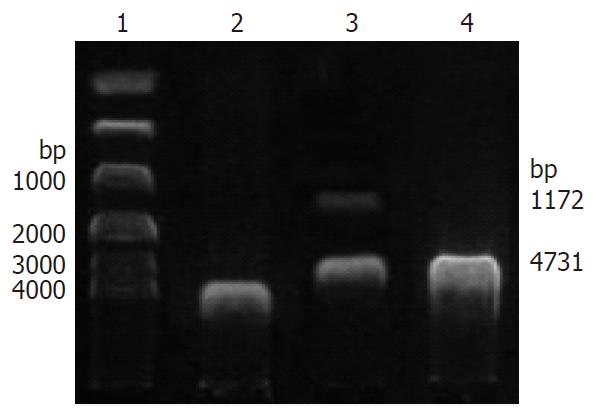
重组质粒pEGFP-C1-FUT3经限制性内切酶XhoⅠ和EcoRⅠ双酶切后, 经琼脂糖凝胶电泳显示在4731 bp和1172 bp处有2个片段, 分别与pEGFP-C1载体以及FUT3目的基因大小一致, 证明FUT3已经成功构建到pEGFP-C1载体中(图3).
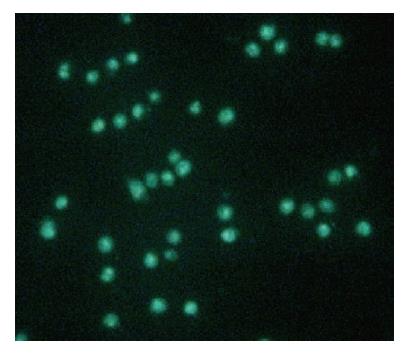
FUT3在MDA-MB-231细胞中的表达 利用脂质体转染技术, 将重组质粒pEGFP-C1-FUT3与空载体质粒pEGFP-C1转染入MDA-MB-231细胞中, 倒置荧光显微镜下观察到转染pEGFP-C1-FUT3细胞内有较强的绿色荧光, EGFP-FUT3融合蛋白主要定位在细胞质(图4).
308 bp处有目的基因表达, 转染pEGFP-C1-FUT3组的细胞FUT3基因表达与未转染组及转空载体组相比, 表达量有明显增高, 而未转染组与转空载体组细胞FUT3表达量均较低(图5).
细胞癌变过程中总伴有糖链结构的改变, 黏附、迁移及侵袭等重要的细胞学行为都与特定的糖链的结构或糖基有关[3]. 岩藻糖残基是细胞表面寡糖链中的重要基团之一, 可参与构成某些重要黏附分子的糖链结构, 如Lewis抗原决定簇(LeA、LeX、sLeA及sLeX)的构成[4]. 许多恶性肿瘤细胞表面有LeX及其相关结构的高度表达, sLeX与sLeA在某些类型的肿瘤中作为肿瘤标志物, 与患者生存率直接相关并可作为转移性疾病的预后指标[5-7]. LeX结构的表达取决于α1, 3/4FUT, 是LeX抗原合成中的最后一步. 该基因编码6种α1, 3/4FUTs家族成员(FUT3-7与FUT9)[8-9]. FUT3(Lewis血型)主要分布在肾、胆囊、乳汁中[10], 是唯一可形成α1, 3与α1, 4两类键的FUT, 既能合成带α1, 3-Fuc的LeX、LeY、sLeX, 又能唯一合成带α1, 4-Fuc的LeA、LeB及sLeA. 研究表明[11-13], FUT3基因与FUT6基因与某些肿瘤的sLeX合成相关. Kazuhiro et al[14]测得在15株上皮细胞癌细胞系中有14株表达sLeX结构, 8株表达sLeA, 其中14株细胞系中能检测到FUT3的mRNA, 与sLeX在细胞表面的表达相一致. Kimura et al[15]利用免疫组织化学染色检测正常结肠组织中FUT3表达很少, 而在结肠肿瘤组织中, FUT3呈现大量增强的表达, 呈分散、随机分布. 因此, 建立一个具有生物学功能的FUT3蛋白表达系统, 对深入研究FUT3的生物学功能及分子机制有着十分重要的作用.
为了明确在肿瘤转移过程中FUT3基因调控机制, 本实验克隆了FUT3基因的全序列, 并成功地构建了以EGFP为报告基因的真核表达质粒pEGFP-C1-FUT3, 通过脂质体2000成功地稳定转染靶细胞MDA-MB-231, 荧光检测及RT-PCR证实FUT3在MDA-MB-231细胞中有效表达. 表达载体的构建是在细菌质粒上引入一个真核启动子, 在启动子的下游插入目的蛋白的编码基因, 由于质粒上不仅有大肠杆菌的复制起点, 而且有真核启动子, 所以表达载体既可在大肠杆菌中复制又在真核细胞中表达. 同时pEGFP-C1表达载体中含有EGFP, 该基因与目的基因连接形成融合蛋白, 可以进行细胞水平上的快速筛选、检测该载体的转染和表达效率, 而不影响目的基因的表达.
总之, 本研究成功构建了EGFP为报告基因的真核表达载体pEGFP-C1-FUT3, 为深入研究FUT3对糖抗原合成的调控及FUT3对肿瘤细胞行为学的影响提供了理想的载体, 同时为下一步的重组质粒实验奠定了基础.
细胞癌变过程中总伴有糖链结构的改变. 岩藻糖残基是细胞表面寡糖链中重要基团之一, 可参与构成某些重要黏附分子的糖链结构, 如Lewis抗原决定簇(LeA、LeX、sLeA和sLeX). sLeX和sLeA作为肿瘤相关抗原在许多恶性肿瘤细胞表面高度表达, 而α1, 3-岩藻糖基转移酶Ⅲ(FUT3)是参与合成Lewis抗原的关键酶之一.
李增山, 副教授, 中国人民解放军第四军医大学病理教研室
本研究首次克隆人FUT3的基因, 并且转染至MDA-MB-231细胞中获得稳定表达的细胞株.
本文成功地构建人FUT3基因真核表达载体pEGFP-C1-FUT3, 并体外转染人乳腺癌细胞系MDA-MB-231, 为深入研究FUT3对糖抗原合成的调控及FUT3对肿瘤细胞行为学的影响提供了理想的载体.
本研究构建了FUT3的绿色荧光表达载体, 为阐释其在肿瘤中的生物学作用奠定了基础, 有一定的实用性, 但实验过程较简单.
编辑: 李瑞敏 电编: 吴鹏朕
| 1. | Brooks SA, Leathem AJ. Expression of the CD15 antigen (Lewis x) in breast cancer. Histochem J. 1995;27:689-693. [PubMed] [DOI] |
| 2. | Prorok-Hamon M, Notel F, Mathieu S, Langlet C, Fukuda M, El-Battari A. N-glycans of core2 beta(1,6)-N-acetylglucosaminyltransferase-I (C2GnT-I) but not those of alpha(1,3)-fucosyltransferase-VII (FucT-VII) are required for the synthesis of functional P-selectin glycoprotein ligand-1 (PSGL-1): effects on P-, L- and E-selectin binding. Biochem J. 2005;391:491-502. [PubMed] [DOI] |
| 3. | Ito H, Hiraiwa N, Sawada-Kasugai M, Akamatsu S, Tachikawa T, Kasai Y, Akiyama S, Ito K, Takagi H, Kannagi R. Altered mRNA expression of specific molecular species of fucosyl- and sialyl-transferases in human colorectal cancer tissues. Int J Cancer. 1997;71:556-564. [PubMed] [DOI] |
| 4. | Raes G, Ghassabeh GH, Brys L, Mpofu N, Verschueren H, Vanhecke D, De Baetselier P. The metastatic T-cell hybridoma antigen/P-selectin glycoprotein ligand 1 is required for hematogenous metastasis of lymphomas. Int J Cancer. 2007;121:2646-2652. [PubMed] [DOI] |
| 5. | Kimura H, Shinya N, Nishihara S, Kaneko M, Irimura T, Narimatsu H. Distinct substrate specificities of five human alpha-1,3-fucosyltransferases for in vivo synthesis of the sialyl Lewis x and Lewis x epitopes. Biochem Biophys Res Commun. 1997;237:131-137. [PubMed] [DOI] |
| 6. | Magnani JL. The discovery, biology, and drug development of sialyl Lea and sialyl Lex. Arch Biochem Biophys. 2004;426:122-131. [PubMed] [DOI] |
| 7. | Miyoshi E, Moriwaki K, Nakagawa T. Biological function of fucosylation in cancer biology. J Biochem. 2008;143:725-729. [PubMed] [DOI] |
| 8. | Kudo T, Fujii T, Ikegami S, Inokuchi K, Takayama Y, Ikehara Y, Nishihara S, Togayachi A, Takahashi S, Tachibana K. Mice lacking alpha1,3-fucosyltransferase IX demonstrate disappearance of Lewis x structure in brain and increased anxiety-like behaviors. Glycobiology. 2007;17:1-9. [PubMed] [DOI] |
| 9. | Escrevente C, Machado E, Brito C, Reis CA, Stoeck A, Runz S, Marme A, Altevogt P, Costa J. Different expression levels of alpha3/4 fucosyltransferases and Lewis determinants in ovarian carcinoma tissues and cell lines. Int J Oncol. 2006;29:557-566. [PubMed] |
| 10. | Narimatsu H. [Human fucosyltransferases: tissue distribution of blood group antigens, cancer-associated antigens and fucosyltransferases]. Tanpakushitsu Kakusan Koso. 1998;43:2394-2403. [PubMed] |
| 11. | Togayachi A, Kudo T, Ikehara Y, Iwasaki H, Nishihara S, Andoh T, Higashiyama M, Kodama K, Nakamori S, Narimatsu H. Up-regulation of Lewis enzyme (Fuc-TIII) and plasma-type alpha1,3fucosyltransferase (Fuc-TVI) expression determines the augmented expression of sialyl Lewis x antigen in non-small cell lung cancer. Int J Cancer. 1999;83:70-79. [PubMed] [DOI] |
| 12. | Johnson PH, Donald AS, Clarke JL, Watkins WM. Purification, properties and possible gene assignment of an alpha 1,3-fucosyltransferase expressed in human liver. Glycoconj J. 1995;12:879-893. [PubMed] [DOI] |
| 13. | Malagolini N, Santini D, Chiricolo M, Dall'Olio F. Biosynthesis and expression of the Sda and sialyl Lewis x antigens in normal and cancer colon. Glycobiology. 2007;17:688-697. [PubMed] [DOI] |
| 14. | Yago K, Zenita K, Ginya H, Sawada M, Ohmori K, Okuma M, Kannagi R, Lowe JB. Expression of alpha-(1,3)-fucosyltransferases which synthesize sialyl Le(x) and sialyl Le(a), the carbohydrate ligands for E- and P-selectins,in human malignant cell lines. Cancer Res. 1993;53:5559-5565. [PubMed] |
| 15. | Kimura H, Kudo T, Nishihara S, Iwasaki H, Shinya N, Watanabe R, Honda H, Takemura F, Narimatsu H. Murine monoclonal antibody recognizing human alpha(1,3/1,4)fucosyltransferase. Glycoconj J. 1995;12:802-812. [PubMed] [DOI] |