修回日期: 2009-10-23
接受日期: 2009-10-26
在线出版日期: 2009-11-08
目的: 探讨中药丹参活性成分TanⅡA对肠癌小鼠皮下移植瘤微血管生成的抑制作用.
方法: 通过腋下接种小鼠C26肠癌细胞, 建立小鼠结肠癌移植瘤模型, 随机分为: 模型组、TanⅡA低[0.5 mg/(kg•d)]、中[1 mg/(kg•d)]、高[2 mg/(kg•d)]剂量组、5-氟脲嘧啶[1 mg/(kg•d)]组, 经尾静脉分别给予生理盐水、不同浓度的TanⅡA及5-氟脲嘧啶, 每天1次, 给药1 wk. 给药7 d后摘除眼球取血, 剥离瘤体, 测量大小及质量. 免疫组织化学法检测MVD, HE染色检测肿瘤组织坏死情况, ELISA法检测小鼠血清VEGF的表达.
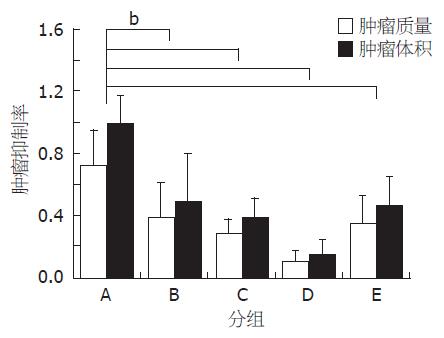
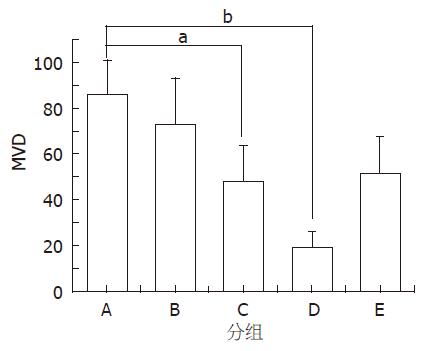
结果: TanⅡA低、中、高剂量的肿瘤质量抑制率分别为: 45.8%、60.3%及84.5%, 肿瘤体积抑制率为: 50.5%、60.7%及84.2%; 模型组与低剂量组肿瘤组织以轻度坏死为主, MVD值分别为: 86.5±14.6与73.5±19.8, 中、高剂量组则以中、重度坏死为主, MVD值分别为: 48.6±15.2与19.4±6.6; 模型组血清VEGF的浓度显著高于空白组, TanⅡA低、中、高剂量组VEGF抑制率分别为: 15.8%、34.2%及74.8%.
结论: TanⅡA能够抑制小鼠肠癌微血管生成, 并对肠癌的生长有明显抑制作用, 其抗肠癌作用与抑制VEGF、MVD有关.
引文著录: 周利红, 刘宣, 王炎, 范忠泽, 孙珏, 李琦. 丹参酮ⅡA对小鼠肠癌皮下移植瘤血管新生的抑制作用. 世界华人消化杂志 2009; 17(31): 3203-3209
Revised: October 23, 2009
Accepted: October 26, 2009
Published online: November 8, 2009
AIM: To investigate the effects of tanshinone IIA (an active component of traditional Chinese medicine salvia miltiorrhiza) on angiogenesis in subcutaneous colorectal cancer xenografts in mice.
METHODS: An ectopic mouse model of colorectal cancer was established by subcutaneously inoculating colon carcinoma C26 cells into the armpit of mice. The mice were then randomly divided into 5 groups: model control group, low-dose tanshinone IIA group [0.5 mg/(kg•d)], mid-dose tanshinone IIA group [1 mg/(kg•d)], high-dose tanshinone IIA group [2 mg/(kg•d)], and 5-fluorouracil (5-FU) group [1 mg/(kg•d)]. Normal saline (model control group), tanshinone IIA of different doses and 5-FU were injected via the vena caudalis once daily for one week, respectively. Seven days later, the eyeballs were removed to collect blood samples, and the tumors were peeled off to measure tumor size and weight. The microvessel density (MVD) was tested by immunohistochemistry. Tumor necrosis was detected by hematoxylin and eosin staining. Serum VEGF level was assayed by enzyme-linked immunosorbent assay (ELISA).
RESULTS: Compared with the model control group, tumor weight decreased by 45.8%, 60.3% and 84.5% in the low-, mid- and high-dose tanshinone IIA groups, respectively. Corresponding tumor size decreased by 50.5%, 60.7% and 84.2%, respectively. Tumor necrosis was mild in the model control group and low-dose tanshinone IIA group, but moderate to severe in the mid- and high-dose tanshinone IIA groups. The MVD was higher in the model control group and low-dose tanshinone IIA group than in the mid- and high-dose tanshinone IIA groups (86.5 ± 14.6 and 73.5 ± 19.8 vs 48.6 ± 15.2 and 19.4 ± 6.6, respectively). Serum VEGF level was significantly higher in the model control group than in the normal control group. Compared to the model control group, serum VEGF levels decreased by 15.8%, 34.2% and 74.8% in the low-, mid- and high-dose tanshinone IIA groups, respectively.
CONCLUSION: Tanshinone IIA can inhibit tumor angiogenesis and growth of colorectal cancer xenografts in mice perhaps via inhibition of VEGF and MVD.
- Citation: Zhou LH, Liu X, Wang Y, Fan ZZ, Sun J, Li Q. Tanshinone IIA inhibits angiogenesis in subcutaneous colorectal cancer xenografts in mice. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3203-3209
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3203
大肠癌是临床上常见的消化系恶性肿瘤之一, 发病率仅次于胃癌和肝癌, 并呈现逐年上升的趋势[1], 成为严重威胁人类健康的重大疾病. 肿瘤微血管生成在大肠癌的发生、发展、侵袭转移过程是起着重要的作用[2]. 丹参酮ⅡA(tanshinone ⅡA, TanⅡA) 是中药丹参的有效活性成分, 最早用于心血管疾病, 近年来发现具有明显的抗肿瘤作用, 其抗癌机制涉及抑制细胞增殖[3]、促进细胞凋亡[4]、诱导肿瘤细胞分化[5-6]等. 但对肠癌血管新生的作用尚未见报道. 本研究建立C26细胞小鼠结肠癌移植瘤模型, 体内研究TanⅡA对肠癌微血管生成的作用及对血管内皮生长因子(vascular endothelial growth factor, VEGF)和微血管密度(microvessel density, MVD)的影响.
Babl/c F1代小鼠60只, ♂, 体质量18±2 g, 清洁级, 购自上海斯莱克实验动物有限责任公司, 饲养于上海中医药大学附属普陀医院实验动物室. 合格证编号: SCHK(沪) 2007-0005; 小鼠C26结肠癌细胞(购自上海医药工业研究院); Tan ⅡA, 含量>98%, 西安冠宇生物技术有限公司, 批号: 20070621; 5氟脲嘧啶(5-FU)为上海旭东海普药业有限公司生产, 批号: 20070802; 小鼠VEGF ELISA试剂盒(美国Bio Sources公司); 山羊抗小鼠CD34 mAb(美国R&D公司).
1.2.1 细胞培养: 小鼠结肠癌C26细胞引自上海医药工业研究院药理研究室. 细胞培养于含100 mL/L胎牛血清、1×105 U/L青霉素、链霉素的RPMI l640培养液中, 37 ℃, 50 mL/L CO2培养箱内常规传代培养.
1.2.2 小鼠肠癌模型的制作及分组给药: 参照文献报道的方法[7], 取对数生长的C26细胞, 以5×l06/只数量接种于小鼠腋下. 7-10 d后形成肿瘤, 生长旺盛期的瘤组织剪切成1 mm3左右, 在无菌条件下, 接种于小鼠右侧腋窝皮下, 如此传3代后, 大批接种小鼠腋下, 待瘤体生长约100 mm3随机分为5组, 每组8只, 分别为模型组、TanⅡA低、中、高剂量组[8]和5-FU组. TanⅡA低、中、高剂量组分别经尾静脉注射0.5、1、2 mg/(kg·d)的TanⅡA, 5-FU组尾静脉注射1 mg/(kg·d)的5-FU, 空白组和模型组每天注射等量的生理盐水, 连续给药1 wk. 给药7 d后, 小鼠摘除眼球取血, 以颈椎脱臼法处死, 剥离剥离体, 剔除结缔组织, 测量肿瘤长、宽及质量后, 以40 g/L甲醛溶液固定, 石蜡包埋, 4 μm厚连续切片.
1.2.3 抑瘤率的计算: 抑瘤率以模型组和给药组肿瘤体积及瘤体质量的变化进行计算, 肿瘤体积(TV)的计算公式[9]为: TV = ab2/2, 其中a、b分别表示瘤体的长、宽. 肿瘤体积抑制率 = (1-实验组平均瘤体积/对照组平均瘤体积)×100%, 瘤重抑制率 = (l-实验组平均瘤质量/对照组平均瘤质量)×100%.
1.2.4 HE染色: 取材组织块, 经40 g/L甲醛溶液固定后, 常规石蜡包埋, 取完整的肿瘤蜡块以最大面积4 μm厚切片, 在100倍光学显微镜下挑选坏死面积最高密度区域, 在200倍光镜下随机选择3个高倍视野进行拍照, 在专业图像处理软件Image Pro Plus 6.0的辅助下采用双盲法分别进行切片坏死面积统计. 坏死面积占切片总面积的<5%记0分、5%-25%记1分、25%-50%记2分、>50%记3分[10].
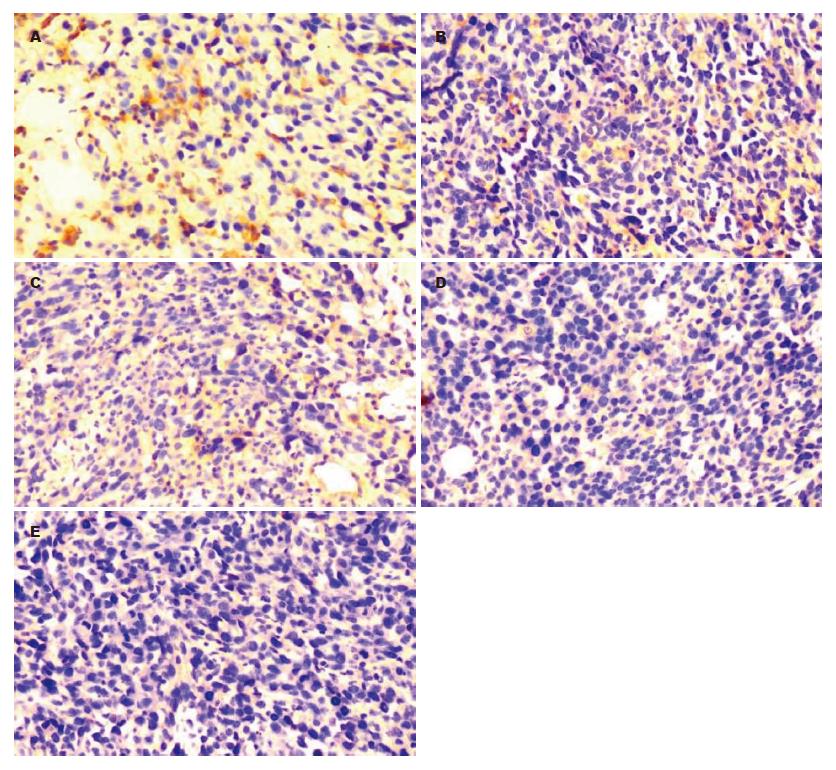
1.2.5 SP免疫组织化学染色: 取存档蜡块制成4 μm连续切片, 二甲苯脱蜡, 梯度酒精脱水. 将切片依次经内源性过氧化物酶清除、抗原修复、正常血清封闭、抗体结合、DAB染色、蒸馏水洗涤, 再经苏木素衬染, 烟酸酒精分化, 稀氨水蓝化. 递增梯度酒精脱水, 二甲苯透明, 常规树脂封片. 所用一抗为1:50稀释的山羊抗小鼠CD34 mAb, 二抗为1:200生物素标记二抗, 显色时加入1:200辣根酶标记链霉卵白素, 3种试剂均以磷酸盐缓冲液稀释. MVD的检测方法按Weidner法[11]进行: (1)CD34阳性以血管内皮细胞呈棕色或棕黄色染色为标准; (2)切片在100倍光镜下挑选微血管分布最高密度区域, 在200倍光镜下计数不重复视野中被CD34染成棕黄色的微血管数, 取其平均值作为MVD. 每个与邻近微血管明显分离的阳性染色的血管内皮细胞或血管内皮细胞簇都视为独立的微血管; 只要结构不相连, 其分支结构也计作一个血管计数.
1.2.6 酶联免疫吸附试验(ELISA法): 将经眼球静脉丛取出的正常组、模型组及给药组的小鼠全血离心后, 收集血清, 采用小鼠VEGF ELISA检测试剂盒分别测定各组小鼠血清VEGF的表达情况, 具体检测方法参照美国Bio Sourse公司提供的试剂盒说明书进行. 将检测结果用ELISA标准曲线专用软件作出VEGF浓度的标准曲线, 分别用标准曲线计算出各检测孔中VEGF的浓度.
统计学处理 采用PEMS3.1医学统计软件包对数据进行统计分析, 所得到的计量资料数据以mean±SD表示, 多样本均数比较用单因素方差分析, 各组两两比较采用Student-Newman-KeuLs检验, 等级资料使用等级资料频数表表示, 数据统计用多个样本比较的秩和检验, 各组两两比较采用Wilcoxon检验, 统计结果以P<0.05为差异有显著性.
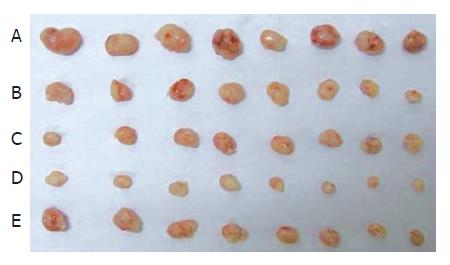
肠癌皮下移植瘤小鼠造模7 d后, 游标卡尺测量给药前各组小鼠肿瘤体积大小, 各组之间无明显差异. 经尾静脉给予不同浓度的TanⅡA后, 各组均有不同程度的抑制作用, TanⅡA低、中、高剂量的肿瘤质量抑制率分别为45.8%、60.3%、84.5%, 肿瘤体积抑制率为50.5%、60.7%、84.2%, 与模型组比较, 各给药组肿瘤质量及体积均低于模型组(均P<0.01). 中剂量的TanⅡA与同剂量的5-FU瘤质量抑制率分别为60.3%和50.3%, 体积抑制率分别为60.7%和53.1%, 2组相比无统计学意义(P>0.05, 表1, 图1-2).
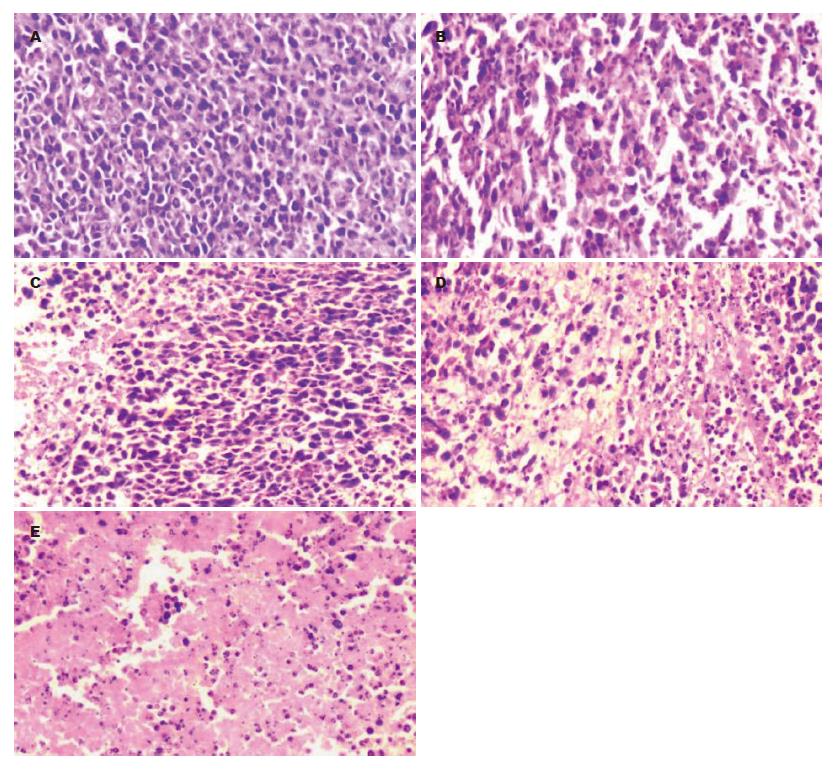
给药前, 肉眼观察各组荷瘤小鼠肿瘤体积大小无明显差异, 大小约为100 mm3. 给药7 d后, 各组肿瘤均有不同程度的增长, 其中以模型组增长最快. 处死小鼠后取出瘤体进行HE染色, 结果显示, 模型组以无坏死和轻度坏死为主, TanⅡA各剂量组以中重度坏死为主, 细胞核萎缩、变形及破碎, 细胞排列稀疏, 以胞质着紫色及粉红色为主, 中、高剂量组的肿瘤坏死程度与生理盐水组相比, 具有显著性差异(均P<0.05); 5-FU组以轻、中度坏死为主(P>0.05), 坏死程度略高于模型组及低剂量TanⅡA组, 但不及中、高剂量TanⅡA组(表2, 图3).
免疫组织化学测定给药7 d的各组肠癌小鼠微血管密度, 结果发现, 模型组肿瘤组织微血管新生最为明显, 200倍光镜视野下满布密集的微血管, MVD值为86.5±14.6. 各给药组也有部分微血管新生, 但微血管密度随药物剂量的加大而减少, MVD值以TanⅡA高剂量组的19.4±6.6最低, 其次为中剂量组的48.6±15.2和5-FU组的51.9±15.8, 而低剂量组则为73.5±19.8. 与模型组比较, TanⅡA高剂量组最具统计学意义(P<0.01), 肿瘤微血管新生抑制作用最明显, TanⅡA中剂量组和5-FU组抑制作用不如高剂量组, 但也有统计意义(均P<0.05), 低剂量组则无明显差别(图4-5).
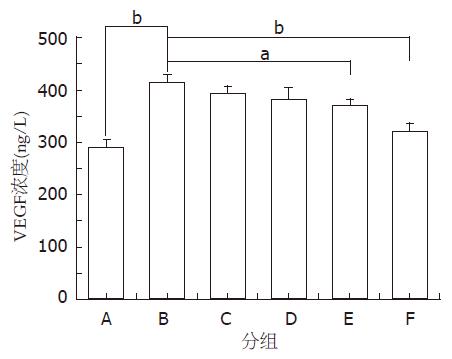
给药后小鼠眼球取血, ELISA法测得模型组血清VEGF的浓度显著高于空白组(415.4±14.2 ng/L vs 292.0±13.5 ng/L, P<0.01), TanⅡA各组VEGF的抑制作用随浓度的增加而增强, 低、中、高浓度的抑制率分别为15.8%、34.2%和74.8%, 低、中剂量组作用明显低于高剂量组. 中浓度的TanⅡA与同等剂量的5-FU相比, 两者对VEGF的抑制作用无明显的统计学意义(表3, 图6).
肿瘤血管新生(tumor angiogenesis)或血管生成(vascularization)是实体瘤生长非常关键的因素, 不但成为肿瘤生长的基础, 而且构成了肿瘤细胞侵袭转移的首要靶目标, 肿瘤细胞转移及其在转移部位的生长也依赖于肿瘤血管生成. 早在20世纪70年代, Folkman教授就提出, 肿瘤生长与血管生成有重要的联系: 一方面, 肿瘤生长需要血管为之提供养料并运走代谢废料. 没有血管, 肿瘤一般只生长到1-2 mm; 另一方面, 肿瘤组织内血管密度的增加、肿瘤边缘部位的瘤细胞与血管接触增多, 也进一步促使肿瘤细胞随细胞数量的增多而脱落进入血管的机会增加[12]. 肿瘤血管生成受血管生成因子和血管生成抑制因子的两者有机调控: 一旦血管生成因子上调或血管生成抑制因子功能障碍, 二者平衡被打破即发生肿瘤血管新生[13-14]. 肿瘤细胞分泌的血管生成因子能将增强新血管生成和增殖的特殊基因激活和蛋白表达的信号传递到正常组织周围, 从而使血管内皮细胞加速分化, 产生微血管包绕到肿瘤组织周围, 从而促进肿瘤侵袭和转移. 因此, 肿瘤血管生成对肿瘤细胞的转移有直接的和间接的促进作用, 可有效调控血管生成和抑制因子间的动态平衡, 是抗肿瘤血管生成治疗的关键和作用靶点[15].
近年来肠癌的发病率呈逐年上升趋势, 手术作为治疗大肠癌的重要手段之一是必不可少的, 但是术后5年生存率为50%-60%左右[16], 扩大手术范围则无法提高患者的受益率. 近20年来, 大肠癌术后防治研究虽然已有长足的发展, 治疗手段不断提高(手术、放疗、化疗、生物反应调节治疗等), 但5年生存率并没有得到明显提高[17], 其主要原因是由于肿瘤血管新生导致的肿瘤向其他脏器组织侵袭、转移. 因此, 肿瘤形成过程的血管生成、侵袭、转移是肿瘤治疗的最大的障碍, 如何在肿瘤形成过程中抑制肿瘤血管新生, 阻断原发瘤向其他器官的侵袭转移是防治大肠癌的一个重要手段, 也是目前肿瘤综合治疗亟待解决的问题.
TanⅡA是从中药丹参中提取的脂溶性有效成分, 具有抗氧化、抗心脑血管疾病、抗菌消炎等药理作用, 近年研究发现TanⅡA对肝癌、胃癌、肠癌等肿瘤细胞具有杀伤作用. TanⅡA为活血化瘀中药丹参提取的有效活性成分, 体外研究显示TanⅡA对多种肿瘤细胞(肝癌、胃癌、结直肠癌、鼻咽癌等) 具有抑增殖、促凋亡的作用, 是一种较好的抗肿瘤中药单体, 但TanⅡA体内抗肿瘤效应及作用机制研究目前报道不多.
目前对肿瘤新生血管形成研究中最常用的方法是MVD的测定, 大量研究证明, MVD与血道转移密切相关[18-19], 是一种较为可靠的研究方法. MVD被认为是判断肿瘤进展及转移潜力的指标, 是影响患者生存的独立预后因素[20], 目前评价肿瘤血管形成大多经免疫组织化学微血管计数来分析肿瘤新生血管[21], 常用标记物有F82RA、CD34、CD31等. 本研究以CD34为标记对象, 以小鼠C26肠癌细胞接种Babl/c F1代小鼠建立的小鼠肠癌异位移植瘤模型为研究对象, 分别从抑制率、MVD计数和组织坏死情况3个方面考察TanⅡA对肠癌小鼠肿瘤的抑制作用及肿瘤血管新生的影响. 结果显示, TanⅡA具有较好的抑制肠癌生长和抗肿瘤血管新生的作用, 随给药剂量的加大抑制作用更明显, 其抗肿瘤作用与下调肿瘤组织VEGF表达有关, 且抑制作用具有剂量依从性.
自1971年美国波士顿儿童医院的Folkman教授首先提出血管新生学说以来, 血管新生与肿瘤的关系越来越受到科研人员的重视. 研究证实, 微血管生成在大肠癌的发生、发展、侵袭、转移中发挥重要作用, 已经成为大肠癌向其他脏器转移扩散和手术后复发的关键因素.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室
血管生成、侵袭、转移是肿瘤治疗的最大的障碍, 如何在肿瘤形成过程中抑制肿瘤血管新生, 阻断原发瘤向其他器官的侵袭转移是防治大肠癌的一个重要手段, 也是目前肿瘤综合治疗亟待解决的问题.
20世纪70年代, Folkman教授就提出, 肿瘤生长与血管生成有重要的联系: 一方面, 肿瘤生长需要血管为之提供养料并运走代谢废料. 另一方面, 肿瘤组织内血管密度的增加、肿瘤边缘部位的瘤细胞与血管接触增多, 也进一步促使肿瘤细胞随细胞数量的增多而脱落进入血管的机会增加.
传统中医药以其独特的理论体系与悠久的临床实践为基础, 结合现代的研究方法与手段在肿瘤治疗中发挥着重要的作用, 特别是对于早期肿瘤的预防有着很好的疗效. 本研究将具有活血化瘀、凉血消痈的中药丹参提取物丹参酮ⅡA作用于小鼠肠癌模型, 观察丹参酮ⅡA对肠癌血管新生的抑制作用.
本研究提示, TanⅡA具有较好的抑制肠癌生长和抗肿瘤血管新生的作用, 随给药剂量的加大抑制作用更明显, 其抗肿瘤作用与下调肿瘤组织VEGF表达有关, 且抑制作用具有剂量依从性. 对于明确中药的抗肿瘤活性有着重要的推动作用.
本研究具有较好的科学意义, 方法先进, 具有一定的创新性以及参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 3. | 郑 燕彬, 王 国红, 洪 琛, 梁 盈, 李 祺福. 丹参酮ⅡA对人成骨肉瘤MG-63细胞增殖的抑制作用. 厦门大学学报(自然科学版). 2006;45:1-5. |
| 4. | 徐 俊丽, 和 水祥, 陈 静宏, 符 寒, 赵 刚, 王 艳丽, 任 牡丹. 丹参酮ⅡA对肝癌SMMC-7721细胞COX-2表达的影响. 世界华人消化杂志. 2006;14:1352-1356. [DOI] |
| 6. | 陈 坚, 钟 良, 钱 立平, 蒋 蔚茹, 黄 剑平, 邱 冬妮. 丹参酮ⅡA磺酸钠对MKN-45胃癌裸鼠移植瘤增殖及血管生成的影响. 世界华人消化杂志. 2008;16:2507-2511. [DOI] |
| 8. | 王 炎, 李 琦, 冯 年平, 范 忠泽, 南 艺蕾, 鲍 文磊, 隋 华, 饶 娅敏, 刘 宁宁, 李 先茜. 丹参酮ⅡA纳米粒治疗小鼠肝癌及其对Cyclin E表达的影响. 上海中医药杂志. 2007;41:74-77. |
| 9. | Iwanuma Y, Chen FA, Egilmez NK, Takita H, Bankert RB. Antitumor immune response of human peripheral blood lymphocytes coengrafted with tumor into severe combined immunodeficient mice. Cancer Res. 1997;57:2937-2942. [PubMed] |
| 10. | Kato H, Yoshikawa M, Miyazaki T, Nakajima M, Fukai Y, Masuda N, Fukuchi M, Manda R, Tsukada K, Kuwano H. Expression of vascular endothelial growth factor (VEGF) and its receptors (Flt-1 and Flk-1) in esophageal squamous cell carcinoma. Anticancer Res. 2002;22:3977-3984. [PubMed] |
| 11. | Banerji S, Ni J, Wang SX, Clasper S, Su J, Tammi R, Jones M, Jackson DG. LYVE-1, a new homologue of the CD44 glycoprotein, is a lymph-specific receptor for hyaluronan. J Cell Biol. 1999;144:789-801. [PubMed] [DOI] |
| 12. | Folkman J. Tumor angiogenesis. Adv Cancer Res. 1974;19:331-358. [PubMed] [DOI] |
| 13. | Folkman J. Seminars in Medicine of the Beth Israel Hospital, Boston. Clinical applications of research on angiogenesis. N Engl J Med. 1995;333:1757-1763. [PubMed] [DOI] |
| 14. | Bikfalvi A, Bicknell R. Recent advances in angiogenesis, anti-angiogenesis and vascular targeting. Trends Pharmacol Sci. 2002;23:576-582. [PubMed] [DOI] |
| 15. | Hedley BD, Winquist E, Chambers AF. Therapeutic targets for antimetastatic therapy. Expert Opin Ther Targets. 2004;8:527-536. [PubMed] [DOI] |
| 16. | 李 玉明, 詹 文华, 韩 方海, 何 裕隆, 彭 俊生, 董 文广, 汪 建平, 蔡 世荣, 马 晋平, 赵 刚. 大肠癌同时性肝转移外科治疗的预后因素分析. 中华普通外科杂志. 2005;20:625-628. |
| 18. | Breiteneder-Geleff S, Matsui K, Soleiman A, Meraner P, Poczewski H, Kalt R, Schaffner G, Kerjaschki D. Podoplanin, novel 43-kd membrane protein of glomerular epithelial cells, is down-regulated in puromycin nephrosis. Am J Pathol. 1997;151:1141-1152. [PubMed] [DOI] |
| 19. | Mouta Carreira C, Nasser SM, di Tomaso E, Padera TP, Boucher Y, Tomarev SI, Jain RK. LYVE-1 is not restricted to the lymph vessels: expression in normal liver blood sinusoids and down-regulation in human liver cancer and cirrhosis. Cancer Res. 2001;61:8079-8084. [PubMed] [DOI] |
| 20. | Giatromanolaki A, Koukourakis MI, Stathopoulos GP, Kapsoritakis A, Paspatis G, Kakolyris S, Sivridis E, Georgoulias V, Harris AL, Gatter KC. Angiogenic interactions of vascular endothelial growth factor, of thymidine phosphorylase, and of p53 protein expression in locally advanced gastric cancer. Oncol Res. 2000;12:33-41. [PubMed] [DOI] |
| 21. | Kato H, Yoshikawa M, Miyazaki T, Nakajima M, Fukai Y, Masuda N, Fukuchi M, Manda R, Tsukada K, Kuwano H. Expression of vascular endothelial growth factor (VEGF) and its receptors (Flt-1 and Flk-1) in esophageal squamous cell carcinoma. Anticancer Res. 2002;22:3977-3984. [PubMed] [DOI] |