修回日期: 2009-09-14
接受日期: 2009-09-21
在线出版日期: 2009-10-28
目的: 探讨白头翁醇提物对三硝基苯磺酸诱导大鼠结肠炎肠黏膜上皮细胞紧密连接蛋白的调控, 进一步阐明白头翁醇提物对大鼠实验性结肠炎的肠黏膜屏障的保护作用.
方法: 建立TNBS诱导大鼠结肠炎模型. 实验分为正常组、模型组、白头翁醇提物治疗组和双歧杆菌嗜酸乳杆菌肠球菌三联活菌(金双歧)组. 进行疾病活动指数(DAI)和组织学损伤评分, 用ELISA法测定结肠组织TNF-α、IL-10和血清内毒素, 采用免疫组织学染色检测紧密连接(tight junction, TJ)相关蛋白occludin的分布.
结果: TNBS诱导大鼠结肠炎后, DAI和组织学损伤评分增高, 结肠组织TNF-α水平升高、IL-10水平降低和血清内毒素水平升高, 而经白头翁醇提物和双歧杆菌嗜酸乳杆菌肠球菌三联活菌处理后, DAI和组织学损伤评分有明显下降(6.50±1.27, 5.90±1.67vs 9.20±1.75; 5.00±1.05, 4.80±1.25 vs 7.10±0.99, 均P<0.05), 结肠组织TNF-α水平降低(521.24±109.37 ng/L, 503.98±126.63 ng/L vs 657.54±149.60 ng/L, 均P<0.05)、血清内毒素水平降低(0.148±0.093 EU/mL, 0.153±0.106 EU/mLvs 0.213±0.023 EU/mL, 均P<0.05)和IL-10水平升高(92.19±30.09 ng/L, 95.57±27.71 ng/L vs 42.92±23.74 ng/L, 均P<0.05); TNBS诱导大鼠结肠炎后, TJ结构遭到破坏, TJ相关蛋白的表达减少, 而白头翁醇提物和双歧杆菌嗜酸乳杆菌肠球菌三联活菌(金双歧)处理后可使TNBS引起的TJ结构受损减轻, 相关蛋白的表达增多.
结论: 白头翁醇提物可以对TNBS诱导大鼠结肠炎肠黏膜屏障具有明显的保护作用, 其机制可能是通过调节肠道微生态、上调肠上皮细胞紧密连接蛋白occludin的表达、降低结肠组织TNF-α含量、提高IL-10水平, 从而抑制内毒素通过紧密连接进入体循环.
引文著录: 张文远, 姜伟炜. 白头翁醇提物对大鼠结肠炎肠黏膜上皮细胞紧密连接蛋白的保护作用. 世界华人消化杂志 2009; 17(30): 3134-3139
Revised: September 14, 2009
Accepted: September 21, 2009
Published online: October 28, 2009
AIM: To investigate the protective effects of radix pulsatillae alcohol extract on intestinal epithelial tight junctions in rats with trinitrobenzene sulfonic acid (TNBS)-induced colitis and explore potential mechanisms involved.
METHODS: Acute colitis was induced in rats using TNBS enema. Thirty-eight rats were randomized into four groups: normal control group (n = 8), model control group (n = 10), radix pulsatillae alcohol extract treatment group (n = 10) and golden bifid (live combined bifidobacterium, lactobacillus and streptococcus thermophilus tablets) treatment group (n = 10). Diarrhea and bloody stool were observed. Colonic damage was evaluated histologically. The levels of tumor necrosis factor-α (TNF-α) and interleukin-10 (IL-10) in colonic tissue and endotoxin in blood were determined by enzyme-linked immunosorbent assay (ELISA). The expression of occludin in intestinal mucosal epithelial cells was detected by immunohistochemistry.
RESULTS: After acute colitis was induced in rats using TNBS enema, disease activity index and colonic damage score increased. However, treatment with radix pulsatillae alcohol extract and golden bifid significantly decreased disease activity index (6.50 ± 1.27 and 5.90 ± 1.67 vs 9.20 ± 1.75, respectively; both P < 0.05), colonic damage score (5.00 ± 1.05 and 4.80 ± 1.25 vs 7.10 ± 0.99, respectively; both P < 0.05), colonic TNF-α level (521.24 ± 109.37 ng/L and 503.98 ± 126.63 ng/L vs657.54 ± 149.60 ng/L, respectively; both P < 0.05) and blood endotoxin level (0.148 ± 0.093 EU/mL and 0.153 ± 0.106 EU/mL vs 0.213 ± 0.023 EU/mL, respectively; both P < 0.05), and remarkably increased colonic IL-10 content (92.19 ± 30.09 ng/L and 95.57 ± 27.71 ng/L vs 42.92 ± 23.74 ng/L, respectively; both P < 0.05) in rats with TNBS-induced colitis. In the model control group, the structure of tight junctions was destroyed and the expression of occludin was downregulated in colonic mucosal epithelium. However, treatment with radix pulsatillae alcohol extract and golden bifid could reduce the damage to tight junctions and upregulate the expression of occludin in rats with TNBS-induced colitis.
CONCLUSION: Radix pulsatillae alcohol extract can exert a protective effect against TNBS-induced intestinal mucosal barrier dysfunction possibly via mechanisms that are associated with adjusting intestinal microecology, upregulating occludin expression, reducing colonic TNF-α level and blood endotoxin level, and increasing colonic IL-10 production.
- Citation: Zhang WY, Jiang WW. Protective effects of radix pulsatillae alcohol extract on intestinal epithelial tight junctions in rats with trinitrobenzene sulfonic acid-induced colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3134-3139
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3134.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3134
炎症性肠病(inflammatory bowel disease, IBD)的病因和发病机制至今尚不完全清楚. 近年来, 肠道黏膜屏障在IBD中的作用越来越受到重视, 肠上皮细胞紧密连接蛋白是肠上皮细胞间的最重要的连接蛋白, 对肠黏膜屏障起着至关重要的作用, 参与了IBD的发病过程[1-2], 中药是否可以通过调整肠道上皮紧密连接到达治疗IBD, 目前国内外未见这方面的报道. 白头翁醇提物对TNBS诱导大鼠结肠炎模型的肠黏膜屏障肠上皮细胞紧密连接蛋白occludin是否具有保护作用, 为此我们做了研究.
SD大鼠, 雌雄兼用, 购自四川省医学科学院实验动物研究所, 许可证号: SCXK(111) 2004-16. 白头翁批号080721, 产地: 四川省成都中医药大学惠康药业; 三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)为Sigma公司产品, 试剂浓度1.14 kg/L; 双歧杆菌嗜酸乳杆菌肠球菌三联活菌(金双歧), 每片0.5 g, 内蒙古双奇药业股份有限公司, 批准文号: 国药准字S19980004; 一抗occludin兔多克隆抗体, Sigma公司; TNF-α、IL-10 ELISA法检测试剂盒, 欣博盛生物科技有限公司; 血清内毒素鲎试剂盒, 欣博盛生物科技有限公司.
1.2.1 白头翁醇提物的制备: 按王先芳 et al[3]方法提取并稍加改进. 称取白头翁饮片250 g, 加950 mL/L乙醇1500 mL, 在80℃恒温水箱中加热回流2.5 h, 共3次, 用100目尼龙网过滤, 将滤液减压蒸馏回收乙醇, 然后烘干成褐色粉末备用.
1.2.2 造模: SD大鼠共38只, 雌雄兼用, 适应性饲养3 d后随机数字表法分成正常对照组(n = 8)、TNBS模型组(n = 10)、白头翁醇提物治疗组(n = 10)和金双歧治疗组(n = 10). 参照Morris et al[4], 王皓 et al[5]报道的TNBS法造模: 所有大鼠术前禁食24 h, 自由饮水, 氯胺酮注射液(50 mg/kg)腹腔注射麻醉大鼠后, 模型组、白头翁治疗组及金双歧治疗组将含TNBS(100 mg/kg)的500 mL/L乙醇溶液0.85 mL用硅胶管缓慢注入距肛门约8 cm处的肠腔内, 正常对照组在相同的麻醉条件下予以等量生理盐水注入, 注入后立即提起大鼠尾部倒置2-3 min, 以防药液倒流. 造模后第1-7天, 白头翁治疗组大鼠将制备的白头翁醇提物按2 g/kg用蒸馏水配置成1 mL灌肠; 金双歧治疗组大鼠用已制备的金双歧粉末水溶液(2 Co/只)1 mL灌肠, 模型组和正常对照组以等量生理盐水灌肠, 每天1次. 各组大鼠饲以相同的平衡颗粒样食物, 并自由饮水, 观察大鼠精神状态、进食、活动、大便和体质量等情况. 于造模后第8天取眼眶静脉血测定血清内毒素, 并断颈处死所有大鼠, 游离并取下整段结肠, 沿肠系膜纵向剪开, 清洁肠内污物后观察结肠标本充血水肿情况、溃疡大小、分布、有无活动性出血等情况; 取1 cm病变组织, 行HE染色及免疫组织化学法检测occludin的表达; 余下标本液氮冻存, 用于ELISA法测定结肠组织中TNF-α、IL-10的表达.
1.2.3 occludin免疫组织化学染色: 采用EnVision法, 石蜡切片常规脱蜡至水, H2O2孵育, 胃蛋白酶37℃ 30 min抗原修复, 兔抗occludin抗体(1:200)4℃过夜后, 滴加适当二抗工作液室温孵育30 min, DAB显色, 镜下控制显色时间, 苏木素复燃, 常规脱水透明, 树胶分片. 在低倍镜下观察occludin在肠上皮细胞的分布特征, 每张切片选取5处occludin染色集中区域, 在高倍镜下(×200)计数, 求得平均值.
1.2.4 血清内毒素测定: 取SD大鼠眼眶静脉血, 低温6000 r/min离心5 min, 取0.1 mL上清液, 以ELISA法测定其内毒素含量, 具体步骤按试剂盒说明书操作进行.
1.2.5 结肠组织TNF-α、IL-10测定: 切取部分结肠组织, 电子天平称质量, 在液氮条件下将大鼠结肠研磨碎, 冰PBS 0.4 mL制成结肠组织溶液, 4℃ 3500 r/min离心10 min, 取0.1 mL上清液, 使用相应的试剂盒以ELISA法测定其TNF-α、IL-1含量.
统计学处理 均数以mean±SD表示, 各组间比较用F检验, P<0.05时差异有显著性.
DAI及组织学损伤评分与正常组比较差异均有显著性意义(P<0.05), 白头翁治疗组与金双歧治疗组比较差异无显著意义(P>0.05, 表1).
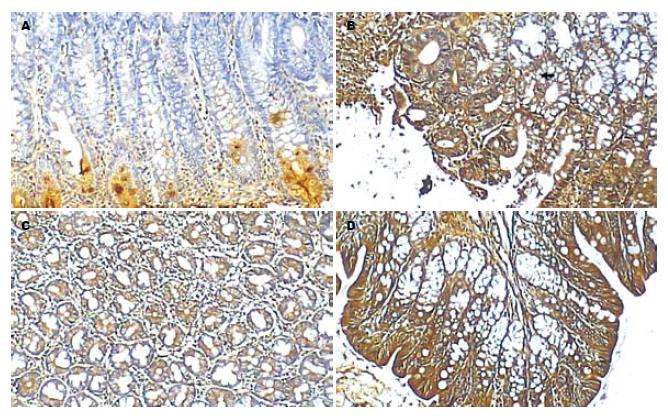
正常组occludin连续分布于肠黏膜上皮细胞的边缘, 主要定位于细胞膜和细胞质, 为棕黄色染色颗粒, 其计数结果为81.62±11.39. 模型组occludin染色散乱, 其计数结果为25.78±10.28. 白头翁治疗组染色明显恢复, 其计数结果为50.68±17.02. 金双歧治疗组染色有所恢复, 其计数结果为52.43±16.15. 模型组与金双歧治疗组相比有差异(P<0.05). 模型组结肠组织occludin阳性染色强度及范围较弱, 白头翁治疗组和金双歧治疗组occludin较模型组强, 正常组occludin的定位与前面2组没有明显区别, 但其棕褐色染色强度及范围很强(图1).
TNF-α、IL-10和血清内毒素水平在模型组、白头翁治疗组和金双歧治疗组、正常对照组组间比较, 差异均有显著性意义(均P<0.05), 白头翁治疗组与金双歧治疗组之间差异无显著性意义(P>0.05, 表2).
肠黏膜屏障主要由肠黏膜基底膜、上皮细胞层及其表面的黏液层所构成[6], 在维护肠功能中扮演着重要角色. 肠上皮细胞是肠黏膜屏障的主要组织结构基础, 细胞间的连接复合体参与维持上皮细胞的完整性, 其中紧密连接是细胞间最重要的连接方式, 在细胞侧空间形成调控屏障, 调控水、离子和大分子物质的跨膜转运, 防止大分子物质经肠腔漏到周围组织中, 维护肠黏膜屏障功能和肠黏膜通透性[7-10]. 紧密连接不仅参与生理过程调节, 还参与炎症的调节过程, 当肠上皮细胞紧密连接一旦发生变异、减少或缺失, 则细胞间隙通透性增加, 细菌、内毒素及大分子物质就可通过紧密连接进入体循环[11-12]. 上皮紧密连接主要由occludin蛋白、claudin蛋白、连接黏附分子等紧密连接蛋白构成选择性屏障功能, 紧密连接蛋白在上皮细胞分化中起重要作用[7,13-14]. 其中, occludin蛋白是紧密连接中最重要的结构蛋白, 不仅能通过外环以拉链式结合进而产生严密的细胞旁封闭, 还能与不同的分子结合, 参与紧密连接形成的信号调节. 肠上皮occludin水平的检测不仅可以反映肠道菌群紊乱情况下致病菌对肠道屏障的破坏情况, 也反映了肠道屏障的恢复程度, 因此在国际上已得到认可[15-18].
目前普遍认为, IBD发病时肠黏膜屏障功能异常, 一些损伤性因素如炎症细胞因子能破坏肠黏膜屏障, 肠腔内抗原物质向肠黏膜固有层移位, 进一步激活固有层免疫细胞, 导致肠黏膜异常炎症反应[19-21]. 各种炎症因子及内毒素等可通过影响各种紧密连接蛋白的表达, 使连接复合体遭到破坏, 肠黏膜通透性增加[22]. Willemsen et al[23]研究IFN-γ对闭合蛋白claudin-2表达的影响和肠上皮屏障功能之间的关系时发现IFN-γ通过不同作用机制影响到闭合蛋白claudin-2的表达, 破坏肠上皮屏障, 进而导致IBD等的发生. 还有报道, TNF-α通过紧密连接破坏上皮屏障功能[24], IBD肠黏膜高表达的其他细胞因子如IL-15、IL-2、IL-1β等也能影响上皮细胞紧密连接蛋白表达及分布[25-26].
我们的实验结果表明, 白头翁醇提物对TNBS诱导的大鼠结肠炎有明显的抑制作用. 用白头翁提物治疗TNBS诱导大鼠结肠炎, 结肠黏膜糜烂、溃疡显著减轻, 炎性细胞浸润明显减少, DAI和黏膜损伤积分明显下降, 与金双歧治疗组无差异显著性, 与模型组比较差异有显著性, 提示白头翁醇提物对结肠炎具有一定的治疗作用. 本实验还表明, 模型组紧密连接蛋白occludin表达低于正常组的表达, 而通过白头翁醇提物治疗后, 结肠组织occludin表达明显高于模型组, 但低于正常组的表达, 从而表明紧密连接蛋白occludin参与了IBD的发病机制, 可能是当IBD发病时, 肠黏膜屏障功能异常, 导致肠上皮细胞紧密连接发生减少、缺失, 使得肠上皮细胞紧密连接occludin蛋白的表达下降, 肠道通透性增加. 调节肠道微生态能够增强肠上皮细胞的紧密连接, 降低肠道通透性, 增强肠道黏膜屏障功能. Madsen et al[27]研究发现, 口服VSL 3能降低肠黏膜分泌TNF-α和IFN-γ, 恢复IL-10-KO小鼠损伤的结肠屏障功能和上皮细胞的完整性. Resta-Lenert et al[28]也在对肠侵袭性大肠杆菌(enteroinvasive E.coli, EIEC)对人肠上皮细胞系(HT29/cl 19A和Caco-2)感染的研究中发现, 嗜热链球菌(Streptococcus thermophilus, ST)和嗜酸乳杆菌(Lactobacillus acidophilus, LA)能维持或增强细胞骨架蛋白和紧密连接蛋白的磷酸化, 因此增强了肠上皮细胞间的紧密连接, 从而阻止了EIEC对肠上皮细胞的侵袭. 另外还有一些研究发现[29-31]增加肠道特殊菌群, 通过改变肠道微生态, 不仅能够增加细胞因子IFN-γ的水平, 而且增强肠道上皮细胞的功能及活性. 我们的实验结果显示: 在通过金双歧治疗后, 结肠组织occludin表达明显高于模型组, 但低于正常组的表达, 白头翁治疗组与金双歧治疗组之间差异无显著意义, 从而表明白头翁治疗组具有与金双歧调节肠道微生态的类似作用, 通过维持肠道菌群的平衡, 维护肠道微生态屏障, 抑制细菌移位, 从而使肠道上皮紧密连接蛋白occludin的表达增多, 保护肠上皮的机械屏障, 达到治疗结肠炎的目的. 我们的结果还显示, 模型组中与正常组比较, 血清内毒素水平升高, 炎症因子TNF-α水平升高, IL-10水平降低; 经白头翁和金双歧治疗后, 血清内毒素水平明显下降, TNF-α水平显著降低, IL-10水平明显升高, 白头翁治疗组与金双歧治疗组之间差异无显著意义, 表明IBD发病时, 肠腔内抗原物质向肠黏膜固有层以为并激活其免疫细胞, 产生大量炎症细胞因子, 血清内毒素水平升高, 炎症分子进一步损伤肠道黏膜屏障功能, 使炎症进一步扩大; 给予白头翁后, 通过纠正肠道微生态后, 使致炎细胞因子减少, 抗炎细胞因子增多, 血清内毒素也降低.
总之, 白头翁醇提物对TNBS诱导大鼠结肠炎肠上皮细胞紧密连接蛋白的调控, 起到对肠黏膜屏障的保护作用; 其作用机制可能是通过保护肠道微生物屏障, 纠正肠道菌群紊乱调节肠道微生态, 降低IBD中致炎细胞因子TNF-α、升高抗炎细胞因子IL-10, 减少炎症分子对肠道黏膜屏障的损伤, 有效的调节肠黏膜屏障功能, 从而使紧密连接蛋白occludin的表达增多, 减少肠上皮细胞受损伤的机会, 保护肠道黏膜上皮细胞之间的紧密连接蛋白, 降低肠道通透性, 从而抑制内毒素通过紧密连接进入体循环, 达到治疗IBD的目的.
紧密连接是构成肠黏膜屏障的主要结构基础, 当结肠炎发生时可由紧密连接的破坏引起肠黏膜屏障的损伤, 在治疗方面, 是否可通过保护紧密连接从而达到保护肠黏膜屏障的作用. 本文就这一问题研究了白头翁醇提物对TNBS诱导大鼠结肠炎模型的肠黏膜屏障肠上皮细胞紧密连接蛋白occludin是否具有保护作用.
房静远, 教授, 上海交通大学医学院附属仁济医院, 上海市消化疾病研究所
炎症性肠病发生时肠黏膜屏障损伤已证实, 但其发生机制是目前研究的热点, 而且治疗通过调节肠道微生态方面的机制尚不清楚.
目前有关中药治疗炎症性肠病是肠上皮细胞紧密连接蛋白occludin表达的文章尚未见报道. 本研究证实了白头翁醇提物对大鼠结肠炎黏膜上皮细胞紧密连接蛋白具有保护作用. 为中医治疗炎症性肠病提供新的思路.
本研究发现, 白头翁醇提物治疗后的大鼠结肠炎肠道屏障上皮细胞紧密连接蛋白occludin表达升高, 为白头翁醇提物试用于临床试验做了充分的准备.
本研究设计合理, 有一定创新性, 可读性较好.
编辑: 李军亮 电编:何基才
| 1. | Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease. Nat Rev Immunol. 2003;3:521-533. [PubMed] [DOI] |
| 2. | Amasheh S, Meiri N, Gitter AH, Schöneberg T, Mankertz J, Schulzke JD, Fromm M. Claudin-2 expression induces cation-selective channels in tight junctions of epithelial cells. J Cell Sci. 2002;115:4969-4976. [PubMed] [DOI] |
| 4. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 6. | Arrieta MC, Bistritz L, Meddings JB. Alterations in intestinal permeability. Gut. 2006;55:1512-1520. [PubMed] [DOI] |
| 7. | Schneeberger EE, Lynch RD. The tight junction: a multifunctional complex. Am J Physiol Cell Physiol. 2004;286:C1213-C1228. [PubMed] [DOI] |
| 8. | González-Mariscal L, Betanzos A, Nava P, Jaramillo BE. Tight junction proteins. Prog Biophys Mol Biol. 2003;81:1-44. [PubMed] [DOI] |
| 9. | Ivanov AI, Nusrat A, Parkos CA. Endocytosis of the apical junctional complex: mechanisms and possible roles in regulation of epithelial barriers. Bioessays. 2005;27:356-365. [PubMed] [DOI] |
| 10. | Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1901-1909. [PubMed] [DOI] |
| 12. | Heller F, Florian P, Bojarski C, Richter J, Christ M, Hillenbrand B, Mankertz J, Gitter AH, Bürgel N, Fromm M. Interleukin-13 is the key effector Th2 cytokine in ulcerative colitis that affects epithelial tight junctions, apoptosis, and cell restitution. Gastroenterology. 2005;129:550-564. [PubMed] |
| 14. | Usami Y, Chiba H, Nakayama F, Ueda J, Matsuda Y, Sawada N, Komori T, Ito A, Yokozaki H. Reduced expression of claudin-7 correlates with invasion and metastasis in squamous cell carcinoma of the esophagus. Hum Pathol. 2006;37:569-577. [PubMed] [DOI] |
| 16. | Chen YH, Lu Q, Goodenough DA, Jeansonne B. Nonreceptor tyrosine kinase c-Yes interacts with occludin during tight junction formation in canine kidney epithelial cells. Mol Biol Cell. 2002;13:1227-1237. [PubMed] [DOI] |
| 17. | Nusrat A, Chen JA, Foley CS, Liang TW, Tom J, Cromwell M, Quan C, Mrsny RJ. The coiled-coil domain of occludin can act to organize structural and functional elements of the epithelial tight junction. J Biol Chem. 2000;275:29816-29822. [PubMed] [DOI] |
| 18. | Tilsala-Timisjärvi A, Alatossava T. Characterization of the 16S-23S and 23S-5S rRNA intergenic spacer regions of dairy propionibacteria and their identification with species-specific primers by PCR. Int J Food Microbiol. 2001;68:45-52. [PubMed] [DOI] |
| 19. | Lewis K, Caldwell J, Phan V, Prescott D, Nazli A, Wang A, Soderhölm JD, Perdue MH, Sherman PM, McKay DM. Decreased epithelial barrier function evoked by exposure to metabolic stress and nonpathogenic E. coli is enhanced by TNF-alpha. Am J Physiol Gastrointest Liver Physiol. 2008;294:G669-G678. [PubMed] [DOI] |
| 20. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 21. | Bruewer M, Luegering A, Kucharzik T, Parkos CA, Madara JL, Hopkins AM, Nusrat A. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. J Immunol. 2003;171:6164-6172. [PubMed] |
| 23. | Willemsen LE, Hoetjes JP, van Deventer SJ, van Tol EA. Abrogation of IFN-gamma mediated epithelial barrier disruption by serine protease inhibition. Clin Exp Immunol. 2005;142:275-284. [PubMed] [DOI] |
| 24. | Poritz LS, Garver KI, Tilberg AF, Koltun WA. Tumor necrosis factor alpha disrupts tight junction assembly. J Surg Res. 2004;116:14-18. [PubMed] [DOI] |
| 25. | Nishiyama R, Sakaguchi T, Kinugasa T, Gu X, MacDermott RP, Podolsky DK, Reinecker HC. Interleukin-2 receptor beta subunit-dependent and -independent regulation of intestinal epithelial tight junctions. J Biol Chem. 2001;276:35571-35580. [PubMed] [DOI] |
| 26. | Al-Sadi RM, Ma TY. IL-1beta causes an increase in intestinal epithelial tight junction permeability. J Immunol. 2007;178:4641-4649. [PubMed] |
| 27. | Madsen K, Cornish A, Soper P, McKaigney C, Jijon H, Yachimec C, Doyle J, Jewell L, De Simone C. Probiotic bacteria enhance murine and human intestinal epithelial barrier function. Gastroenterology. 2001;121:580-591. [PubMed] [DOI] |
| 28. | Resta-Lenert S, Barrett KE. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC). Gut. 2003;52:988-997. [PubMed] [DOI] |
| 29. | Broekaert IJ, Walker WA. Probiotics as flourishing benefactors for the human body. Gastroenterol Nurs. 2006;29:26-34. [PubMed] [DOI] |
| 30. | Dogi CA, Galdeano CM, Perdigón G. Gut immune stimulation by non pathogenic Gram(+) and Gram(-) bacteria. Comparison with a probiotic strain. Cytokine. 2008;41:223-231. [PubMed] [DOI] |
| 31. | Scharek L, Guth J, Reiter K, Weyrauch KD, Taras D, Schwerk P, Schierack P, Schmidt MF, Wieler LH, Tedin K. Influence of a probiotic Enterococcus faecium strain on development of the immune system of sows and piglets. Vet Immunol Immunopathol. 2005;105:151-161. [PubMed] [DOI] |