修回日期: 2008-12-22
接受日期: 2008-12-29
在线出版日期: 2009-01-28
目的: 观察内源性胱硫醚-γ-裂解酶(cystathionine gamma-lyase, CSE)/硫化氢(hydrogen sulfide, H2S)(CSE/H2S)体系在不同时期肝硬化大鼠模型上的变化, 以探讨内源性H2S在肝硬化发生发展过程中的作用.
方法: 制备四氯化碳诱导的肝硬化大鼠模型, 在第15、30、52天取大鼠门静脉血检测H2S浓度, 用免疫组化和RT-PCR方法观察肝组织CSE mRNA的表达.
结果: 肝硬化早、中、晚期大鼠门静脉血中H2S的含量均显著低于正常对照组(F = 126.208, P = 0.000), 且H2S浓度随着肝脏病变的加重而逐渐降低(r = -0.777, P<0.05). 肝硬化不同时期肝组织CSE蛋白的灰阶值均低于正常对照组(F = 156.04, P = 0.000), 表明CSE表达增强. 各组CSE mRNA的表达均分别显著高于正常对照组(F = 23.927, P = 0.000), 且随着肝脏病变的加重表达逐渐增加.
结论: H2S体系在肝硬化发生发展中起着保持血管舒张状态的重要作用.
引文著录: 张宁, 郑勇, 王于理, 李睿, 孙侃, 常向云, 陈卫刚, 赵瑾, 李洪安. 内源性硫化氢在不同时期大鼠肝硬化中的作用. 世界华人消化杂志 2009; 17(3): 307-311
Revised: December 22, 2008
Accepted: December 29, 2008
Published online: January 28, 2009
AIM: To observe the changes of cystathionine gamma-lyase/hydrogen sulfide (CSE/H2S) on the liver of rats with hepatic cirrhosis at different stages, so as to investigate the role H2S plays in development of hepatic cirrhosis.
METHODS: H2S density in portal vein blood of model rats with carbon tetrachloride-induced hepatic cirrhosis was measured on the 15th day, the 30th day and the 52th day, respectively. The expression of CSE and CSEmRNA in liver was measured using immunohistochemisty and RT-PCR.
RESULTS: The blood H2S density in rats with hepatic cirrhosis was significantly lower in early-stage, the mid-stage, and the later stage group than in control group (F = 126.208, P = 0.000). H2S density was on a decline with disease development (r = -0.777, P < 0.05). The Grey of liver CSE with hepatic cirrhosis at different stages were lower than the control (F = 156.04, P = 0.000). The expression of protein CSE was enhanced. The expression of CSEmRNA of liver with hepatic cirrhosis at different stages were all higher than control (F = 23.927, P = 0.000), and the expression increased gradually with the disease development.
CONCLUSION: H2S system has an important effect which maintains the state of diastolic blood vessels on the occurrence and development in rats with hepatic cirrhosis.
- Citation: Zhang N, Zheng Y, Wang YL, Li R, Sun K, Chang XY, Chen WG, Zhao J, Li HA. Role of endogenous hydrogen sulfide in rats with hepatic cirrhosis at different stages. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 307-311
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/307.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.307
肝硬化(liver cirrhosis)是一种常见的慢性肝病, 可由多种原因引起. 肝细胞弥漫性变性坏死, 继而出现纤维组织增生和肝细胞结节状再生, 这三种改变反复交错进行, 结果肝小叶结构和血液循环途径逐渐被改建, 使肝变形、变硬而形成肝硬化. 本病早期可无明显症状, 后期则出现一系列不同程度的门静脉高压和肝功能障碍. 近年实验研究表明, 机体内源性气体信号分子一氧化氮(NO)及一氧化碳(CO)是重要的扩血管物质, 对保持门脉血管的松弛, 尤其是保持肝窦的舒张状态起着及其重要的作用[1]. NO、CO在肝硬化的肝脏血流动力学及门脉高压的发生发展中起着重要作用[2].
内源性硫化氢(hydrogen sulfide, H2S)是继NO、CO之后发现的又一新的内源性气体信号分子, 由L-半胱氨酸在胱硫醚-β-合成酶(cystathionine beta-synthase, CBS)、胱硫醚-γ-裂解酶(cystathionine gamma-lyase, CSE)作用下生成, 受体内代谢途径的调控[3], 而H2S对CBS和CSE的活性又具有负反馈调节作用. H2S具有与NO、CO相似的病理生理学效应[4], 比如抑制平滑肌细胞增殖, 舒张血管等. 近些年, 国内外研究均发现, 内源性H2S在肺动脉高压、高血压、感染性休克等心血管系统的发病中起到重要的作用, 但在肝硬化的研究才刚刚起步. 本研究复制不同时期肝硬化大鼠模型, 分期观察肝硬化大鼠门静脉血中硫化氢的变化, 并检测肝组织中CSE的表达, 以探讨H2S在肝硬化发病过程中的作用.
实验大鼠91只由新疆自治区疾控中心动物研究所提供, 均为同期出生、纯种系、4-5 wk龄的健康♀SD大鼠(SPF), 体质量约180-220 g. NaHS为美国Sigma公司产品, 醋酸锌、对氨基二甲基苯胺盐酸盐、三氯化铁、三氯醋酸均为国产分析纯; 鼠抗兔CSE多克隆抗体及SABC试剂盒购自武汉博士德生物工程有限公司; DAB显色剂为DAKO公司产品; RNA提取试剂TRIzol为美国Invitrogen公司产品; M-MLV逆转录酶、Tap酶购自美国Fermentas公司; PCR引物及内参照GAPDH引物均由上海生物工程公司合成, 序列如下: CSE-F 5'-AGAATTCTCT CGGGGCAGTT-3', CSE-R 5'-ACTACGTTTGGCGAGCTCAT-3'; GAPDH-F 5'-ACCACAGTCCATGCCATCAC-3', GAPDH-R 5'-TCCACCACCCTGTTGC TGTA-3'.
1.2.1 肝硬化动物模型: 采用CCl4复合因素法建立肝硬化大鼠模型. 给实验大鼠(81只)sc 400 mL/L CCl4棉籽油溶液, 首次注射5 mL/kg体质量, 后每隔4天注射一次, 每次3 mL/kg体质量, 共注射11次, 200 mL/L乙醇溶液作为唯一饮用液体, 给予高脂高胆固醇饲料. 随机抽取大鼠(10只)为正常对照组, 同期sc生理盐水, 剂量同实验组, 采用标准饲养方法.根据预实验中肝硬化形成经验, 实验组大鼠分3批, 每批27只, 分别在实验的第15、30、52天将大鼠用乙醚麻醉, 剖腹抽取门静脉血, 分离获得血浆备检.然后处死大鼠, 取大鼠左叶肝组织做HE染色, 显微镜下观察, 依据严家春 et al[5]的方法病理学确定肝硬化分期.
1.2.2 门静脉血浆H2S的测定: 采用去蛋白的方法见文献[6]. 首先在试管中加入0.5 mL 10 g/L醋酸锌, 然后加入0.1 mL血浆标本, 振荡混匀, 再依次加入0.5 mL 20 mmol/L对氨基二甲基苯胺盐酸盐和0.5 mL 30 mmol/L三氯醋酸, 再加入2.5 mL蒸馏水补足体积至5 mL, 充分混匀. 6000 r/min离心5 min, 吸出上清液, 用分光光度计在670 nm处检测吸光度. 根据H2S标准曲线计算上清液中H2S的含量.
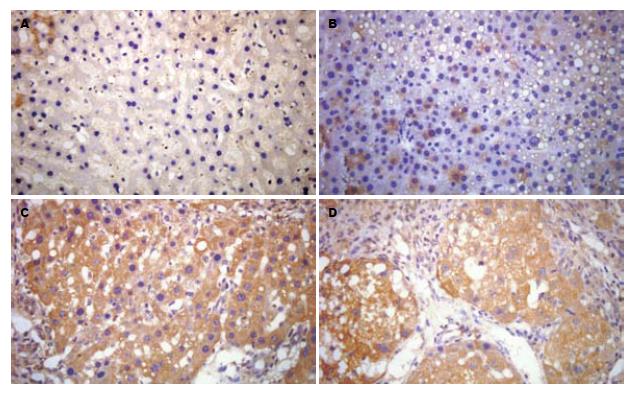
1.2.3 免疫组织化学染色方法检测肝组织CSE表达: 石蜡切片常规脱蜡至水; 30 mL/L H2O2室温孵育5-10 min, 以消除内源性过氧化物酶的活性, PBS浸洗5 min; 热修复抗原20 min; PBS浸洗5 min, 滴加适当比例稀释的一抗(1:100), 4℃过夜. PBS浸洗5 min, 滴加生物素化山羊抗小鼠IgG工作液, 37℃孵育30 min; PBS浸洗5 min, 滴加试剂SABC, 37℃孵育30 min, PBS浸洗5 min. DAB显色, 镜下观察控制时间. 蒸馏水充分冲洗, 苏木素轻度复染, 脱水, 透明, 中性树胶封片. 阳性部位在胞质处显棕黄色. 每例切片在低倍镜下将视野按十字形分为上、下、左、右、中五个区域, 然后在400倍镜视野下应用Olmpus-DP70彩色病理图文分析系统, 测定免疫反应阳性产物灰阶值, 灰阶值越低说明表达越强, 反映细胞内蛋白表达量越多, 以灰阶值来进行量化后的统计学分析.
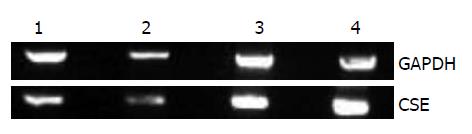
1.2.4 RT-PCR检测肝组织内CSE mRNA的表达: 使用TRIzol法提取肝脏总RNA, 应用10 g/L的琼脂糖凝胶电泳检查RNA的完整性, 并用紫外分光光度仪行RNA浓度及纯度测定, A260/A280均在1.8-2.0之间说明RNA纯度较高. 应用M-MLV逆转录酶, 及Oligod(T)15、dNTPs等将总RNA逆转录为cDNA, 然后进行PCR扩增.CSE的PCR反应条件: 94℃ 2 min; 94℃ 20 s, 54℃ 45 s, 72℃ 45 s, 共35个循环; 72℃延伸7 min. 反应结束后, PCR产物用20 g/L的琼脂糖凝胶进行电泳分析, 采用Quantity one凝胶成像分析系统计算各个条带的光密度值, 以CSE/GAPDH比值表示CSE mRNA的相对表达水平.
统计学处理 采用SPSS13.0软件进行统计学分析, 所有数据以mean±SD表示, 采用方差分析进行组间比较, 并使用独立样本t检验与相关性分析, P<0.05表示差异有统计学意义.
根据肝细胞变性与增生情况, 汇管区与小叶间纤维组织增生程度以及假小叶形成等指标将大鼠分别确定为肝硬化早期组21只、中期组22只、晚期组20只、正常对照组10只.
将数据进行方差分析, 结果显示肝硬化早、中、晚期组大鼠的门静脉血H2S浓度均低于正常对照组, 并且随着肝硬化进程的发展, H2S浓度逐渐降低(F = 126.208, P = 0.000). 同时行相关分析示门静脉血H2S浓度的降低与肝硬化程度且呈负相关(r = -0.777, P = 0.031), 进一步行组间两两比较(表1).
肝硬化早、中、晚期组大鼠肝组织CSE蛋白的表达见图1, 灰阶值见表2, 从中可以看出肝硬化各组大鼠肝组织中CSE的灰阶值都显著低于对照组大鼠, 显示CSE的表达增高(F = 156.04, P = 0.000). 行相关分析示, CSE蛋白的表达与肝硬化病变程度呈负相关(r = -0.527, P = 0.000).
肝硬化是一种由多种致病因素长期或反复作用于肝脏引起的肝实质弥漫性损害, 使肝细胞变性、坏死、再生, 导致肝小叶和肝血管结构的紊乱, 最终形成假小叶及血管重建, 进一步引起一系列肝功能损害和门静脉高压的临床表现. 肝硬化门静脉高压主要与门静脉系统血流受阻以及内脏血流高动力循环有关, 二者均与肝硬化时血管活性物质的代谢紊乱密切相关. 内源性H2S是继NO和CO之后发现的可以导致血管舒张的第3种气体信号分子[6], 在体内具有重要的生理意义. H2S作为气体小分子可以自由通过细胞膜, 作用不依赖于相应的质膜受体, 可在CBS、CSE催化下内源性产生, H2S对CBS和CSE的活性具有负反馈调节作用. H2S在体内可能有两种存在形式, 一种以气体形式, 另一种可能以硫氢化钠形式存在. NaHS在体内可解离成钠离子和硫氢根离子, 后者与体内可结合生成H2S, H2S和硫氢化钠形成动态的平衡, 据报道, 1/3 H2S在体内以气体分子存在, 2/3以NaHS的形式存在, 这样, 既保证了H2S在体内的稳定, 而且还不改变内环境的pH值水平[7]. 肝脏是体内H2S生成的主要部位, 对维持循环血液中H2S的浓度起到重要作用, 而H2S在调节正常及肝硬化的微循环中的作用也已被证实[8]. H2S的作用机制目前尚未完全阐明, 但已有的研究结果表明, 在不需第2信息分子参与的条件下, H2S很可能是通过开放的KATP通道而发挥作用[9]. 在血管平滑肌细胞中, H2S兴奋KATP通道, 增加KATP通道的电流, 使细胞膜出现超极化并使电压门控式L-型钙离子通道失活, 进而减少胞内游离钙离子的浓度, 从而导致血管和平滑肌的松弛和扩张.
我们的研究显示: 在大鼠肝硬化早、中、晚期, 门静脉血中H2S的含量与对照组相比均明显下降, 且随着肝硬化进程的发展, H2S浓度逐渐降低. 肝硬化早、中、晚期组CSE蛋白的表达以及CSE mRNA的表达与对照组相比均明显增加, 且随着肝硬化进程的发展, 表达逐渐增强. 目前在肝脏研究中, 关于H2S的表达并不一致. 如于宏伟 et al[10]在结扎大鼠肝动脉诱发肝细胞病变的实验中发现, 随着肝动脉结扎时间延长, 血清中H2S浓度随结扎时间延长呈现曲线变化, 即肝组织在缺血缺氧初期H2S浓度降低, 当缺血缺氧加重时H2S增加, 而肝细胞出现核溶解或固缩, 肝细胞失去调节和被调节能力时H2S浓度又再次降低. 然而对于H2S在肺纤维化发病机制的研究中, CSE/H2S也显示了不同的变化: 造模第7天CSE酶活性及血浆H2S含量一致降低, 第28天时, CSE酶活性恢复至正常, 而H2S含量明显高于对照组, 但是CSE mRNA的含量均是明显升高[11].
我们推测: 在肝硬化时, 肝血管重构使肝组织缺血缺氧, 而内源性H2S作为气体信号分子首先被消耗, 为维持内环境的稳定, 降低门静脉高压, 减轻血管阻力, 肝组织需要产生更多的内源性H2S, 可能CSE mRNA的持续高表达在翻译水平促进了CSE蛋白的合成, 进而补充机体对于H2S的需要, 这种CSE的增加可能是机体的一种自我保护机制.有研究显示, H2S通过下调凋亡抑制因子Bcl-2及NF-κB水平, 激活效应因子Caspase-3而促进血管平滑肌细胞凋亡[12-13]; 也通过ERK/MAPK通路抑制细胞核增生抗原的表达, 增强P21Cip/WAK-1而发挥抑制血管内皮细胞肿胀和平滑肌细胞增殖的作用[14-18]; 通过抑制肺小型、中型肌性动脉中Ⅰ、Ⅲ型前胶原mRNA和TIMP-1 mRNA表达来降低Ⅰ、Ⅲ型胶原蛋白的含量[19]. 同时, H2S也抑制了弹性蛋白的合成[20].凡此种种, H2S抑制了血管重建, 保护了血管. 至于CSE mRNA如何被调控, 以及CSE/H2S与其他气体信号分子之间有无相互调节作用, 均有待于进一步的研究证实.
总之, 内源性CSE/H2S体系参与了大鼠肝硬化的发病过程, 并表现出了对于肝脏血流的重要调节作用, H2S在肝脏及其他脏器呈现出来的功能可能会在治疗各种机体功能紊乱方面开启一条光明的道路.
近年实验研究表明, 机体内源性气体信号分子一氧化氮(NO)及一氧化碳(CO)是重要的扩血管物质, 对保持门脉血管的松弛, 尤其是保持肝窦的舒张状态起着及其重要的作用. NO、CO在肝硬化的肝脏血流动力学及门脉高压的发生发展中起着重要作用.内源性硫化氢(H2S)是继NO、CO之后发现的又一新的内源性气体信号分子. 近些年, 国内外研究均发现, 内源性H2S在肺动脉高压、高血压、感染性休克等心血管系统的发病中起到重要的作用, 但在肝硬化的研究才刚刚起步.
陈耀凯, 副教授, 中国人民解放军第三军医大学西南医院全军感染病研究所.
H2S的作用机制目前尚未完全阐明, 但已有的研究结果表明, 在不需第2信息分子参与的条件下, H2S很可能是通过开放的KATP通道而发挥作用.
于宏伟 et al在结扎大鼠肝动脉诱发肝细胞病变的实验中发现, 随着肝动脉结扎时间延长, 血清中H2S浓度随结扎时间延长呈现曲线变化, 即肝组织在缺血缺氧初期H2S浓度降低, 当缺血缺氧加重时H2S增加, 而肝细胞出现核溶解或固缩, 肝细胞失去调节和被调节能力时H2S浓度又再次降低.
本文研究思想与国内外相关研究设计基本相似, 但研究结果也有些新发现, 文中表格、图片较为清晰, 行文较为流畅, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | La Villa G, Gentilini P. Hemodynamic alterations in liver cirrhosis. Mol Aspects Med. 2008;29:112-118. [PubMed] [DOI] |
| 3. | Geng B, Yang J, Qi Y, Zhao J, Pang Y, Du J, Tang C. H2S generated by heart in rat and its effects on cardiac function. Biochem Biophys Res Commun. 2004;313:362-368. [PubMed] [DOI] |
| 4. | Hosoki R, Matsuki N, Kimura H. The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide. Biochem Biophys Res Commun. 1997;237:527-531. [PubMed] [DOI] |
| 6. | Ali MY, Ping CY, Mok YY, Ling L, Whiteman M, Bhatia M, Moore PK. Regulation of vascular nitric oxide in vitro and in vivo; a new role for endogenous hydrogen sulphide? Br J Pharmacol. 2006;149:625-634. [PubMed] [DOI] |
| 7. | Chunyu Z, Junbao D, Dingfang B, Hui Y, Xiuying T, Chaoshu T. The regulatory effect of hydrogen sulfide on hypoxic pulmonary hypertension in rats. Biochem Biophys Res Commun. 2003;302:810-816. [PubMed] [DOI] |
| 8. | Fiorucci S, Antonelli E, Mencarelli A, Orlandi S, Renga B, Rizzo G, Distrutti E, Shah V, Morelli A. The third gas: H2S regulates perfusion pressure in both the isolated and perfused normal rat liver and in cirrhosis. Hepatology. 2005;42:539-548. [PubMed] [DOI] |
| 9. | Dawe GS, Han SP, Bian JS, Moore PK. Hydrogen sulphide in the hypothalamus causes an ATP-sensitive K+ channel- dependent decrease in blood pressure in freely moving rats. Neuroscience. 2008;152:169-177. [PubMed] [DOI] |
| 11. | 李 虹, 刘 新民, 耿 彬, 潘 春水, 齐 永芬, 吴 胜英, 唐 朝枢. 新型气体信号分子硫化氢在大鼠肺纤维化发病中的作用. 北京大学学报(医学版). 2006;38:140-145. |
| 12. | Sodha NR, Clements RT, Feng J, Liu Y, Bianchi C, Horvath EM, Szabo C, Sellke FW. The effects of therapeutic sulfide on myocardial apoptosis in response to ischemia-reperfusion injury. Eur J Cardiothorac Surg. 2008;33:906-913. [PubMed] [DOI] |
| 13. | Oh GS, Pae HO, Lee BS, Kim BN, Kim JM, Kim HR, Jeon SB, Jeon WK, Chae HJ, Chung HT. Hydrogen sulfide inhibits nitric oxide production and nuclear factor-kappaB via heme oxygenase-1 expression in RAW264.7 macrophages stimulated with lipopolysaccharide. Free Radic Biol Med. 2006;41:106-119. [PubMed] [DOI] |
| 14. | de Lima VM, Oliveira CP, Alves VA, Chammas MC, Oliveira EP, Stefano JT, de Mello ES, Cerri GG, Carrilho FJ, Caldwell SH. A rodent model of NASH with cirrhosis, oval cell proliferation and hepatocellular carcinoma. J Hepatol. 2008;49:1055-1061. [PubMed] [DOI] |
| 15. | Li X, Du J, Jin H, Tang X, Bu D, Tang C. The regulatory effect of endogenous hydrogen sulfide on pulmonary vascular structure and gasotransmitters in rats with high pulmonary blood flow. Life Sci. 2007;81:841-849. [PubMed] [DOI] |
| 16. | 李 晓惠, 杜 军保, 唐 朝枢. 硫化氢供体对高肺血流性肺动脉高压大鼠肺血管结构及血管活性多肽的影响. 中国医学科学 院学报. 2006;28:159-163. |
| 17. | Li XH, Du JB, Bu DF, Tang XY, Tang CS. Sodium hydrosulfide alleviated pulmonary vascular structural remodeling induced by high pulmonary blood flow in rats. Acta Pharmacol Sin. 2006;27:971-980. [PubMed] [DOI] |
| 18. | Jeong SO, Pae HO, Oh GS, Jeong GS, Lee BS, Lee S, Kim du Y, Rhew HY, Lee KM, Chung HT. Hydrogen sulfide potentiates interleukin-1beta-induced nitric oxide production via enhancement of extracellular signal-regulated kinase activation in rat vascular smooth muscle cells. Biochem Biophys Res Commun. 2006;345:938-944. [PubMed] [DOI] |