修回日期: 2008-12-24
接受日期: 2008-12-29
在线出版日期: 2009-01-28
目的: 通过降低小鼠免疫力并给小鼠胃肠道造成溃疡, 建立小鼠胃白念珠菌感染动物模型.
方法: 昆明小鼠110只随机分成3组. 对照组Ⅰ给予浓度5.5×1012白念珠菌菌悬液0.5 mL灌胃; 对照组Ⅱ腹腔内注射浓度40 g/L的环磷酰胺溶液0.02 mL/g体质量, 并用3 g/L冰醋酸溶液0.5 mL灌胃; 模型组用对照Ⅱ组方法灌胃, 2 h后给予浓度5.5×1012白念珠菌菌悬液0.5 mL灌胃. 于第10天取小鼠胃组织行真菌镜检、组织病理检查, 同时取所有真菌镜检阳性胃组织经念珠菌显色培养基培养, 观察菌落.
结果: 模型组小鼠胃组织内发现念珠菌孢子、芽生孢子、假菌丝及大量成团菌丝. 模型组与对照组Ⅰ真菌镜检及组织病理HE染色阳性率比较有显著性差异(χ2 = 40.763, 40.526, 均P<0.01), 与对照组Ⅱ比较也有显著性差异(χ2 = 58.964, 44.074, 均P<0.01).
结论: 通过降低小鼠免疫力并造成胃溃疡, 应用白念珠菌感染可以建立小鼠胃白念珠菌感染动物模型.
引文著录: 马耀辉, 王刚生, 邓洁华, 张晓光, 王爱学, 四荣联. 小鼠胃白念珠菌感染动物模型的建立. 世界华人消化杂志 2009; 17(3): 303-306
Revised: December 24, 2008
Accepted: December 29, 2008
Published online: January 28, 2009
AIM: To establish a mouse model of stomach with candida albicans infection on hypoimmunity and ulceric mouse.
METHODS: Kunming mice were randomly divided into 3 groups. Mice in control group were given 0.5 mL 5.5 × 1012 candida albicans suspension by gastric intubation; mice in control group Ⅱ were given cyclophosphamide (40 g/L) through intraperitoneal injection by 0.02 mL per gram (weight) and lavaged with 0.5 mL 3 g/L glacial acetic acid; mice in model group were first lavaged in the same way as control group Ⅱ, then 2 hours later, were given intragastric administration with 0.5 mL 5.5 × 1012 candida albicans suspension. On day 10, microscopic and histopathological examination were performed on stomach tissue of mice. Positive fungi under microscopy were all cultivated with CHROMagar, and observed.
RESULTS: Monilia sporus, blastospore, pseudohypha and a bulk of hypha in stomach were observed in model group. The differences in positive rates upon microscopic and histopathological examination between model group and control group Ⅰ were significant (χ2 = 40.763, 40.526, both P < 0.01). There was also significant difference in positive rate between model group and control group Ⅱ (χ2 = 58.964, 44.074, both P < 0.01).
CONCLUSION: By inhibiting immunity and inducing peptic ulcer, we can establish a mouse model of stomach with candida albicans infection.
- Citation: Ma YH, Wang GS, Deng JH, Zhang XG, Wang AX, Si RL. Establishment of a mouse model of stomach infection with candida albicans. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 303-306
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/303.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.303
念珠菌广泛分布于自然界, 寄生于正常人皮肤、口腔、肠道、阴道等处, 以消化系带菌率最高, 约占正常人的30%-50%, 在人体免疫力低下时, 正常寄生状态的念珠菌大量繁殖并侵入黏膜引起消化系念珠菌病, 偶自黏膜侵入血液引起系统播散性念珠菌病. 白念珠菌由寄生菌转变为致病菌, 并引发黏膜念珠菌病, 导致系统播散, 其发病原因考虑与机体免疫力低下, 黏膜受损、白念珠菌定殖数量等有关. 制作小鼠胃肠道白念珠菌感染动物模型, 可对以上分析提供客观依据并有助于新药研发等.
普通级昆明小鼠110只, 体质量约25 g, 雌雄各半, 购买于河北医科大学实验动物中心. 白念珠菌来自河北医科大学第二医院皮肤性病科真菌室.
1.2.1 白念珠菌菌悬液制备: 取白念珠菌, 经念珠菌显色培养基培养鉴定的白念珠菌大量接种于沙氏培养基上(葡萄糖40 g/L, 蛋白胨10 g/L, 琼脂15 g/L加蒸馏水), 在37℃恒温培养箱中培养72 h. 将培养基表面的白念珠菌菌落溶于少量9 g/L氯化钠溶液中并逐渐稀释成浓度为5.5×1012的白念珠菌菌悬液(血细胞计数板计数).
1.2.2 动物分组及处理: 实验小鼠随机分为三组, 对照组Ⅰ30只, 对照组Ⅱ40只, 模型组40只. 对照组Ⅰ用浓度5.5×1012白念珠菌菌悬液0.5 mL给小鼠ig, 然后在标准饲养条件下喂养. 对照组Ⅱ用40 g/L环磷酰胺溶液0.02 mL/g体质量, 给小鼠腹腔内注射, 并立即用3 g/L冰醋酸溶液0.5 mL以对照组Ⅰ方法ig, 然后在标准饲养条件下喂养. 模型组以对照组Ⅱ方法ig 2 h后给予浓度5.5×1012白念珠菌菌悬液0.5 mL ig, 然后在标准饲养条件下喂养.
1.2.3 小鼠胃溃疡观察及胃取材: 2 h随机取对照组Ⅱ小鼠3只, 断颈处死, 观察胃外观, 沿胃大弯剪开胃壁清理食糜观察胃黏膜, 并分别剪取溃疡处约0.5 cm×0.5 cm胃壁, 无菌生理盐水冲洗后, 置于40 g/L甲醛溶液中固定.
1.2.4 实验小鼠胃外观、真菌镜检及胃取材: 第10天取对照组Ⅰ、对照组Ⅱ、模型组存活小鼠分别为30、34、36只, 按照以上方法解剖小鼠, 观察胃外观、黏膜. 并取约大米粒大小胃组织置于含1滴100 g/L KHO溶液的载玻片上, 放入60℃电热恒温水温箱中溶解10 min, 取出盖上盖玻片轻压并用吸水纸吸干. 置于普通光学显微镜下寻找孢子及菌丝. 同时分别剪取约0.5 cm×0.5 cm胃壁, 无菌生理盐水冲洗后, 置于40 g/L甲醛溶液中固定. 同时取所有真菌镜检阳性胃组织经念珠菌显色培养基30℃培养48 h, 观察菌落. 所有胃组织取材行HE染色.
统计学处理 胃组织真菌镜检或HE染色中发现菌丝为阳性, 分别记录对照组Ⅰ、对照组Ⅱ、模型组真菌镜检、组织HE染色阳性数, 用模型组与对照组Ⅰ、对照组Ⅱ的阳性率进行比较, 用SPSS10.0统计软件进行χ2检验, α = 0.01.
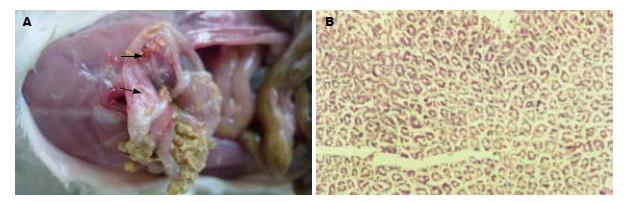
对照组Ⅱ灌胃后2 h小鼠胃体血管扩张、充血, 剖开胃壁见胃内大量褐黄色食糜, 清理食糜后见胃黏膜溃疡水肿(图1A). 胃组织HE染色见胃黏膜细胞内、细胞间水肿, 部份组织缺损形成溃疡(图1B).
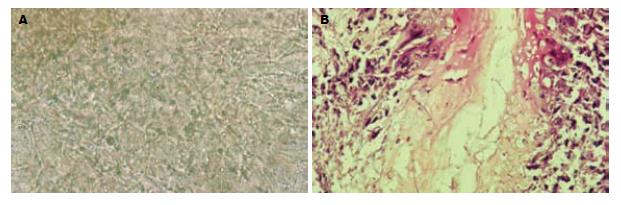
对照组Ⅰ胃外观及黏膜与正常小鼠无明显差异, 对照组Ⅱ及模型组均见胃体缩小, 塌陷, 光泽差, 胃黏膜见水肿, 溃疡. 真菌镜检, 对照组Ⅰ有4只小鼠胃组织真菌镜检见少量菌丝; 对照组Ⅱ小鼠胃组织真菌镜检均未见孢子及菌丝; 模型组有33只小鼠胃组织真菌镜检发现念珠菌孢子、芽生孢子、假菌丝及大量成团菌丝(图2A).
对照组Ⅰ、Ⅱ小鼠胃组织病理HE染色均未见孢子及菌丝. 模型组真菌镜检阴性的3只小鼠胃的组织病理HE染色未见孢子及菌丝, 胃组织真菌镜检阳性小鼠中, 有28只在胃黏膜表面脓疡中及黏膜浅层见大量芽生孢子、假菌丝及菌丝(图2B). 对照组Ⅱ及模型组组织病理HE染色均发现胃黏膜组织水肿, 部份结构紊乱及坏死.
念珠菌广泛分布于自然界. 正常人体的皮肤、口腔、肠道、肛门及阴道等处均可分离出本菌, 其中以消化系(口腔和肠道)带菌率最高, 约占正常人的30%-50%, 这是念珠菌病内源获得性感染的根源[1]. 在所有念珠菌感染中以白念珠菌最多[2]. 当机体抵抗力或免疫力降低时, 尤其细胞免疫功能降低时, 引起真菌感染[3]. 高凡 et al[4]给正常小鼠腹腔内注射50 mg/kg的环磷酸胺(CP)隔日连续腹腔注射4-5次, 小鼠自然杀伤细胞细胞活性出现显著下降, 血清白介素2及肿瘤坏死因子均出现显著下降, 抗体生成细胞功能显著下降.
黏附于胃肠道的白念珠菌孢子在一定条件下转变为致病状态的菌丝, 从而引起胃肠道白念珠菌感染, 也会受到胃肠道局部抵抗力的干扰. 消化系黏膜组织不仅是一种机械性的屏障, 同时也因其所特有的免疫系统保护机体, 起着防御疾病的重要作用. 本研究对照组Ⅰ小鼠在自然状态下给予白念珠菌灌胃, 在第10天有4只小鼠胃组织真菌镜检见少量白念珠菌菌丝, 但未发现胃组织学上的损害, 说明小鼠胃肠道的天然屏障、非特异性及特异性防御系统对白念珠菌的生长繁殖有抵御作用. 之前多项研究发现小鼠胃肠道白念珠菌定植, 但未发现其菌丝相, 也证明了这一点[5-14].
黏膜局部受损, 创面水肿, 黏膜屏障完整性受损有利于真菌生长[15]. 本研究用3 g/L冰醋酸溶液0.5 mL给小鼠灌胃, 2 h后发现胃黏膜溃疡水肿, 胃组织HE染色见胃黏膜细胞内、细胞间水肿, 部分组织缺损形成溃疡. 在这种条件下灌胃白念珠菌菌悬液, 白念珠菌侵入黏膜的机会大大提高, 本研究的结果在模型组小鼠胃组织见大量芽生孢子、假菌丝及菌丝验证了以上情况.
本研究模型组小鼠33只胃组织真菌镜检发现念珠菌孢子、芽生孢子、假菌丝及大量成团菌丝, 28只胃组织HE染色可见胃黏膜表面脓疡中及黏膜浅层见大量芽生孢子、假菌丝及菌丝. 模型组与对照组Ⅰ、对照组Ⅱ的真菌镜检、组织HE染色阳性率比较有显著统计学差异, 说明模型组比对照组Ⅰ、对照组Ⅱ小鼠胃白念珠菌感染率明显增高, 可用于建立小鼠胃白念珠菌感染动物模型.
本研究提示免疫力低下及消化系溃疡给定植于胃的白念珠菌以大量繁殖和侵入胃黏膜创造了条件, 使白念珠菌由孢子相转变为菌丝相, 引起胃黏膜念珠菌感染. 证明了免疫力低下及胃溃疡为胃白念珠菌感染的易感因素, 为临床上免疫力低下患者及胃溃疡患者易出现消化系念珠菌病提供了实验室依据, 为进一步研究其感染方式、致病机制、药物筛选及开发奠定基础, 为临床治疗提供依据. 本研究中对照组Ⅱ及模型组持续胃溃疡、水肿外观无明显差异, 因此白念珠菌在胃损害中有无加重损害程度及对胃损害的的愈合有无不良影响, 有待进一步证实.
念珠菌感染在院内感染真菌中占首位, 肠道念珠菌感染仅次于下呼吸道占第2位, 以白念珠菌最多. 由于临床上高效安全的抗真菌药物数目较少, 因此念珠菌感染常呈致死病因.
阴赪宏, 研究员, 首都医科大学附属北京友谊医院感染暨急救医学科; 吴建国, 教授, 武汉大学生命科学学院病毒学国家重点实验室.
念珠菌耐药日渐增多, 抗真菌药物数目较少, 且无良好的动物模型.
黄雪峰 et al通过喂食白念珠菌发现白念珠菌在小鼠肠道定植, 邸琳 et al用冰醋酸致大鼠结肠形成溃疡.
CCP是我国学者自行合成的超分子铂类配合物, 已经申请专利. CCP是一种笼状结构, 以卡铂作为主体分子, 以柠檬酸作为客体分子, 即以柠檬酸的3个-COOH中的2个结合成分子内氢键, 生成超分子的CCP, 以第三个COOH增加分子的极性, 进而增加可溶性. 同时, 这种结构起到保护中心铂原子的作用. 整个分子将增加稳定性、溶解性、极性、特异性和增加对肿瘤的毒性. 本文是关于CCP的体外和动物体内的药效学研究.
建立小鼠肠道白念珠菌感染动物模型, 为进一步研究其感染方式、致病机制、药物筛选及开发奠定基础, 为临床治疗提供依据.
本研究首次建立了免疫抑制小鼠胃白念珠菌感染的动物模型, 具有一定的科学价值.
编辑: 李军亮 电编:何基才
| 1. | 张 学军, 刘 维达, 何 春涤. 现代皮肤病学基础. 第1版. 北京: 人民卫生出版社 2001; 946. |
| 2. | 杨 国亮, 王 侠生. 现代皮肤病学. 第1版. 上海: 上海医科大学出版社 1996; 193. |
| 3. | 陈 世平. 真菌感染学. 第1版. 沈阳: 辽宁科学技术出版社 2000; 4. |
| 5. | 陈 必兴. 胃肠道白念珠菌顽固性感染的小鼠-抗真菌治疗的模型. 国外医药·抗生素分册. 1983;4:158-159. |
| 6. | Field LH, Pope LM, Cole GT, Guentzel MN, Berry LJ. Persistence and spread of Candida albicans after intragastric inoculation of infant mice. Infect Immun. 1981;31:783-791. [PubMed] |
| 10. | Algin C, Sahin A, Kiraz N, Sahintürk V, Ihtiyar E. Effectiveness of bombesin and Saccharomyces boulardii against the translocation of Candida albicans in the digestive tract in immunosuppressed rats. Surg Today. 2005;35:869-873. [PubMed] [DOI] |
| 11. | Sandovsky-Losica H, Barr-Nea L, Segal E. Fatal systemic candidiasis of gastrointestinal origin: an experimental model in mice compromised by anti-cancer treatment. J Med Vet Mycol. 1992;30:219-231. [PubMed] [DOI] |
| 13. | Mellado E, Cuenca-Estrella M, Regadera J, González M, Díaz-Guerra TM, Rodríguez-Tudela JL. Sustained gastrointestinal colonization and systemic dissemination by Candida albicans, Candida tropicalis and Candida parapsilosis in adult mice. Diagn Microbiol Infect Dis. 2000;38:21-28. [PubMed] [DOI] |