修回日期: 2008-12-22
接受日期: 2008-12-29
在线出版日期: 2009-01-28
目的: 测定大鼠摄食量的变化来鉴定aFGF分子中具有调节摄食行为的活性部位, 并进一步经皮下注射有活性的片段, 观察对大鼠夜间摄食的影响, 以此确定该活性片段外周给药的有效性.
方法: 将设计好的七种aFGF分子片段aFGF-(1-15), [D-Trp6]-aFGF-(1-15), [desaminoPhe1.D-Trp6]-aFGF-(1-15), [desaminoPhe1.Lys(ε-myristyl)16]-aFGF-(1-16), [Lys(ε-myristyl)16]-aFGF-(1-16), [D-Trp6.Lys(ε-myristyl)16]-aFGF-(1-16)及[Ala16] aFGF-(1-29), 在无麻醉下于18:30-19:00从第三脑室留置的不锈钢导管微量注射, 然后在19:00, 22:00及07:00的时间点测定饲料箱内粉末饲料, 分别计算3 h(19:00-22:00)及12 h(19:00-7:00)的摄食量. 然后将发现具有生物活性的aFGF-(1-15)及[Ala16]aFGF-(1-29)两个片段经皮下注射给药, 测定夜间摄食量.
结果: aFGF-(1-15)以每只大鼠200 ng脑室内给与后对摄食没有影响, 以每只大鼠400 ng脑室内给与后减少了大鼠的夜间摄食量(3 h: 3.0±0.2 vs 2.1±0.2; 12 h: 18.5±0.5 vs 16.1±0.5, P<0.01); [Ala16]aFGF-(1-29)经脑室内投与, 无论是在每只大鼠200 ng(3 h: 4.9±0.2 vs 3.4±0.2; 12 h: 19.3±1.2 vs 17.3±1.1, P<0.01); 还是每只大鼠400 ng给药均减少了大鼠的夜间摄食量(3 h: 3.6±0.1 vs 1.6±0.2; 12 h: 19.9±0.8 vs 16.4±1.6, P<0.01), 并且与aFGF-(1-15)相比, [Ala16] aFGF-(1-29)抑制摄食作用更明显; 其余五种aFGF片段脑室内注射无论每只大鼠200 ng还是在每只大鼠400 ng, 对大鼠夜间摄食均没有影响. aFGF-(1-15)和[Ala16]aFGF-(1-29)以80、100、300 μg/kg大鼠皮下注射, 其中仅[Ala16]aFGF-(1-29), 300 μg/kg皮下注射减少了大鼠的夜间摄食量(3 h: 3.9±0.2 vs 2.1±0.3; 12 h: 19.8±0.5 vs 11.2±0.8, P<0.01), 其余种类和剂量对大鼠夜间摄食均没有影响.
结论: aFGF氨基酸序列的N末端及用丙氨酸代替aFGF氨基末端中半胱氨酸残基对摄食调节发挥重要作用. 而第6位甘氨酸被右旋-色氨酸替代, 第1位苯丙氨酸去氨基, 第16位半胱氨酸被赖氨酸(ε-十四烷基)所代替, 均没有摄食调节活性. 部分活性片段外周给药同样可以发挥其生物活性.
引文著录: 赵艳军, 李学良, 林琳, 粟生修司, 大村裕. 酸性成纤维细胞生长因子片段脑室内及皮下注射对大鼠夜间摄食的影响. 世界华人消化杂志 2009; 17(3): 259-264
Revised: December 22, 2008
Accepted: December 29, 2008
Published online: January 28, 2009
AIM: To investigate the active region of aFGF responsible for food intake by calculating nocturnal food consumption to examine the efficacy of peripheral administration of the active fragments.
METHODS: For intracerebroventricular infusion, a guide cannula made of stainless steel tubing was fixed into the third cerebral ventricle one week before the experiments. Under no anesthesia seven synthesized aFGF fragments aFGF-(1-15), [D-Trp6]-aFGF-(1-15), [desaminoPhe1.D-Trp6]-aFGF-(1-15), [desaminoPhe1.Lys (ε-myristyl)16]-aFGF-(1-16), [Lys (ε-myristyl)16]-aFGF-(1-16), [D-Trp6.Lys (ε-myristyl)16]-aFGF-(1-16) and [Ala16] aFGF-(1-29) were injected into the third ventricle of rats during the period from 18:30 to 19:00. Powdered food in the animal food boxes were weighed at 19:00, 22:00, and 7:00 for calculating food consumption by rats in 3 hours and 12 hours. Then the two active aFGF fragments aFGF-(1-15) and [Ala16] aFGF-(1-29) were injected into the subcutaneous tissue of rats during the period from 18:30 to 19:00, to calculate nocturnal food consumption.
RESULTS: For intracerebroventricular infusion, aFGF-(1-15) (per rat 200 ng) had no effect on the feeding, while aFGF-(1-15) (per rat 400 ng) suppressed the food intake (3 h: 3.0 ± 0.2 vs 2.1 ± 0.2; 12 h: 18.5 ± 0.5 vs 16.1 ± 0.5, both P < 0.01). As for [Ala16] aFGF-(1-29), not only per rat 200 ng (3 h: 4.9 ± 0.2 vs 3.4 ± 0.2; 12 h: 19.3 ± 1.2 vs 17.3 ± 1.1, both P < 0.01) but also per rat 400 ng (3 h: 3.6 ± 0.1 vs 1.6 ± 0.2; 12 h: 19.9 ± 0.8 vs 16.4 ± 1.6, both P < 0.01) suppressed the food intake. Other five aFGF fragments had no effect on the feeding in the dose of per rat 200 ng and per rat 400 ng. For hypodermic injection, [Ala16] aFGF-(1-29) (300 mg/kg) suppressed the food intake (3 h: 3.9 ± 0.2 vs 2.1 ± 0.3; 12 h: 19.8 ± 0.5 vs 11.2 ± 0.8, both P < 0.01), while others had no effect.
CONCLUSION: These findings suggest the amino-terminal portion of aFGF is active in food intake suppression. The replacement of cysteine residue by alanine is important in some amino-terminal aFGF fragments. Other aFGF fragments, in which glycine at position 6 was replaced with D-tryptophane, phenylalanine at position 1 with desaminoPhe, and cysteine at position 16 with Lys (ε-myristyl) has no effect on nocturnal feeding in rats. Peripheral administration of one fragment is also effective on nocturnal feeding in rats.
- Citation: Zhao YJ, Li XL, Lin L, Aou S, Oomura Y. Effects of acidic fibroblast growth factor fragments on nocturnal feeding in rats by intracerebroventricular and hypodermic injection. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 259-264
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/259.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.259
成纤维细胞生长因子(fibroblast growth factor, FGF)于1974年在牛脑和脑垂体中被发现, FGF家族的每个成员都有一个140个氨基酸的中轴, 该中轴在不同的成员间有高度的同源性, 中轴折叠成12条逆向平行的β链, 他们又形成圆柱状的结构, 两端由更多变的氨基末端和羧基末端封闭. 在这些FGF家族当中被研究最多的要数有140个和146个氨基酸序列组成的aFGF及bFGF, 分子质量约为16 000 Da, 两者具有55%的同源性[1]. 已经清楚aFGF及bFGF与各种由中胚层发生来的细胞的分化和增殖密切相关, 他们在中枢神经系统的作用非常引人注目, 但是关于其有效的生物活性部位的不明点还很多. 关于aFGF, 最初由Thomas于1984年从牛脑中分离纯化得到, 研究已经发现, 其N末端的1-15片段与全分子同样对海马神经元的长期增强(long-term potentiation, LTP)具有促进作用[2], 该发现反映了aFGF的氨基酸序列与其特异的生物活性相关, 但其详细的构造-活性相互关系还不清楚. 本研究是在大鼠的第三脑室投与七种aFGF片段, 以此鉴定aFGF具有调节摄食行为的活性部位, 并进一步经sc有活性的片段, 通过观察对大鼠夜间摄食的影响来研究该活性片段外周给药的有效性, 为开发该物质的临床应用奠定基础.
♂Wistar大鼠162只, 体质量250-300 g, 在明暗各12 h(07:00-19:00)周期, 22±2℃的室温环境, 1个笼中饲育1只. 饲料(研成碎沫状)和水18:30-19:00时间以外自由给予. 大鼠及饲料购自河北医科大学实验动物中心. 大鼠脑立体定位仪为淮北正华生物仪器设备有限公司产品, 微量注射器为上海光正医疗仪器有限公司产品, aFGF片段由日本大阪肽研究所协助合成.
1.2.1 第三脑室置管术: 在戊巴比妥钠麻醉下(40 mg/kg, 腹腔内注射), 将大鼠固定在脑立体定位仪上, 根据大鼠脑图[3], 从十字缝后方0.2 mm, 深7.5-8.0 mm, 在正中位颅盖骨上打开直径约2 mm的洞, 以不锈钢导管插入(长18.0 mm, 外径0.64 mm, 内经0.39 mm)留置; 用带聚乙烯帽的不锈钢制导丝(长17 mm, 直径0.33 mm), 插入已经置入的不锈钢导管内用以封闭导管. 另外用两个不锈钢制的螺钉固定在置入导管两侧的头骨上, 用牙科黏合剂与导管固定. 手术后动物自由恢复1 wk.
1.2.2 药物: 为了寻找生物活性最强的N端的aFGF片段, 本实验设计了以下七种aFGF片段: (1)aFGF-(1-15): aFGF的1-15片段; (2)[D-Trp6]-aFGF-(1-15): 将aFGF-(1-15)片段中的第6位甘氨酸以右旋-色氨酸替换; (3)[desaminoPhe1.D-Trp6]-aFGF-(1-15): 将aFGF-(1-15)片段中第1位苯丙氨酸去氨基, 第6位甘氨酸以右旋-色氨酸替换; (4)[desaminoPhe1.Lys(ε-myristyl)16]- aFGF-(1-15): 将aFGF-(1-15)片段中第1位苯丙氨酸去氨基, 第16位半胱氨酸以赖氨酸(ε-十四烷基)替换; (5)[desaminoPhe1.Lys(ε-myristyl)16]-aFGF-(1-16): 将aFGF-(1-16)片段中第1位苯丙氨酸去氨基, 第16位半胱氨酸以赖氨酸(ε-十四烷基)替换; (6)[D-Trp6.Lys(ε-myristyl)16]- aFGF-(1-16): 将aFGF-(1-16)片段中的第6位甘氨酸以右旋-色氨酸替换, 第16位半胱氨酸以赖氨酸(ε-十四烷基)替换; (7)[Ala16]-aFGF-(1-29): 将aFGF-(1-29)片段中的第16位半胱氨酸残基用丙氨酸替换, 所有片段均委托日本大阪肽研究所合成. aFGF片段均溶于含1 g/L牛血清白蛋白的人工脑脊液中.
1.2.3 分组及给药: 将大鼠随机分为对照组和aFGF片段组. 在脑室内注射时, 将全部aFGF片段设每只大鼠200、400 ng两个剂量组, 皮下注射时, 设80、100、300 μg/kg三个剂量组. 分别n = 6, 对照组用同样操作方法, 脑室内注入等量10 μL生理盐水或sc 0.2 mL等量生理盐水.
1.2.4 药物投于方法及摄食量测定: 脑室内注射前, 连续测定3 d的摄食量, 在确认安定基础摄食量的状况下, 在无麻醉下18:30-19:00从第三脑室或sc给与aFGF片段. 脑室内给药时, 聚乙烯管(长30 mm)的一端与注射用插管相连, 另一端装上微计量注射器. 在注入药物前拔掉带聚乙烯帽的不锈钢制导丝, 将注射用插管插入置入第三脑室的不锈钢导管内, 将10 μL溶液用微量注射器缓慢注入, 注射时间不少于10 min. 然后在19:00, 22:00及07:00的时间点测定饲料箱内粉末饲料, 分别计算3 h(19:00-22:00)及12 h(19:00-7:00)的摄食量.
1.2.5 脑室内注射组织学监测: 实验结束后, 用过量的戊巴比妥钠深麻醉大鼠, 20 g/L的美蓝溶液溶于0.5 mL生理盐水中, 用与前述注射药物同样的方法注入第三脑室内. 然后用40 g/L的中性甲醛溶液(100 mL), 经左心室灌流后, 取出脑组织, 再在40 g/L的中性甲醛溶液中固定1 d以上, 作前额断面的连续冰冻切片(50 μm), 在显微镜下确认插入管头端的位置. 并同时满足: (1)药物投与前除去带聚乙烯帽的不锈钢制导丝时, 脑脊液由置入第三脑室的不锈钢导管溢出; (2)20 g/L的美蓝溶液注入后脑室的全部内壁均染色; (3)脑内无明显的出血或炎症. 满足以上三个标准的大鼠的数据作为有效数据, 不合格的予以剔除.
统计学处理 所有的测定值均以mean±SD表示, 统计学方法采用配对t检验和方差分析, P<0.05差异有统计学意义.
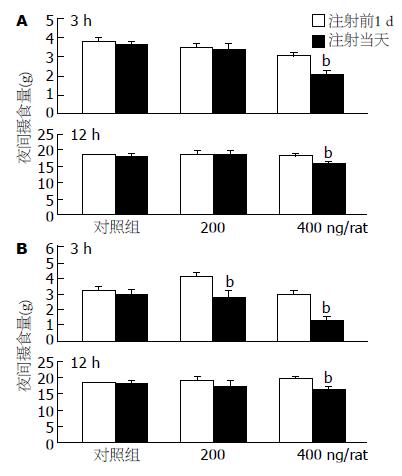
在全部aFGF片段中, aFGF-(1-15)以每只大鼠200 ng(n = 6)脑室内给予后对摄食没有影响; 而给与每只大鼠400 ng脑室内注射后, 3 h及12 h摄食量均明显减少, 与给药的前1 d相比, 其摄食量分别从3.0±0.2 g减少为2.1±0.2 g(P<0.01, n = 6)和18.5±0.5 g减少为16.1±0.5 g(P<0.01, n = 6)(图1A). [Ala16]-aFGF-(1-29)组在每只大鼠200 ng脑室内给药后, 最初3 h的平均摄食量从4.9±0.2 g减少为3.4±0.2 g(P<0.01,n = 6), 12 h平均摄食量从19.3±1.2 g减少为17.3±1.1g(P<0.01, n = 6); 在每只大鼠400 ng给药后, 最初3 h的平均摄食量从3.6±0.1 g减少为1.6±0.2 g(P<0.01, n = 6), 12 h平均摄食量从19.9±0.8 g减少为16.4±1.6 g(P<0.01, n = 6)(图1B). 对照组脑室内注射等量生理盐水对大鼠夜间摄食没有影响(n = 6).
无论是在每只大鼠200 ng给药, 还是在每只大鼠400 ng给药, [D-Trp6]-aFGF-(1-15), [desaminoPhe1.D-Trp6]-aFGF-(1-15, [desaminoPhe1.Lys(ε-myristyl)16]-aFGF-(1-16), [Lys(ε-myristyl)16]-aFGF-(1-16), [D-Trp6.Lys(ε-myristyl)16]-aFGF-(1-16)这5种aFGF片段脑室内给药对摄食均没有影响(表1).
| 时间 | B | C | D | E | ||||||
| 200 | 400 | 200 | 400 | 200 | 400 | 200 | 400 | 200 | 400 | |
| 3 h | ||||||||||
| 前1 d | 3.6±0.2 | 3.3±0.4 | 4.6±0.3 | 3.6±0.2 | 3.1±0.2 | 3.8±0.2 | 4.4±0.1 | 3.4±0.3 | 3.9±0.4 | 3.2±0.3 |
| 当天 | 3.5±0.1 | 3.4±0.2 | 4.8±0.2 | 3.5±0.1 | 3.3±0.2 | 4.0±0.1 | 4.2±0.2 | 3.7±0.2 | 4.0±0.1 | 3.5±0.2 |
| 12 h | ||||||||||
| 前1 d | 19.4±0.5 | 18.6±0.6 | 19.0±0.7 | 18.7±0.3 | 17.9±0.8 | 19.5±0.7 | 19.3±0.8 | 18.1±0.9 | 18.5±1.1 | 17.8±1.0 |
| 当天 | 18.8±0.7 | 18.9±0.4 | 19.8±0.9 | 18.3±0.5 | 18.5±1.0 | 19.8±0.5 | 18.7±0.7 | 18.8±0.6 | 17.9±0.7 | 18.5±0.6 |
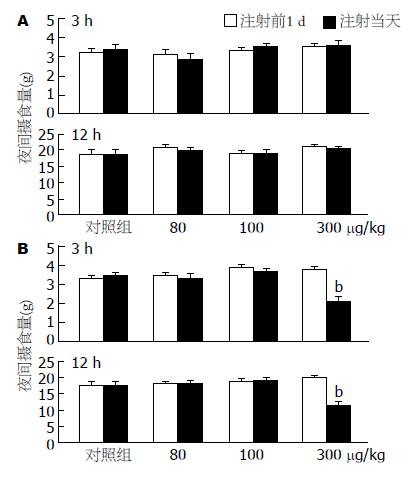
为将来开发该细胞因子片段的临床应用奠定基础, 将aFGF-(1-15)和[Ala16]-aFGF-(1-29)采用皮下注射的方式给药, 来观察他们对于大鼠夜间摄食的影响. 两种细胞因子片段无论是80 μg/kg还是100 μg/kg皮下注射给药, 对于大鼠3 h的摄食量和12 h的摄食量均没有影响(n = 6); 而加大给药剂量, 在300 μg/kg给药浓度下, 与前1 d相比, aFGF-(1-15)组对大鼠的夜间摄食依然没有影响(n = 6)(图2A); [Ala16]- aFGF-(1-29)组最初3 h的平均摄食量从3.9±0.2 g减少为2.1±0.3 g(P<0.01, n = 6), 12 h平均摄食量从19.8±0.5 g减少为11.2±0.8 g(P<0.01, n = 6)(图2B). 对照组sc等量生理盐水对大鼠夜间摄食没有影响(n = 6).
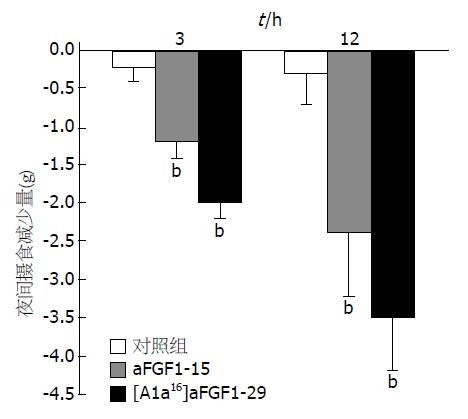
分别计算相同脑室给药剂量下, aFGF-(1-15)与[Ala16]-aFGF-(1-29)以及对照组前一日与给药当日3、12 h摄食量的差值, 采用方差分析进行组间比较. aFGF-(1-15), [Ala16]-aFGF-(1-29)与对照组比较, 均有统计学意义(P<0.01). 在每只大鼠400 ng给药剂量, aFGF-(1-15)前1 d与给药当日3 h摄食量的差值为0.9±0.3g, [Ala16]aFGF-(1-29)为2.0±0.2 g, 两组比较P<0.01; 再比较两种片段前一日与给药当日12 h摄食量的差值2.4±0.7 g和3.5±0.8 g, P<0.01(图3).
研究已经发现, 酸性成纤维细胞生长因子(aFGF)除具有促进成纤维细胞生长作用外, 尚有很多中枢及外周的生理活性. 包括(1)作用于下丘脑的摄食中枢调节摄食[4-5]; (2)通过中枢和外周作用调节交感神经活动[5-6]; (3)在缺血等应激状态下, 使组织细胞减少或免受伤害, 并促进损伤后细胞再生等功能[7-9]. 但aFGF分子质量较大, 合成复杂, 价格昂贵, 且易产生不良反应, 这些限制了其临床应用前景. 为了寻找具有同样生物活性的N端的aFGF片段, 在本研究中设计了7种aFGF片段, 通过给大鼠脑室内注射后测定摄食量变化的方法了解其生物活性. 在发现了aFGF活性片段后, 为了将来可能开发该细胞因子片段作为临床应用, 进一步采用皮下注射的方式来观察aFGF-(1-15)和[Ala16]aFGF-(1-29)两种有活性的细胞因子片段对于大鼠夜间摄食的影响.
Sasaki et al[10]的研究显示, aFGF的C端aFGF- (114-140)没有摄食抑制活性, N端aFGF-(1-15)抑制大鼠的夜间摄食, 但在相同摩尔浓度下, 其效果只有aFGF的1/200; 相反, 更长的N端片段aFGF-(1-20)和aFGF-(1-29), 对大鼠的夜间摄食没有影响. 本研究显示把aFGF N端aFGF- (1-15)(每只大鼠200 ng)在脑室内投与后, 对大鼠的夜间摄食没有影响; 而把aFGF-(1-15)(每只大鼠400 ng)在脑室内投与后, 大鼠的3 h摄食量12 h摄食量均减少了, 与Sasaki et al的实验结果一致. 上述结果显示, aFGF氨基末端aFGF-(1-15)可能是具有抑制大鼠夜间摄食活性的细胞因子片段. 有研究结果[11]显示aFGF的第7-13位氨基酸序列NYKKPKL为核转运序列, 我们设想aFGF-(1-15)具有抑制摄食活性可能与该结构相关.
aFGF有两个保守的半胱氨酸残基, 分别位于第16位和第83位, 这个半胱氨酸残基参与形成分子间二硫键, 从而造成构象的改变[10]. 人型的aFGF, 由于形成了二硫键, 导致对于Balb/c 3T3细胞的促分裂作用消失[12]. 这提示更长的N端片段aFGF-(1-20)和aFGF-(1-29), 对大鼠的夜间摄食没有影响的原因可能是第16位的半胱氨酸残基的影响. 因为考虑到分子间二硫键的形成, 我们用丙氨酸代替16位的半胱氨酸残基, 这是考虑到两种氨基酸均为一氨基一羧基结构, 在结构上接近, 等电点也相对接近, 加之丙氨酸为小分子氨基酸, 对肽的空间结构影响不大. 结果[Ala16]-aFGF(1-29)经脑室内投与, 无论是在每只大鼠200ng还是在每只大鼠400 ng均减少了大鼠的夜间摄食量. 且与aFGF-(1-15)相比, 无论是3 h还是12 h, [Ala16]-aFGF(1-29)抑制大鼠的夜间摄食作用更明显. 该结果证实了我们的设想即用其他氨基酸残基代替aFGF片段中易参与形成分子间二硫键的第16位的半胱氨酸残基, 比如丙氨酸, 避免了可能的二硫键形成, 从而使得该分子片段显示了其生物活性. 如前所述, 根据Sasaki et al的研究结果, aFGF-(1-15)的作用效果为其全氨基酸分子的1/200, 我们设想可能aFGF的生物活性强度与其分子中氨基酸数量在一定程度上存在正比例关系, 且[Ala16]-aFGF(1-29)片段较长, 可能含有肝素结合的基本位点, 而肝素是一类糖胺聚糖, 可增加aFGF的稳定性, 防止aFGF被热、极端pH变性及蛋白酶水解. 所以在本研究中29个氨基酸的片段较15个氨基酸的片段显示了更强的摄食抑制作用.
为了寻找摄食抑制作用更强的N端的aFGF片段, 并提高其生物利用度, 增加其稳定性, 防止其被代谢, 我们将第1位苯丙氨酸去氨基, 第6位非极性疏水甘氨酸被极性中性氨基酸右旋-色氨酸替代, 第16位半胱氨酸被赖氨酸所替代, 并将赖氨酸以ε-十四烷基进行化学修饰, 使其无碱性, 共合成五种aFGF片段, 采用脑室给药进行观察, 发现对大鼠的夜间摄食均没有影响, 提示这些分子结构的改变所形成的新的aFGF分子片段并没有生物活性. 分析原因可能是第1位苯丙氨酸去氨基而变成酸性, 导致等电点变低; 第6位甘氨酸被右旋-色氨酸替代, 色氨酸有杂环, 为大分子氨基酸, 易造成肽的空间结构错位, 加之右旋-色氨酸为非天然氨基酸没有活性, 从而造成合成的分子片段没有生物活性; 第16位半胱氨酸被赖氨酸(ε-十四烷基)所替代, 可能是所带侧链ε-十四烷基, 影响末端羧基发挥作用, 从而影响了其生物学活性作用. 这说明aFGF分子结构和其生物活性之间存在着相当复杂的关系, 仍有很多未知的问题需要进一步研究.
进一步的皮下注射给药[Ala16]-aFGF(1-29)同样抑制了大鼠的夜间摄食, Cuevas et al[13]的研究结果显示, aFGF外周给药可以透过血脑屏障对缺血所致的海马神经元损伤起保护作用. 我们的结果提示aFGF片段外周给药起到与中枢给药同样的生理作用. 在此过程中, aFGF片段是否通过未知的外周机制影响了摄食, 目前尚没有证据. 而aFGF-(1-15)皮下注射对大鼠的夜间摄食却没有影响, 可能由于他的作用较[Ala16]aFGF-(1-29)弱, 而我们使用的剂量没有达到足够大有关.
总之, 本研究显示, aFGF氨基酸序列的N末端及用丙氨酸代替aFGF氨基末端中半胱氨酸残基所形成的新的aFGF片段具有摄食调节生物活性, 且部分新的活性片段外周给药同样可以发挥其生物学活性. 这些结果为进一步开发aFGF的临床应用展现了一个良好的前景.
研究已经清楚酸性成纤维细胞生长因子(aFGF)与各种由中胚层发生来的细胞的分化和增殖密切相关, 同时他们在中枢神经系统及外周的其他作用也非常引人注目, 包括神经元的损伤保护、抑制摄食、在缺血等情况下对心肝肾等重要脏器细胞的保护作用和抗衰老, 增强记忆等. aFGF的众多的生物活性, 展现了该物质是一个具有广泛临床开发使用前景的生物活性因子.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科.
aFGF具有广泛的生物活性, 有望开发成药物用于临床, 但aFGF分子量较大, 合成复杂, 易产生不良反应. 故目前希望寻找其具有生物活性的分子片段来取代整个分子用于开发使用. 但关于其分子中有效的生物活性部位的不明点还很多. aFGF的氨基酸序列与其特异的生物活性相关, 但其详细的构造-活性相互关系还不清楚.
本研究中首次设计了七种aFGF片段, 采用中枢给药方式, 通过测定其对大鼠摄食量的影响来鉴定aFGF分子中的活性部位, 发现了与aFGF大分子具有同样或相近生物活性的N端的aFGF片段, 同时进一步证明了部分活性片段外周给药同样可以发挥其生物学活性, 并对其活性-构造关系进行了初步的阐述. 为进一步研究开发aFGF的临床应用奠定了良好的基础.
本研究发现部分aFGF片段具有与aFGF大分子相同或相近的生物活性, 由于其分子结构较aFGF简单, 分子量小, 更容易合成, 成本更低; 在给予生物体用药时更易被吸收利用、不良反应大大减少, 具有较好的临床应用前景.
1 成纤维细胞生长因子: 是一个蛋白质家族, 因其对BALB/c3T3等成纤维细胞有强烈的增殖作用而得名. 现发现至少已有23个成员, 即FGFl-FGF23, 在这些FGF家族当中被研究最多的要数有140个和146个氨基酸序列组成的aFGF及bFGF, 两者具有55%的同源性.
2 酸性成纤维细胞生长因子: 是FGF家族中的重要成员. 由Thomas于1984年从牛脑中分离纯化得到. aFGF可促进组织细胞分裂、增殖, 还具有在缺血再灌注等应急状态下对神经元、心脏、肾脏等重要器官的损伤保护和修复作用.
本文内容新颖, 设计合理, 结果可靠, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Baird A, Walicke PA. Fibroblast growth factors. Br Med Bull. 1989;45:438-452. [PubMed] |
| 2. | Sasaki K, Oomura Y, Figurov A, Morita N, Yanaihara N. An amino-terminal fragment peptide of acidic fibroblast growth factor modulates synaptic transmission in rat hippocampal slices. Brain Res Bull. 1995;38:185-191. [PubMed] [DOI] |
| 3. | Schober W. The rat cortex in stereotaxic coordinates. J Hirnforsch. 1986;27:121-143. [PubMed] |
| 4. | Hanai K, Oomura Y, Kai Y, Nishikawa K, Shimizu N, Morita H, Plata-Salamán CR. Central action of acidic fibroblast growth factor in feeding regulation. Am J Physiol. 1989;256:R217-R223. [PubMed] |
| 5. | Oomura Y. Acidic fibroblast growth factor, a satiety substance, with diverse physiological significance. NeuroImmune Biology. 2008;6:199-211. [DOI] |
| 6. | Matsumoto I, Oomura Y, Niijima A, Sasaki K, Aikawa T. Acidic fibroblast growth factor activates hypothalamic-pituitary- adrenocortical axis in rats. Am J Physiol. 1998;274:R503-R509. [PubMed] |
| 7. | Lee LM, Huang MC, Chuang TY, Lee LS, Cheng H, Lee IH. Acidic FGF enhances functional regeneration of adult dorsal roots. Life Sci. 2004;74:1937-1943. [PubMed] [DOI] |
| 8. | Luginbuehl V, Meinel L, Merkle HP, Gander B. Localized delivery of growth factors for bone repair. Eur J Pharm Biopharm. 2004;58:197-208. [PubMed] [DOI] |
| 9. | Lee YS, Sindhu RK, Lin CY, Ehdaie A, Lin VW, Vaziri ND. Effects of nerve graft on nitric oxide synthase, NAD(P)H oxidase, and antioxidant enzymes in chronic spinal cord injury. Free Radic Biol Med. 2004;36:330-339. [PubMed] [DOI] |
| 10. | Sasaki K, Li AJ, Oomura Y, Muto T, Hanai K, Tooyama I, Kimura H, Yanaihara N, Yagi H, Hori T. Effects of fibroblast growth factors and related peptides on food intake by rats. Physiol Behav. 1994;56:211-218. [PubMed] [DOI] |
| 11. | Imamura T, Engleka K, Zhan X, Tokita Y, Forough R, Roeder D, Jackson A, Maier JA, Hla T, Maciag T. Recovery of mitogenic activity of a growth factor mutant with a nuclear translocation sequence. Science. 1990;249:1567-1570. [PubMed] [DOI] |
| 12. | Hatai M, Hashi H, Mogi A, Soga H, Yokota J, Yaoi Y. Stimulation of tyrosine- and serine-phosphorylation of focal adhesion kinase in mouse 3T3 cells by fibronectin and fibroblast growth factor. FEBS Lett. 1994;350:113-116. [PubMed] [DOI] |
| 13. | Cuevas P, Carceller F, Muñoz-Willery I, Giménez-Gallego G. Intravenous fibroblast growth factor penetrates the blood- brain barrier and protects hippocampal neurons against ischemia-reperfusion injury. Surg Neurol. 1998;49:77-83; discussion 83-84. [PubMed] [DOI] |