修回日期: 2008-12-24
接受日期: 2008-12-29
在线出版日期: 2009-01-28
目的: 探讨干细胞标志物ABCG2在肝细胞性肝癌组织和肝癌细胞株中表达的意义.
方法: 应用免疫组化SP方法检测ABCG2在30例肝细胞性肝癌组织和8例癌旁肝硬化组织中的表达、分布, 并采用细胞免疫荧光技术检测ABCG2在两种肝癌细胞株HepG2、PLC/PRF/5中的表达, 采用流式细胞技术测试出两种细胞株中ABCG2阳性细胞的比例.
结果: 免疫组化中, ABCG2阳性染色定位于癌细胞胞膜, 部分病例胞质也有分布. 免疫组化显示ABCG2在肝细胞性肝癌组织和癌旁肝硬化组织中的表达阳性率分别为63.33%(19/30)和25%(2/8). ABCG2蛋白在HepG2、PLC/PRF/5这两个肝癌细胞株中均有表达, HepG2中, ABCG2阳性染色定位于细胞胞质中, 而在PLC/PRF/5中, ABCG2阳性染色定位于细胞胞质和细胞膜上. PLC/PRF/5细胞株中, 通过流式细胞仪能检测出表达ABCG2的细胞(P<0.05), 而在HepG2细胞株中, 通过流式细胞仪不能检测出表达ABCG2的细胞.
结论: ABCG2在肝细胞性肝癌的发生发展过程中可能起着非常重要的作用, 有可能成为临床治疗肝细胞性肝癌的分子靶标.
引文著录: 奚忠, 江春平, 丁义涛. ABCG2在肝细胞性肝癌组织和肝癌细胞株中的表达及意义. 世界华人消化杂志 2009; 17(3): 247-252
Revised: December 24, 2008
Accepted: December 29, 2008
Published online: January 28, 2009
AIM: To investigate ABCG2 expression and its significance in hepatocellular carcinoma (HCC) tissue and HCC cell lines.
METHODS: The expression of ABCG2 and the distribution of ABCG2-positive cells of 30 HCC cases and 8 cases of paraneoplastic liver cirrhosis were examined using immunohistochemistry SP methods. Dual-fluorescent immunostaining was used to detect ABCG2 positive cells in two HCC cell lines, and flow cytometry was used to figure out the percentages of ABCG2-positive cells in the two HCC cell lines.
RESULTS: The present study confirmed the predominant localization of ABCG2 transporter in plasma membrane. Some of ABCG2-positive tumors showed mixed membranous and cytoplasmic staining. ABCG2 expression was detected in 63.33% (19/30) of HCC and 25% (2/8) of paraneoplastic liver cirrhosis. ABCG2 expression was observed both in the two HCC cell lines, ABCG2 expression in HepG2 was only observed in the cytoplasm, whereas ABCG2 expression was observed on the cell membrane in addition to the cytoplasm in PLC/PRF/5; ABCG2-positive cells can be detected by flow cytometry in PLC/PRF/5 (P< 0.05), but not in HepG2.
CONCLUSION: The expression of ABCG2 found in HCC tissue and HCC cell lines may be closely related to oncogenesis and progress of HCC, and the ABCG2 may be regarded as a potential maker for liver cancer stem cells.
- Citation: Xi Z, Jiang CP, Ding YT. Expression of stem cell marker ABCG2 and its significance in hepatocellular carcinoma tissue and cell lines. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 247-252
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/247.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.247
ABCG2属于ABC转运蛋白家族成员之一, 被认为是侧群细胞的表型, 一种潜在的干细胞分子标志[1-2]. 目前已经发现部分肿瘤干细胞的标志中包含ABCG2, 并且有些研究直接用ABCG2作为干细胞或肿瘤干细胞的标志物来分离或鉴定干细胞或肿瘤干细胞[3-5]. 最新研究表明肝癌干细胞可能也存在于人类肝细胞型肝癌中, 而且在肝癌的发生、发展中占有重要作用[6-7], 也有文献表明在肝癌细胞株中确实存在肝癌干细胞[8], 本研究通过组织学和细胞学结合的方式, 探讨干细胞标志分子ABCG2在肝细胞性肝癌组织和肝癌细胞株中的表达和分布, 阐明肝癌干细胞在肝癌形成过程中的作用, 为临床治疗肝细胞性肝癌确定可能的分子靶标.
人肝癌细胞株HepG2和PLC/PRF/5(购买自中国科学院上海生命科学院细胞库), H-DMEM培养液(美国Hyclone公司), 胎牛血清(美国Hyclone公司), 胰蛋白酶(美国Hyclone公司), 鼠抗人ABCG2单克隆抗体(克隆号: 5D3, 美国R&D公司产品, 工作浓度1:20), 异硫氰酸标记的兔抗鼠二抗100 μL(Millipore公司产品, 工作浓度1:50), Hochest 33258染料(Sigma公司产品, 工作浓度1:1000), 倒置显微镜(Olympus公司), 二氧化碳培养箱(Thermo公司), 超净工作台(苏州净化有限公司), 荧光显微镜(Olympus公司), 流式细胞仪(Thermo公司). 收集南京市鼓楼医院病理科2006-10/2007-12病例资料完整的30例肝细胞性肝癌和8例癌旁肝硬化手术切除标本(患者手术前都没有接受过化疗或放疗). 经我院病理科均确诊为肝细胞型肝癌. 其中男25例, 女5例; 患者年龄32-82(平均年龄60)岁. 参照国际TNM分期标准, 分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期, 再分为早期(Ⅰ、Ⅱ期)19例, 晚期(Ⅲ、Ⅳ期)11例, 组织学显示乙型肝炎后肝硬化17例, 有脉管癌栓11例. 肿瘤最大直径1.0-15 cm, ≥10 cm者7例, 3-10 cm者18例, ≤3 cm者5例.
1.2.1 免疫组化染色: 采用SP方法. 一抗为鼠抗人ABCG2单克隆抗体(克隆号: 5D3, 美国R&D公司产品, 工作浓度1:100). 主要步骤包括: 常规脱蜡至水, 1 mmol/L、pH6.0柠檬酸微波95℃ 20 min, 阻断内源性过氧化物酶、正常羊血清封闭, 一抗4℃过夜; 次日依次加生物素标记的羊抗鼠二抗和Streptavidin-Peraxidase, DAB显色; 苏木素复染, 脱水、透明、固定. 试验中同时设立阳性对照和阴性对照. 阴性对照: 用PBS代替一抗. 阳性对照: 根据抗体说明书, 选用胎盘组织ABCG2染色. 结果判定: ABCG2阳性细胞为胞膜棕黄色染色, 癌细胞全部不着色为阴性.
1.2.2 人肝癌细胞株HepG2和PLC/PRF/5的培养: 人肝癌细胞株HepG2和PLC/PRF/5细胞接种于75 mL的培养瓶中, 培养液为90%的H-DMEM, 100 mL/L胎牛血清, 100 kU/L青霉素, 100 mg/L链霉素, 置于37℃, 50 mL/L CO2环境中培养, 24 h后首次换液去掉未贴壁的悬浮细胞. 以后根据细胞生长情况每3天换液, 第6-7天细胞生长占瓶底面积超过90%时, 用2.5 g/L浓度的胰蛋白酶消化, 按照1:2进行传代, 以后重复操作, 传至第五代, 培养过程中倒置相差显微镜下对培养中的细胞进行观察.
1.2.3 人肝癌细胞株HepG2和PLC/PRF/5的免疫细胞化学: 细胞长满后接种于高压消毒处理过的载玻片上, 待细胞处于对数生长期时取出载玻片, PBS清洗5 min×3次后, 用40 mL/L多聚甲醛固定10 min, PBS清洗5min×3次后, 0.2% Triton-X100破膜2 min, PBS清洗后加鼠抗人ABCG2单克隆抗体(用含3% BSA的PBS稀释)100 μL, 4℃孵育, 过夜. 同时设立对照组: 用PBS代替一抗. PBS清洗5min×3次后, 加入异硫氰酸标记的兔抗鼠二抗100 μL, 工作浓度1:50, 4℃孵育30 min. PBS清洗5 min×3次. 加入Hochest 33258染料100 μL, 4℃孵育15 min, PBS清洗5 min×3次, 甘油封片, 荧光显微镜下观察、照相.
1.2.4 流式细胞术分选阳性细胞比例: 用2.5 g/L浓度的胰蛋白酶消化下来后, 计数细胞达到106数量级装入Ep管中, 1200 r/min离心5 min, PBS清洗5 min×3次, 加入一抗: 鼠抗人ABCG2 mAb, 4℃过夜. 同时设立阴性对照组: 用PBS代替一抗. PBS清洗5 min×3次, 次日加入异硫氰酸标记的羊抗鼠二抗, 4℃孵育30 min. PBS清洗5 min×3次. 上流式细胞仪检测细胞ABCG2阳性率. 实验重复4次.
统计学处理 采用SPSS 15.0统计软件进行数据处理. 配对资料采用t检验, P<0.05表示有显著性差异.
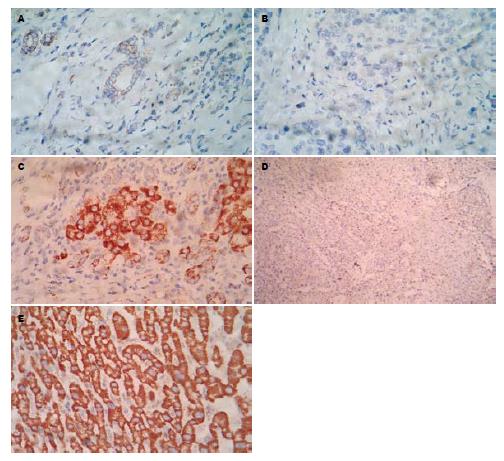
ABCG2在肝细胞性肝癌组织和癌旁肝硬化组织中的表达阳性率分别为63.33%(19/30)和25%(2/8). 在癌旁肝硬化组织中, ABCG2表达在胆小管和Hering小管中(图1A中有些细小的管腔, 周围没有结缔组织而是被成熟的肝细胞包绕, 提示该组织为Hering小管), 而在肝癌组织中, ABCG2则表达在癌细胞的胞膜和胞质中, ABCG2在癌旁肝硬化组织中表达强度比在肝癌组织中弱. 不同区域的染色程度差异不明显, 阳性产物呈弥散的棕黄色颗粒. 阳性对照(胎盘组织)染色的合胞体滋养层细胞膜和胞质可见ABCG2强阳性染色(图1).
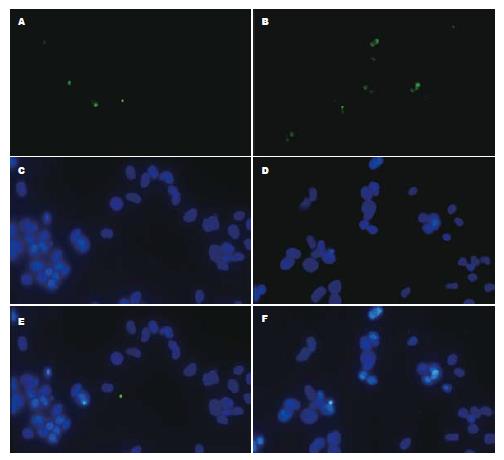
两种肝癌细胞株都表达ABCG2(阴性对照组都没有观察到绿色荧光染色). 在HepG2中, ABCG2主要表达在细胞的胞质中, 而在PLC/PRF/5中, ABCG2主要表达在细胞膜上, 胞质内也有表达(图2). 其中蓝色荧光的为Hochest33258染色, 大多细胞都能被染色, 绿色荧光的为ABCG2染色.
HepG2中, 对其采用配对资料的t检验, 得出P = 0.149>0.05. 说明这两组数据没有统计学差异. 这表明通过流式细胞仪不能检测出表达ABCG2的细胞. 同样, PLC/PRF/5中, 对其采用配对资料的t检验, 得出P = 0.008<0.05. 说明这两组数据有统计学差异. 这表明通过流式细胞仪能检测出表达ABCG2的细胞(表1).
关于肿瘤的起源有两种学说: 成熟细胞起源学说和祖细胞起源学说[9-10]. 成熟细胞起源学说认为人类肿瘤起源于分化细胞基因突变的不断积累; 而祖细胞起源学说只适用于一些少数的肿瘤, 如畸胎瘤和白血病[11] 从肿瘤细胞的增殖观念角度, 有两种模型: 推测模型和等级分化模型. 推测模型认为肿瘤的所有细胞都具有相同的致瘤能力, 并且可以像一个新的肿瘤细胞发挥功能作用. 相反的, 等级分化模型则认为: 只有少数细胞或细胞亚群具有明显的增殖能力, 而且可以产生新的肿瘤细胞. 等级分化模型与肿瘤干细胞理论相符, 也就是说肿瘤干细胞可能是致瘤细胞, 在肿瘤细胞的谱系中占有重要地位[12-13]. 最新的干细胞研究认为: 祖细胞起源学说和等级分化模型可以应用在实体肿瘤上. 肿瘤干细胞可能不仅仅存在于白血病, 还有可能存在于实体肿瘤, 如脑肿瘤和乳腺癌[14-16].
1997年, Goodell et al[17]开创了一个新的方法来证实成人干细胞存在. 当骨髓来源的细胞与Hoechst33342染料共同孵育, 并通过流式细胞仪检测时, 发现有一小部分细胞不能够被Hoechst33342染料染色, 从而被证实为侧群(side population, SP)细胞. SP细胞技术被用来检测正常组织中的干细胞和肿瘤组织中的肿瘤干细胞[18-19]. 肿瘤干细胞与肿瘤细胞在形态上没有差异, 肿瘤干细胞只是一个功能学概念, 体内致瘤性是鉴定肿瘤干细胞的重要依据. 通过侧群细胞的研究, 可以在肿瘤细胞株中将SP细胞与非SP细胞分选开来. 分选出来的SP细胞则可以用来检测他们是否有肿瘤干细胞特性: 体内高效的致瘤性. 但是, Hoechst33342染料具有细胞毒性, SP细胞因为细胞膜上有ATP结合盒膜转运蛋白保护而不受Hoechst33342染料的毒性作用, 但是非SP细胞因为细胞膜上没有保护性蛋白, 所以不能存活[20]. 那么, SP细胞的致瘤性究竟是肿瘤干细胞的内在致瘤性, 还是由于人为的Hoechst33342染料的毒性作用, 就不得而知了. 这样的话, 以是否可以泵出Hoechst33342染料来用于肿瘤干细胞的鉴定是不合理的. 然而, ABCG2在细胞表面的表达可能可以作为一个肝癌干细胞的表面标志物来研究[21].
ABCG2属于ABC转运蛋白家族成员之一, 被认为是侧群细胞的表型, 一种潜在的干细胞分子标记, 本实验通过对30例肝细胞型肝癌组织和8例癌旁肝硬化组织免疫组织化学的实验研究发现, ABCG2在癌旁肝硬化组织和肝细胞型肝癌组织中都有表达, 且肝细胞型肝癌组织中的阳性率明显高于肝硬化组织. 在癌旁肝硬化组织中, ABCG2表达在胆小管和Hering小管中, 而在肝癌组织中, ABCG2则表达在癌细胞的胞膜和胞质中. 这表明ABCG2+细胞在从癌旁肝硬化组织向肝癌组织演变的过程中是一直存在的. 现在公认的肝癌干细胞可能就是起源于正常组织肝干细胞, 这些细胞主要位于胚胎肝脏或成年肝脏的胆管末端Hering小管中[22], 而本实验的结果表明Hering小管中表达ABCG2的肝干细胞可能就是肝癌干细胞. ABCG2+细胞具有很多干细胞或者祖细胞的特性, 例如自我更新能力, 高效的增殖能力, 以及能够产生非干细胞后代等. ABCG2+细胞在癌旁肝硬化组织和肝细胞型肝癌组织中都存在, 说明在癌细胞的谱系中占有重要位置, 可能在肿瘤细胞的扩增中发挥重要作用. 在该研究中, 鉴于ABCG2在癌旁肝硬化和肝癌中的阳性表达, 表明祖细胞起源学说和等级分化模型适用于人类肝细胞型肝癌.
在本研究中, 通过流式细胞仪不能从HepG2细胞株中检测出表达ABCG2的细胞, 而在PLC/PRF/5细胞株中, 可以检测出表达ABCG2的细胞. 但是对于HepG2细胞株, 通过细胞免疫荧光检测, 确实可以观察到表达ABCG2阳性的细胞. 这一问题可能与ABCG2在不同的细胞株中的细胞定位有关[21], 因为流式细胞仪只能检测出表达细胞膜上的蛋白, 细胞膜的内蛋白因为没有作破膜处理, 一抗未能与其结合, 从而检测不出. ABCG2定位在HepG2的细胞胞质内, 在细胞膜上不表达, 通过流式细胞仪无法检测, 但是ABCG2在PLC/PRF/5细胞中, 定位不仅在细胞胞质内, 在细胞的胞膜上也有表达, 所以通过流式细胞仪可以检测出表达ABCG2的细胞, 本实验通过流式细胞仪检测出在PLC/PRF/5中ABCG2阳性细胞比率平均值为35.0%, 但是根据肿瘤干细胞理论, 肿瘤干细胞的数量只有占一小部分, 分析其原应可能与实验仪器误差有关, 还有可能与实验当时细胞的增殖状态有关.
总之, 通过本研究可以确定干细胞标记分子ABCG2在癌旁肝硬化和肝癌组织中都有表达, 而且在肝癌细胞株中也可以筛选出表达ABCG2阳性的细胞, 我们可以得出干细胞标记分子ABCG2可能是肝癌干细胞的标记分子, 是否可以单独作为特异性的标记分子还需要进一步的研究证明. 例如, 体内致瘤性是筛选和鉴定肿瘤干细胞的重要手段, 建立在本实验的基础上, 可以在肝癌细胞株PLC/PRF/5中分选出ABCG2阳性的细胞, 以阴性细胞作为对照, 同时注入裸鼠体内, 观察其致瘤性和致瘤能力的差异, 从而确定肝癌干细胞特异性的标志分子.
关于肿瘤的起源问题一直是研究难题. 肿瘤干细胞理论为肿瘤的起源提供了全新的理念, 认为肿瘤起源于肿瘤组织中少数的具有干细胞特征的肿瘤干细胞.
陈光, 教授, 吉林大学第一医院消化器官外科
肿瘤干细胞理论相继在白血病、脑肿瘤、乳腺癌等一些疾病中被证实, 相关肿瘤干细胞也得到了分离和鉴定, 相关肿瘤标志物也被确定, 而关于肝癌干细胞的分离和鉴定报道很少, 相关肿瘤标志物也未找到.
有报道采用侧群细胞技术来分离实体性肿瘤细胞株中的侧群细胞, 并检测侧群细胞的致瘤性, 从而确定肿瘤干细胞的存在. 但是, 侧群细胞分离过程中采用的Hoechst33342染料具有细胞毒性, 不能很好阐明致瘤性的原因.
本研究首次采用公认的干细胞标志物ABCG2作为肝癌干细胞的潜在标记分子, 检测其在肝细胞型肝癌组织和肝癌细胞株中的表达.
根据肝癌细胞株中细胞是否表达ABCG2蛋白, 将阳性细胞和阴性细胞分选开来, 为今后的细胞异体移植研究打下基础, 从而确定肝癌干细胞的标志物, 为肝癌的临床和基因治疗提供依据.
ABCG2: ATP结合转运蛋白G超家族成员2, 是一种P-糖蛋白, ABCG2在侧群细胞SP中呈现高表达, 被认为参与肿瘤细胞的多药耐药性. ABCG2蛋白被认为是半转运蛋白,可识别带正负电荷的分子、有机离子和硫酸盐络合物, 主要存在于干细胞, 某些肿瘤细胞和上皮细胞的顶膜. ABCG2主要参与肿瘤干细胞多药抗性的形成.
本研究设计合理, 采用技术手段先进, 所得结论符合祖细胞起源学说和等级分化模型学说, 有较好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Goodell MA, Brose K, Paradis G, Conner AS, Mulligan RC. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 1996;183:1797-1806. [PubMed] [DOI] |
| 2. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] [DOI] |
| 3. | Seigel GM, Campbell LM, Narayan M, Gonzalez-Fernandez F. Cancer stem cell characteristics in retinoblastoma. Mol Vis. 2005;11:729-737. [PubMed] |
| 4. | Olempska M, Eisenach PA, Ammerpohl O, Ungefroren H, Fandrich F, Kalthoff H. Detection of tumor stem cell markers in pancreatic carcinoma cell lines. Hepatobiliary Pancreat Dis Int. 2007;6:92-97. [PubMed] |
| 5. | Wang J, Guo LP, Chen LZ, Zeng YX, Lu SH. Identification of cancer stem cell-like side population cells in human nasopharyngeal carcinoma cell line. Cancer Res. 2007;67:3716-3724. [PubMed] [DOI] |
| 6. | Haraguchi N, Utsunomiya T, Inoue H, Tanaka F, Mimori K, Barnard GF, Mori M. Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells. 2006;24:506-513. [PubMed] [DOI] |
| 7. | Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, Nakauchi H, Taniguchi H. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties. Hepatology. 2006;44:240-251. [PubMed] [DOI] |
| 8. | Yang ZF, Ngai P, Ho DW, Yu WC, Ng MN, Lau CK, Li ML, Tam KH, Lam CT, Poon RT. Identification of local and circulating cancer stem cells in human liver cancer. Hepatology. 2008;47:919-928. [PubMed] [DOI] |
| 9. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. |
| 10. | Vescovi AL, Galli R, Reynolds BA. Brain tumour stem cells. Nat Rev Cancer. 2006;6:425-436. [PubMed] [DOI] |
| 11. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 12. | Hope KJ, Jin L, Dick JE. Acute myeloid leukemia originates from a hierarchy of leukemic stem cell classes that differ in self-renewal capacity. Nat Immunol. 2004;5:738-743. [PubMed] [DOI] |
| 13. | Beachy PA, Karhadkar SS, Berman DM. Tissue repair and stem cell renewal in carcinogenesis. Nature. 2004;432:324-331. [PubMed] [DOI] |
| 14. | Hirschmann-Jax C, Foster AE, Wulf GG, Nuchtern JG, Jax TW, Gobel U, Goodell MA, Brenner MK. A distinct "side population]of cells with high drug efflux capacity in human tumor cells. Proc Natl Acad Sci U S A. 2004;101:14228-14233. [PubMed] [DOI] |
| 15. | Hemmati HD, Nakano I, Lazareff JA, Masterman-Smith M, Geschwind DH, Bronner-Fraser M, Kornblum HI. Cancerous stem cells can arise from pediatric brain tumors. Proc Natl Acad Sci U S A. 2003;100:15178-15183. [PubMed] [DOI] |
| 16. | Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, Hide T, Henkelman RM, Cusimano MD, Dirks PB. Identification of human brain tumour initiating cells. Nature. 2004;432:396-401. [PubMed] [DOI] |
| 17. | Goodell MA, Rosenzweig M, Kim H, Marks DF, DeMaria M, Paradis G, Grupp SA, Sieff CA, Mulligan RC, Johnson RP. Dye efflux studies suggest that hematopoietic stem cells expressing low or undetectable levels of CD34 antigen exist in multiple species. Nat Med. 1997;3:1337-1345. [PubMed] [DOI] |
| 18. | Jackson KA, Majka SM, Wang H, Pocius J, Hartley CJ, Majesky MW, Entman ML, Michael LH, Hirschi KK, Goodell MA. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells. J Clin Invest. 2001;107:1395-1402. [PubMed] [DOI] |
| 19. | Welm BE, Tepera SB, Venezia T, Graubert TA, Rosen JM, Goodell MA. Sca-1(pos) cells in the mouse mammary gland represent an enriched progenitor cell population. Dev Biol. 2002;245:42-56. [PubMed] [DOI] |
| 20. | Hill RP. Identifying cancer stem cells in solid tumors: case not proven. Cancer Res. 2006;66:1891-1895; discussion 1890. [PubMed] [DOI] |
| 21. | Zen Y, Fujii T, Yoshikawa S, Takamura H, Tani T, Ohta T, Nakanuma Y. Histological and culture studies with respect to ABCG2 expression support the existence of a cancer cell hierarchy in human hepatocellular carcinoma. Am J Pathol. 2007;170:1750-1762. [PubMed] [DOI] |