修回日期: 2009-09-03
接受日期: 2009-09-15
在线出版日期: 2009-10-18
目的: 探讨大肠癌与大肠腺瘤组织中树突状细胞(dendritic cells, DCs)浸润, 了解局部组织的免疫状态对大肠肿瘤发生的影响.
方法: 采用免疫组织化学SP法检测25例大肠癌与31例大肠腺瘤患者肿瘤组织、肿瘤旁组织以及远处正常大肠黏膜中S100+ DCs及CD83+ DCs的浸润.
结果: 大肠癌组织中浸润的S100+ DCs、CD83+ DCs细胞数明显少于癌旁组织、正常组织以及大肠腺瘤组织, 差异均有统计学意义(S100+ DCs细胞数: 15.36±1.78 vs 25.14±2.81, 32.55±2.65, 33.77±3.06; CD83+ DCs细胞数: 2.50±0.60 vs4.91±0.51, 5.68±1.14, 5.39±0.68, 均P<0.05); 大肠腺瘤组织中浸润的S100+ DCs细胞数明显多于腺瘤旁组织与正常组织(均P<0.05), 而CD83+ DCs则无差异.
结论: DCs在大肠肿瘤中的浸润情况有助于了解肿瘤的免疫逃逸及大肠肿瘤发生的机制.
引文著录: 詹俊, 孙小娟, 李楚强, 于钟. S100和CD83阳性树突状细胞与大肠肿瘤微环境的关系. 世界华人消化杂志 2009; 17(29): 3061-3065
Revised: September 3, 2009
Accepted: September 15, 2009
Published online: October 18, 2009
AIM: To investigate the infiltration of S100- and cluster of differentiation 83 (CD83)-positive dendritic cells (DCs) in colorectal carcinoma and adenoma and observe the effect of local immunity on the development of colorectal tumors.
METHODS: Twenty-five colorectal carcinoma patients and 31 colorectal adenoma patients were included in the study. The infiltration of S100+ and CD83+ DCs in tumor, tumor-adjacent and tumor-distant tissues was detected by immunohistochemistry using the streptavidin-peroxidase method.
RESULTS: The number of S100+ DCs and CD83+ DCs were significantly less in colorectal carcinoma than in tumor-adjacent and tumor-distant tissues and colorectal adenoma (S100+ DCs: 15.36 ± 1.78 vs 25.14 ± 2.81, 32.55 ± 2.65 and 33.77 ± 3.06, respectively; CD83+ DCs: 2.50 ± 0.60 vs 4.91 ± 0.51, 5.68 ± 1.14 and 5.39 ± 0.68, respectively; all P < 0.05). The number of S100+ DCs was significantly higher in colorectal adenoma than in tumor-adjacent and tumor-distant tissues (both P < 0.05), while no statistical differences were noted in the number of CD83+ DCs among colorectal adenoma and tumor-adjacent and tumor-distant tissues.
CONCLUSION: Detection of DC infiltration in colorectal tumors is helpful in understanding tumor immune evasion and tumor development.
- Citation: Zhan J, Sun XJ, Li CQ, Yu Z. Infiltration of S100- and cluster of differentiation 83-positive dendritic cells in colorectal tumors. Shijie Huaren Xiaohua Zazhi 2009; 17(29): 3061-3065
- URL: https://www.wjgnet.com/1009-3079/full/v17/i29/3061.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i29.3061
大肠癌是消化系最常见的恶性肿瘤之一, 目前研究表明, 大肠癌的发生涉及局部因素(肿瘤局部微环境)和全身因素(机体免疫系统), 并且肿瘤的发生起初多为局限性疾病, 所以研究肿瘤局部的免疫状态往往更能确切地反映机体的抗肿瘤免疫反应. 树突状细胞(dendritic cells, DCs)是机体内功能最强的抗原递呈细胞(antigen presenting cells, APC), 与肿瘤的发生发展关系密切, 在介导机体的免疫反应、抵御恶性肿瘤中发挥重要作用[1], 其数量的减少和功能的缺陷均可使肿瘤细胞逃避机体的免疫监视, 导致肿瘤的发生发展. 对肿瘤微环境中的DCs, 即肿瘤浸润性DCs(tumor infiltrating dendritic cells, TIDCs)的研究将有助于加深对肿瘤免疫逃逸机制的认识. 大肠腺瘤是目前公认的大肠癌的癌前病变, 研究大肠腺瘤的临床价值在于他与大肠癌有密切的联系. 本研究采用免疫组织化学染色检测S100+ DCs和CD83+ DCs在大肠癌患者以及大肠腺瘤患者肠黏膜组织中的浸润情况, 从而了解大肠肿瘤局部免疫微环境状况, 探讨DCs在大肠肿瘤发生发展过程中的意义.
2007-10/2008-01在中山大学附属第二医院肠镜室行肠镜检查并经病理证实的大肠癌和大肠腺瘤患者. 同患者签署了知情同意书, 留取大肠癌患者的癌组织、癌旁组织以及远离癌肿的正常大肠黏膜, 大肠腺瘤患者的腺瘤组织、腺瘤旁组织和远离腺瘤的正常大肠黏膜. 大肠癌患者25例, 其中结肠癌14例, 直肠癌11例, 男17例, 女8例, 年龄31-74(中位年龄61.5)岁; 大肠腺瘤组31例, 男20例, 女11例, 年龄17-77(中位年龄60)岁. 鼠抗人S100 mAb购自Neomarker公司、鼠抗人CD83 mAb购自AbD serotec公司、SP(过氧化物酶标记的链霉卵白素)免疫组织化学染色试剂盒购自北京中杉金桥.
1.2.1 标本组织制备: 所有留取标本组织经多聚甲醛固定, 常规制备石蜡标本, 4.0 μm厚度连续切片, HE染色明确病理类型. 所有标本组织S100和CD83阳性DCs的浸润情况采用SP免疫组化染色, 操作步骤按试剂盒说明书进行. 切片以柠檬酸缓冲液修复抗原, PBS代替一抗作为阴性对照, DAB显色, 苏木素复染, 切片梯度酒精脱水, 二甲苯透明, 中性树胶封片, 光镜下观察
拍照.
1.2.2 计数标准: DCs缺乏特异的免疫学标记, 目前常根据DCs具有树枝状突起的特殊形态结合免疫学标记来判断确定. 本研究中, 高倍镜(×400)下胞质具有树突状突起, 同时细胞质内或细胞核呈棕褐色颗粒着色, 即可判定为抗体标记阳性的DC. 阳性标记的DCs在肿瘤组织中的浸润程度根据Furukawa et al[2]提出的分级标准: 在低倍镜下选取癌细胞密集区, 更换高倍镜(×400), 计数10个高倍视野内阳性细胞的总数, 0-20个阳性细胞为无-轻度浸润; ≥20个为显著浸润.
统计学处理 采用SPSS11.5软件完成统计分析, 正态分布的计量资料用mean±SD表示, 多组间比较采用方差分析, 两组间比较采用t检验; 计数资料的描述以率表示, 两组比较用四格表资料的χ2检验, 多组比较用R×C表资料的χ2检验, P<0.05(双侧)为差异有统计学意义.
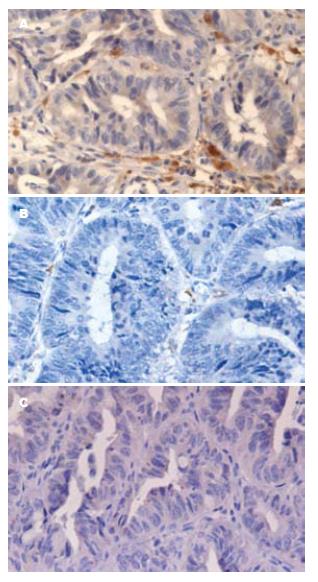
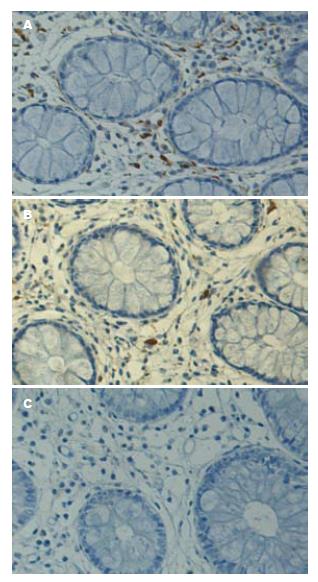
形态学观察可见S100+ DCs和CD83+ DCs呈棕褐色, 单核, 卵圆形或不规则形, 表面可见长短不等、粗细不一和数目不等的突起, 并伴有淋巴细胞的浸润. S100+ DCs散在分布于癌巢、癌旁以及正常大肠黏膜, CD83+ DCs主要分布于癌旁和正常大肠黏膜, 数量较少(图1).
大肠癌组25例中, 在癌组织、癌旁组织和正常组织中, S100+ DCs的阳性浸润率分别为88%(22/25)、100%(25/25)、100%(25/25), 各组间差异有统计学意义(P<0.05); CD83+ DCs阳性浸润率分别是60%(15/25)、80%(20/25)、84%(21/25), 各组间差异无统计学意义(P>0.05); S100+ DCs显著浸润率分别是52%(13/52)、68%(17/25)、84%(21/25), 组织间的差异无统计学意义(P>0.05). 大肠癌组所有组织均无CD83+ DCs的显著浸润. 在癌组织、癌旁组织、正常组织浸润的S100+ DCs细胞数分别是15.36±1.78、25.14±2.81、32.55±2.65, CD83+ DCs细胞数分别是2.50±0.60、4.91±0.51、5.68±1.14, 癌组织S100+DCs和CD83+ DCs细胞数明显低于癌旁组织和正常组织, 差异有统计学意义(P<0.05); 癌旁组织和正常组织S100+ DCs和CD83+DCs细胞数的差异无统计学意义(P>0.05).
大肠腺瘤组中, 所有组织均有S100+ DCs浸润, 其阳性浸润率均为100%; 在大肠腺瘤组织、腺瘤旁组织和正常组织中, S100+ DCs显著浸润率分别是87.1%(27/31)、61.3%(19/31)、51.6%(16/31), 组织间显著浸润率的差异有统计学意义(P<0.05), 且腺瘤组织明显高于腺瘤旁及正常组织, 差异有统计学意义(P<0.05), 腺瘤旁组织和正常组织间的差异无统计学意义(P>0.05); 在腺瘤组织、腺瘤旁组织、正常组织中, S100+ DCs细胞数分别是33.77±3.06、22.42±1.37、19.81±2.10, 组织间的差异有统计学意义(P<0.05), 且腺瘤组织明显高于腺瘤旁和正常组织, 差异有统计学意义(P<0.05); 腺瘤旁组织和正常组织间的差异无统计学意义(P>0.05). 在大肠腺瘤组所有组织中均有CD83+ DCs浸润, 其阳性浸润率为100%, 均无显著浸润; 在腺瘤组织、腺瘤旁组织、正常组织中, CD83+ DCs细胞数分别是5.39±0.68、7.35±1.34、5.19±0.98, 组织间的差异无统计学意义(P>0.05, 图2).
在腺瘤组织和癌组织中, S100+ DCs细胞数分别为33.77±3.06和15.36±1.78, CD83+ DCs细胞数分别为5.39±0.68和2.50±0.60; S100+ DCs阳性浸润率分别100%、88%, CD83+ DCs阳性率浸润分别是100%、60%; S100+ DCs显著浸润率分别是87.1%和52%, 以上S100+ DCs、CD83+ DCs的细胞数、阳性浸润率在腺瘤和癌组织间的差异均有统计学意义(均P<0.05), CD83+ DCs在癌组织和腺瘤组织中均无显著浸润.
DCs作为功能最强的APCs, 在肿瘤抗原的作用下, 经抗原递呈作用(MHC-Ⅰ类分子途径)加工、提呈抗原至T淋巴细胞, 引发肿瘤的免疫反应. 研究表明, 肿瘤组织中TIDCs的数量和功能对机体免疫状况有重要的提示意义. S100是目前最常用于免疫组织化学检测肿瘤浸润DCs的抗体, 能较好的反应DCs的数量, 也是标记大肠癌组织TIDCs的一个可靠指标[3-4], 有报道S100+ DCs数量与肿瘤患者临床病理特点有密切的相关性[5]. 赵春芳 et al[6]报道食管癌癌周组织中的S100的阳性率较癌组织中明显增高, 而且癌前病变组织内的浸润密度也明显增大, 认为这种免疫状态在恶性肿瘤的发生发展过程中起着极其重要的调控作用. 本研究结果显示癌组织中S100+ DCs明显少于癌旁组织和正常组织, 提示大肠癌组织中存在着DCs数量的下降, 其原因可能是由于大肠癌自身缺乏引起DCs浸润的因子或者大肠癌细胞抗原性弱导致的细胞趋化因子不足. 数量减少的DCs不能足量的摄取大肠癌组织抗原, 活性低下DCs的往往不能有效的递呈抗原, 从而使得抗肿瘤的效应T细胞减少, 不能有效的发挥抗肿瘤免疫, 使得肿瘤发生、发展. 本研究也发现大肠腺瘤组织中S100+ DCs明显多于大肠癌组织, 与相关的报到一致, 这可能是由于在肿瘤相对早期阶段, 少量的肿瘤抗原是良好的刺激信号, 使DCs增殖, 数量增多.
随着研究的进一步深入, 发现DCs的抗肿瘤效应与其所处的成熟状态密切相关[7], 成熟DCs是其发挥免疫激发功能的基本条件, 对DCs功能有提示意义[8]. 故局部DCs数量不能反映其免疫功能状况, 有必要使用能反映DCs功能的特异性表面分子作为TIDCs检测指标. DCs表面有大量与功能相关的表面分子, 其中CD83属于免疫球蛋白超家族成员, 高表达于激活状态DCs表面, 被认为是DCs充分成熟、有活性的特异性标志[9-11]. 大量的研究[12]证实CD83的表达相对于常规S100等对患者的预后、病理特点更有说明意义. 因此, CD83作为大肠肿瘤TIDCs的指标更有意义. 本研究显示, 癌组织中CD83+ DCs明显少于癌旁组织和正常大肠黏膜组织, 提示大肠癌局部组织浸润的成熟DCs数量减少, DCs存在成熟障碍, 抗原递呈功能下降, 机体识别大肠肿瘤细胞的能力下降, 致使大肠癌发生发展、转移. 至于肿瘤局部组织成熟DCs减少、功能缺陷的机制可能是: (1)肿瘤细胞可直接诱导成熟的DCs凋亡[13]; (2)肿瘤细胞分泌血管内皮生长因子(vascular endothelial growth factor, VEGF), 可抑制Flt-1诱导DCs转录因子NF-KappaB的激活而致DCs成熟程度降低和功能缺陷[14]; (3)肿瘤细胞分泌IL-10, 可抑制DCs的分化成熟, 下调共刺激分子的表达, 并可抑制DCs在肿瘤内的聚集[15]; (4)肿瘤细胞还分泌TGF-β, 在肿瘤细胞恶性演变时可显著抑制DCs的产生和分化成熟[16].
总之, 大肠癌组织中TIDCs浸润程度下降, 并存在功能障碍, 这反映了大肠癌对肿瘤微环境内DCs免疫功能的抑制作用.
大肠癌的发生涉及肿瘤局部微环境和机体免疫系统, DCs是体内功能最强的抗原递呈细胞, 在介导机体的免疫反应、抵御恶性肿瘤中发挥重要作用, 对肿瘤微环境中的DCs的研究有助于了解大肠肿瘤局部免疫状况, 为临床治疗提供理论依据.
高泽立, 副教授,上海交通大学医学院附属第九人民医院周浦分院消化科.
本研究首次在大肠肿瘤局部研究S100+ DCs和CD+ DCs浸润情况, 从DCs数量和功能上进行综合研究, 弥补了单纯从DCs的数量上研究的不足.
MHC-Ⅰ类分子途径: MHC-Ⅰ类分子主要是经过经典途径呈递细胞内源性抗原. 细胞内抗原降解成肽段后首先以ATP依赖方式与HSP70和HSP90结合, 转移至内质网膜, 与新合成的MHC-Ⅰ类分子形成肽-MHC-Ⅰ类分子复合体, 并最终转运至细胞表面, 供CD8+T细胞识别, 激发免疫应答.
本文从形态学、免疫组织化学探讨DC局部浸润对大肠肿瘤发生发展的影响, 可读性好, 有一定临床指导意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Ishigami S, Aikou T, Natsugoe S, Hokita S, Iwashige H, Tokushige M, Sonoda S. Prognostic value of HLA-DR expression and dendritic cell infiltration in gastric cancer. Oncology. 1998;55:65-69. [PubMed] [DOI] |
| 2. | Furukawa T, Watanabe S, Kodama T, Sato Y, Shimosato Y, Suemasu K. T-zone histiocytes in adenocarcinoma of the lung in relation to postoperative prognosis. Cancer. 1985;56:2651-2656. [PubMed] [DOI] |
| 3. | Ambe K, Mori M, Enjoji M. S-100 protein-positive dendritic cells in colorectal adenocarcinomas. Distribution and relation to the clinical prognosis. Cancer. 1989;63:496-503. [PubMed] [DOI] |
| 4. | Dadabayev AR, Sandel MH, Menon AG, Morreau H, Melief CJ, Offringa R, van der Burg SH, Janssen-van Rhijn C, Ensink NG, Tollenaar RA. Dendritic cells in colorectal cancer correlate with other tumor- infiltrating immune cells. Cancer Immunol Immunother. 2004;53:978-986. [PubMed] [DOI] |
| 6. | 赵 春芳, 张 巍, 田 卫华, 卢 晓梅, 沈 宝菌, 陈 朝伦. 新疆食管癌p53、PCNA表达及S 100+树状细胞浸润的免疫组化研究. 临床与实验病理学杂志. 1999;15:467. |
| 7. | Moser M. Dendritic cells in immunity and tolerance-do they display opposite functions? Immunity. 2003;19:5-8. [PubMed] [DOI] |
| 8. | Aerts-Toegaert C, Heirman C, Tuyaerts S, Corthals J, Aerts JL, Bonehill A, Thielemans K, Breckpot K. CD83 expression on dendritic cells and T cells: correlation with effective immune responses. Eur J Immunol. 2007;37:686-695. [PubMed] [DOI] |
| 9. | Rouard H, Léon A, Klonjkowski B, Marquet J, Tennezé L, Plonquet A, Agrawal SG, Abastado JP, Eloit M, Farcet JP. Adenoviral transduction of human 'clinical grade' immature dendritic cells enhances costimulatory molecule expression and T-cell stimulatory capacity. J Immunol Methods. 2000;241:69-81. [PubMed] [DOI] |
| 10. | Chen S, Akbar SM, Tanimoto K, Ninomiya T, Iuchi H, Michitaka K, Horiike N, Onji M. Absence of CD83-positive mature and activated dendritic cells at cancer nodules from patients with hepatocellular carcinoma: relevance to hepatocarcinogenesis. Cancer Lett. 2000;148:49-57. [PubMed] [DOI] |
| 11. | Kruse M, Rosorius O, Krätzer F, Bevec D, Kuhnt C, Steinkasserer A, Schuler G, Hauber J. Inhibition of CD83 cell surface expression during dendritic cell maturation by interference with nuclear export of CD83 mRNA. J Exp Med. 2000;191:1581-1590. [PubMed] [DOI] |
| 13. | Yang L, Carbone DP. Tumor-host immune interactions and dendritic cell dysfunction. Adv Cancer Res. 2004;92:13-27. [PubMed] [DOI] |
| 14. | Della Porta M, Danova M, Rigolin GM, Brugnatelli S, Rovati B, Tronconi C, Fraulini C, Russo Rossi A, Riccardi A, Castoldi G. Dendritic cells and vascular endothelial growth factor in colorectal cancer: correlations with clinicobiological findings. Oncology. 2005;68:276-284. [PubMed] [DOI] |
| 15. | Girolomoni G, Ricciardi-Castagnoli P. Dendritic cells hold promise for immunotherapy. Immunol Today. 1997;18:102-104. [PubMed] [DOI] |
| 16. | Matsushita M, Matsuzaki K, Date M, Watanabe T, Shibano K, Nakagawa T, Yanagitani S, Amoh Y, Takemoto H, Ogata N. Down-regulation of TGF-beta receptors in human colorectal cancer: implications for cancer development. Br J Cancer. 1999;80:194-205. [PubMed] [DOI] |