修回日期: 2009-09-23
接受日期: 2009-10-12
在线出版日期: 2009-10-18
目的: 检测核转录因子FOXP3在胃癌患者体内的表达情况及其临床意义.
方法: 使用RT-PCR检测30例胃癌患者外周血单个核细胞(PBMC)和肿瘤组织淋巴细胞中FOXP3 mRNA表达, 与20例健康志愿者PBMC及20例病灶旁正常胃组织淋巴细胞中FOXP3 mRNA的表达进行对比和统计分析. 采用免疫组织化学SP法检测30例胃癌组织和20例正常胃组织中FOXP3蛋白表达.
结果: FOXP3 mRNA在胃癌患者PBMC和胃癌组织淋巴细胞中的表达明显高于其在健康对照组PBMC和正常胃组织淋巴细胞中的表达(t= 25.615, 23.894, 均P<0.01). FOXP3蛋白在胃癌组织中的的表达显著其在高于正常胃组织中的表达(t = 4.868, P<0.01).
结论: 高表达的FOXP3可能导致胃癌细胞免疫逃逸, 参与胃癌的发展过程.
引文著录: 袁甲翔, 张谢夫, 赵春临, 吕新全, 郭晓磊. 核转录因子FOXP3在胃癌患者体内的表达及意义. 世界华人消化杂志 2009; 17(29): 3052-3055
Revised: September 23, 2009
Accepted: October 12, 2009
Published online: October 18, 2009
AIM: To investigate the expression of forkhead box P3 (FOXP3) mRNA and protein in gastric cancer and analyze its clinical significance.
METHODS: Thirty gastric cancer patients and 20 healthy volunteers were included in the study. The expression of FOXP3 mRNA in peripheral blood mononuclear cells (PBMCs) from gastric cancer patients and lymphocytes isolated from gastric cancer tissues was detected by reverse transcription-polymerase chain reaction (RT-PCR). The expression of FOXP3 protein in gastric cancer tissue was detected by immunohistochemistry.
RESULTS: The expression levels of FOXP3 mRNA in PBMCs from patients with gastric cancer and lymphocytes from gastric cancer tissues were significantly higher than those in PBMCs from healthy volunteers and lymphocytes from normal gastric tissues (t = 25.615 and 23.894, respectively, both P < 0.01), respectively. The expression level of FOXP3 protein in gastric cancer tissue was significantly higher than that in normal gastric tissue (t = 4.868, P < 0.01).
CONCLUSION: High expression of FOXP3 may lead to immune escape in gastric cancer and is involved in its development and progression.
- Citation: Yuan JX, Zhang XF, Zhao CL, Lv XQ, Guo XL. Clinical significance of forkhead box P3 expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(29): 3052-3055
- URL: https://www.wjgnet.com/1009-3079/full/v17/i29/3052.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i29.3052
转录因子家族FOXP是一个以具有叉头螺旋结构(forkhead/winged helix, FKH)为特征, 功能各异的大家族. Brunkow et al[1]于2001年在scurfy小鼠体内发现了FOXP3基因的突变. 随后的研究证明FOXP3主要表达于CD4+CD25+ Treg细胞, 是CD4+CD25+ Treg细胞发育和功能作用的关键分子[2], 在自身免疫、肿瘤免疫等疾病的发生发展过程中起到了至关重要的作用[3]. FOXP3基因编码产物scurfin蛋白, 其功能结构主要包括C端forkhead DNA结合区, N端的C2H2锌指结构和亮氨酸拉链基序. 最新研究指出, FOXP3可能通过其他途径来调节肿瘤细胞的生长, 不仅仅是CD4+CD25+ Treg细胞的表面标志物[4], 提示FOXP3在肿瘤的发生发展中有重要的作用. 本试验在于探讨FOXP3在胃癌中的表达及其意义, 为胃癌的免疫治疗提供依据.
收集2008-03/10郑州大学第一附属医院30例胃癌患者外周血, 手术切除的胃癌组织和病变远处20例正常胃组织, 同时抽取20例健康志愿者的外周血作为阳性对照. 所有患者术前均未接受化疗和放疗, 全部病例均经病理证实. 30例胃癌中, 男21例, 女9例, 按TNM分期Ⅱ期10例、Ⅲ期16例、Ⅳ期4例; 年龄34-79(平均55±16)岁; 肿瘤分化程度: 高分化腺癌7例, 中分化腺癌11例, 低分化腺癌12例; 区域性淋巴结转移: 阴性者13例, 阳性者17例; 所有病例均无远处转移. TRIzol Reagent(Invitrogen)、淋巴细胞分离液(天津市灏洋生物制品有限公司)、Reverse Transcription System(Promega)、GoTaq Green Master Mix(Promega)、DNA marker(天根)、Affinity Purified anti-human Foxp3(ebioscience)、SP-9002免疫组织化学染色试剂盒(中杉金桥)、DAB显色试剂盒(福建迈新)、引物合成(上海捷瑞)、德国Leica图像采集系统、高速台式冷冻离心机(美国Beckman公司)梯度PCR仪(美国BIORAD公司)、紫外分光光度计U-3010(日立).
1.2.1 淋巴细胞提取: 抽取静脉血2 mL, EDTA抗凝, 应用淋巴细胞分离液分离出外周血PBMC; 将液氮冻存组织取出后充分研磨筛网过滤, 利用淋巴细胞分离液密度梯度离心后收集组织中的淋巴细胞.
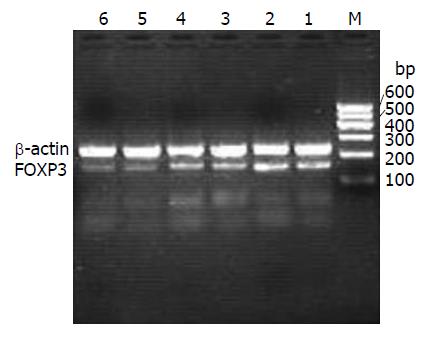
1.2.2 RT-PCR检测FOXP3 mRNA表达: 利用TRIzol提取淋巴细胞中的RNA, 逆转录获取cDNA后进行扩增. FOXP3上游引物: 5'-CAGCACATTCCCAGAGTTCCTC-3', 下游引物: 5'-GCGTGTGAACCAGTGGTAGATC-3'. β-actin上游引物: 5'-AGCACTGTGTTGGCG TACAG-3', 下游引物5'-GGACTTCGAGCAAGAGATG-3'. PCR循环条件: 变性: 95℃ 5 min; 95℃ 45 s, 54℃ 45 s, 72℃ 60 s扩增35个循环; 最后72℃ 5 min延伸. 电泳结果采用凝胶分析, 用FOXP3/β-actin半定量表示FOXP3 mRNA的相对水平.
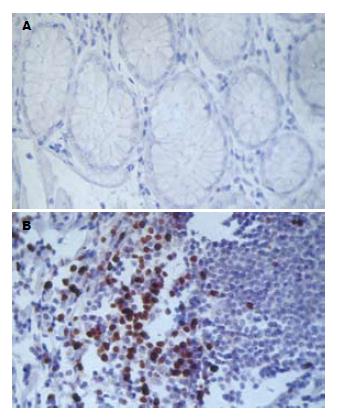
1.2.3 免疫组织化学SP法检测FOXP3蛋白表达: 石蜡包埋组织块后进行切片, 切片厚度为4 μm. 采用链霉素生物素(SP)免疫组织化学技术, 一抗工作浓度为1:50, 微波修复, 实验步骤按试剂盒说明书进行. 将已知的扁桃体阳性切片作阳性对照, 用PBS液代替一抗作阴性对照, 同一条件下行SP染色.
统计学处理 采用SPSS13.0统计软件进行统计学处理实验数据, 分析采用t检验, 以P<0.05为差异有统计学意义.
胃癌组织淋巴细胞和正常胃组织淋巴细胞中均有FOXP3 mRNA的表达, 半定量比值其均值分别为0.5631和0.3021, 两者之间有显著差异(t = 23.894, P<0.01, 图1).
胃癌患者PBMC和健康志愿者PBMC中均有FOXP3 mRNA的表达, 半定量比值其均值分别为0.6089和0.3261, 两者之间有显著差异(t = 25.615, P<0.01, 图1).
FOXP3着色位于淋巴细胞核内, 以淋巴细胞胞核内出现紫褐色颗粒染色视为阳性染色. 对于每一张切片, 由2位病理医师在400倍视野下双盲随机记数5个视野, 记录阳性细胞数, 以阳性细胞数来比较FOXP3蛋白的表达. 正常胃组织阳性细胞数平均值6.35(0-59), 胃癌组织中阳性细胞数平均值52.87(4-267), 2组之间有显著差异(t = 4.868, P<0.01, 图2).
30例胃癌患者术后病理证实17位有淋巴结转移, 13位无淋巴结转移. 有淋巴结转移的患者其胃癌组织淋巴细胞, 外周血中FOXP3 mRNA的平均A值分别为0.5672和0.6150, 阳性细胞均值65.82; 无淋巴结转移的患者其胃癌组织淋巴细胞, 外周血中FOXP3 mRNA的平均A值分别为0.5578和0.6008, 阳性细胞均值35.92. 相互比较均无统计学意义, 但是有淋巴结转移的患者其FOXP3 mRNA和蛋白的表达有增高的趋势.
高、中、低分化腺癌FOXP3 mRNA和蛋白表达无统计学意义, 但中低分化腺癌组织中的表达较高分化腺癌组织有增高的趋势.
胃癌是严重危害人类健康的最常见的恶性肿瘤之一, 手术切除是目前唯一可能根治的方法. 但是对于进展期胃癌患者单纯外科手术无法达到生物学意义上的根治, 即便是扩大胃切除和淋巴结清扫的范围, 多数患者最终仍然复发转移. 相对手术而言, 目前胃癌的化疗效果也有限, 并且缺乏一致公认的"金标准"方案. 因此, 积极寻求其他可能根治肿瘤的手段和方法, 是目前探索的热点方向. 肿瘤的免疫逃逸导致的机体对肿瘤的免疫无应答或免疫反应低下是肿瘤发生发展的重要因素之一. FOXP3作为CD4+CD25+Treg细胞发育和功能的决定因素, 在肿瘤的免疫逃逸中起到了十分重要的作用. 本实验从肿瘤免疫逃逸方面对FOXP3进行了研究, 希望能为今后的免疫治疗提供新的途径.
调节性T细胞在维持机体免疫平衡, 防止过度免疫应答对机体的损伤等方面发挥着重要作用. Liyanage et al[5]在乳腺癌和胰腺癌中的研究证实CD4+CD25+ Treg细胞不仅在肿瘤微环境中升高, 在外周血中同样也有所升高. 目前很多研究均发现在许多数实体肿瘤中, 如卵巢癌、肺癌、胃癌、结肠癌、肝癌等多种肿瘤患者肿瘤局部或外周血中, CD4+CD25+ Treg细胞的表达比例增高, 且数量与患者肿瘤进展程度和预后呈负相关[6]. 我们在对胃癌组织淋巴细胞和正常胃组织淋巴细胞的检测中发现, 无论mRNA或蛋白质, 胃癌组织中FOXP3的表达均高于正常胃组织中的表达水平, 差异显著, 具有统计学意义. 提示胃癌组织与正常胃组织中淋巴细胞的免疫程度是有差别的. 胃癌患者外周血单个核细胞中FOXP3 mRNA的表达高于健康志愿者, 提示胃癌患者整体的免疫程度和健康志愿者有所差别. 这表明在胃癌患者体内, 局部和整体的免疫功能都有所改变, 从而影响胃癌的发展. Perrone et al[7]的研究发现FOXP3蛋白的高表达与胃癌的淋巴、血管、周围神经侵袭和预后不良有关, 提示在胃癌发展过程中随病情进展免疫逃逸可能进一步加强, 又导致了疾病进一步进展. 虽然作者研究FOXP3在有无淋巴结转移和不同分化程度胃癌的检测中没有得到统计学上的差异, 但是有淋巴结转移的患者其FOXP3 mRNA和蛋白的表达较无淋巴结转移的患者有增高的趋势, 而中、低分化腺癌中FOXP3 mRNA和蛋白的表达也有高于高分化组表达的趋势. 这些结果提示肿瘤的恶性程度与肿瘤细胞免疫逃逸有一定的相关性, 增加样本数量和完善相关检查方法可能会获得更加明确的结果.
在我们的研究中, 胃癌组织和胃癌患者的外周血中均有FOXP3 mRNA的相对高表达, 而Zuo et al[8]在乳腺癌则中发现FOXP3能和HER-2/ErbB2基因的启动子结合抑制HER-2/ErbB2基因的表达, 致癌基因HER-2/ErbB2的过表达总是伴随着FOXP3基因的下调. 进一步的研究证明FOXP3亦能对致癌基因SKP2起到抑制作用[9], 这提示FOXP3在不同的肿瘤中可能通过不同途径来参与调节肿瘤的发生、发展. 根据作者的研究结果和其他相关研究表明, 高表达的FOXP3或许可以作为导致肿瘤免疫逃逸的免疫抑制环境的标志, 但对FOXP3作用的机制还有待于进一步的研究. Huter et al[10]通过转导FOXP3+ Treg细胞进入新出生的患有淋巴细胞增殖性疾病的scurfy小鼠起到了抑制淋巴细胞增殖性疾病发生的作用, 提示FOXP3能抑制机体的免疫反应. Cuadrado et al[11]研究发现粒单核细胞吸附血浆分离置换法导致的CD4+CD25+FOXP3+的升高或许是炎症性肠炎病情缓和的有效指标. 选择性的减少Treg细胞甚至FOXP3的表达以减少肿瘤免疫逃逸的发生或许是将来胃癌免疫治疗的一个新的途径.
胃癌是严重危害人类健康的最常见的恶性肿瘤之一, 其发病率在消化系肿瘤中居于第1位, 手术和化疗对于胃癌的治疗效果一直都不尽如人意. 积极寻求其他可能根治肿瘤的手段和方法是目前探索的方向.
樊晓明, 主任医师, 复旦大学附属金山医院消化科.
FOXP3作为CD4+CD25+ Treg细胞发育和功能的决定因素, 在肿瘤的免疫逃逸中起到了十分重要的作用. 目前, 我国在肿瘤的免疫治疗领域尚处于起步阶段.
本试验研究发现胃癌组织和胃癌患者外周血中FOXP3的表达均高于正常胃组织和健康志愿者外周血中FOXP3的表达, 提示胃癌患者体内局部和整体的免疫功能都有所改变, 从而影响胃癌的发展. 期望为胃癌的免疫治疗提供一个新的途径.
本研究立题较新颖, 设计合理, 为进一步研究FOXP3在胃癌发生中的可能作用或针对FOXP3作为靶点治疗胃癌提供了基础.
编辑: 李军亮 电编:何基才
| 1. | Brunkow ME, Jeffery EW, Hjerrild KA, Paeper B, Clark LB, Yasayko SA, Wilkinson JE, Galas D, Ziegler SF, Ramsdell F. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat Genet. 2001;27:68-73. [PubMed] [DOI] |
| 2. | Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003;299:1057-1061. [PubMed] [DOI] |
| 3. | Fontenot JD, Rudensky AY. A well adapted regulatory contrivance: regulatory T cell development and the forkhead family transcription factor Foxp3. Nat Immunol. 2005;6:331-337. [PubMed] [DOI] |
| 4. | Ziegler SF. FOXP3: not just for regulatory T cells anymore. Eur J Immunol. 2007;37:21-23. [PubMed] [DOI] |
| 5. | Liyanage UK, Moore TT, Joo HG, Tanaka Y, Herrmann V, Doherty G, Drebin JA, Strasberg SM, Eberlein TJ, Goedegebuure PS. Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma. J Immunol. 2002;169:2756-2761. [PubMed] |
| 7. | Perrone G, Ruffini PA, Catalano V, Spino C, Santini D, Muretto P, Spoto C, Zingaretti C, Sisti V, Alessandroni P. Intratumoural FOXP3-positive regulatory T cells are associated with adverse prognosis in radically resected gastric cancer. Eur J Cancer. 2008;44:1875-1882. [PubMed] [DOI] |
| 8. | Zuo T, Wang L, Morrison C, Chang X, Zhang H, Li W, Liu Y, Wang Y, Liu X, Chan MW. FOXP3 is an X-linked breast cancer suppressor gene and an important repressor of the HER-2/ErbB2 oncogene. Cell. 2007;129:1275-1286. [PubMed] [DOI] |
| 9. | Zuo T, Liu R, Zhang H, Chang X, Liu Y, Wang L, Zheng P, Liu Y. FOXP3 is a novel transcriptional repressor for the breast cancer oncogene SKP2. J Clin Invest. 2007;117:3765-3773. [PubMed] [DOI] |
| 10. | Huter EN, Punkosdy GA, Glass DD, Cheng LI, Ward JM, Shevach EM. TGF-beta-induced Foxp3+ regulatory T cells rescue scurfy mice. Eur J Immunol. 2008;38:1814-1821. [PubMed] [DOI] |
| 11. | Cuadrado E, Alonso M, de Juan MD, Echaniz P, Arenas JI. Regulatory T cells in patients with inflammatory bowel diseases treated with adacolumn granulocytapheresis. World J Gastroenterol. 2008;14:1521-1527. [PubMed] [DOI] |